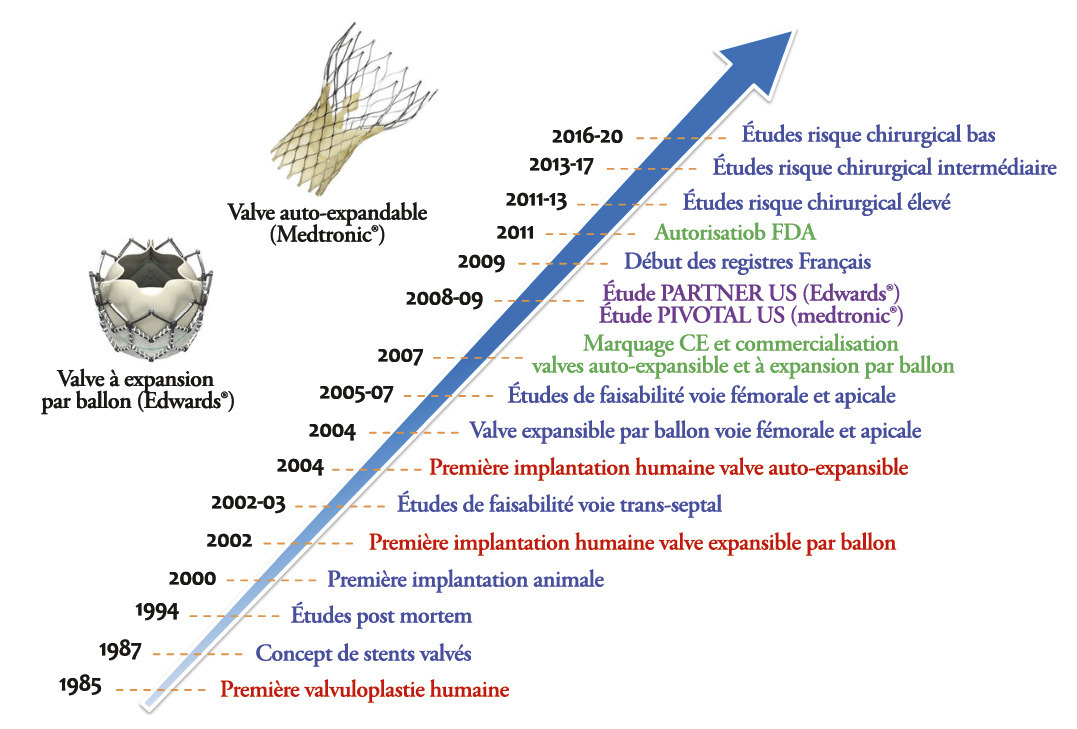
L’implantation d’une valve aortique par voie percutanée (TAVI, pour transcatheter aortic valve implantation) était initialement indiquée aux patients symptomatiques atteints de rétrécissement aortique calcifié (RAc) pour lesquels aucune prise en charge chirurgicale conventionnelle de remplacement valvulaire aortique (RVA) ne pouvait être proposée, en raison de comorbidités ou d’une espérance de vie réduite. Depuis la première implantation percutanée chez l’homme, la validation scientifique de la TAVI, menée étape par étape, a conduit à un véritable bouleversement dans la prise en charge des patients ayant un RAc symptomatique.
Concept né dans les années 1980
Avant la TAVI, 30 à 40 % des patients porteurs d’un RAc symptomatique n’étaient pas opérés pour des raisons diverses, allant du refus de l’opération de RVA par le patient à la récusation par l’équipe médicochirurgicale face à de multiples comorbidités ou une impossibilité technique.¹ De plus, le taux de mortalité à deux ans de ces patients après l’apparition des premiers symptômes était prohibitif, de l’ordre de 50 %.² Une solution thérapeutique était donc impérative afin de prendre en charge ces patients non opérés. Les options possibles étaient soit le traitement médicamenteux (qui malheureusement n’apportait pas d’amélioration de survie), soit la valvuloplastie aortique au ballon. Réalisée depuis 1985, c’est une technique rapide et efficace mais où la resténose aortique survient dans 80 % des cas à un an.
Dès la fin des années 1980, le concept de valve aortique implantable par voie percutanée se fait jour pour pallier cette resténose post-valvuloplastie (figure ).
Dès la fin des années 1980, le concept de valve aortique implantable par voie percutanée se fait jour pour pallier cette resténose post-valvuloplastie (
Amélioration technique et sélection des patients
Après des études de faisabilité puis des implantations chez l’animal, la première valve percutanée à expansion par ballon est implantée chez l’homme par l’équipe du Pr Alain Cribier à Rouen, le 16 avril 2002, par voie trans-septale. Très rapidement après cette première mondiale, le matériel mais également les techniques d’implantation évoluent pour permettre l’implantation de valves percutanées par la voie apicale et fémorale, grâce au développement des systèmes de délivrance rétrograde.
Les premières implantations de TAVI par ces deux voies, chez des patients au risque opératoire extrême, obtiennent des résultats cliniques initiaux très encourageants. Toutefois, ils sont marqués par des complications spécifiques à chaque voie d’abord. La voie artérielle fémorale, qui s’impose rapidement comme la plus utilisée, entraîne des complications liées soit au site de ponction (hémorragies, dissections), soit au risque d’accidents vasculaires cérébraux per-procéduraux. Pour les réduire, et limiter le recours à la voie apicale, de multiples améliorations ont été proposées.
Ce perfectionnement se manifeste à plusieurs niveaux :
Améliorations technologiques. Le diamètre de la valve, une fois sertie dans son support, a été réduit, de même que celui des cathéters d’introduction (désilets), dont la souplesse a aussi été augmentée afin de limiter le traumatisme vasculaire artériel. Enfin, certains systèmes de délivrance de la valve ont désormais la possibilité d’orienter leur distalité afin de limiter la friction de la valve contre l’arche aortique, diminuant ainsi le risque d’embols cérébraux.
Sélection des patients. L’adaptation du choix du matériel en fonction des personnes a été une avancée majeure. Pour cela, les équipes analysent des paramètres cliniques (antécédents d’accident coronarovasculaire, d’anévrisme de l’aorte abdominale) et réalisent un scanner préthérapeutique systématique de l’ensemble de l’aorte, des axes vasculaires et de l’aire cardiaque.
Courbe d’apprentissage. Le partage d’expérience et l’anticipation des complications ont été et restent encore des éléments clés dans la progression de l’utilisation de la TAVI.
Développement de programmes spécifiques pour la TAVI. L’amélioration n’a été possible que par la mise en place d’équipes pluridisciplinaires et le développement de « heart teams », permettant une prise en charge globale du patient, de sa sélection au suivi post-procédural à long terme.
Plus récemment, d’autres innovations technologiques ont été apportées afin d’améliorer encore les résultats cliniques et de réduire les complications, notamment via l’ajout de tissu sous forme de « jupette » à la base de la valve, en regard du versant de la chambre de chasse du ventricule gauche, qui diminue l’incidence des fuites périprothétiques post-implantation.
Les premières implantations de TAVI par ces deux voies, chez des patients au risque opératoire extrême, obtiennent des résultats cliniques initiaux très encourageants. Toutefois, ils sont marqués par des complications spécifiques à chaque voie d’abord. La voie artérielle fémorale, qui s’impose rapidement comme la plus utilisée, entraîne des complications liées soit au site de ponction (hémorragies, dissections), soit au risque d’accidents vasculaires cérébraux per-procéduraux. Pour les réduire, et limiter le recours à la voie apicale, de multiples améliorations ont été proposées.
Ce perfectionnement se manifeste à plusieurs niveaux :
Améliorations technologiques. Le diamètre de la valve, une fois sertie dans son support, a été réduit, de même que celui des cathéters d’introduction (désilets), dont la souplesse a aussi été augmentée afin de limiter le traumatisme vasculaire artériel. Enfin, certains systèmes de délivrance de la valve ont désormais la possibilité d’orienter leur distalité afin de limiter la friction de la valve contre l’arche aortique, diminuant ainsi le risque d’embols cérébraux.
Sélection des patients. L’adaptation du choix du matériel en fonction des personnes a été une avancée majeure. Pour cela, les équipes analysent des paramètres cliniques (antécédents d’accident coronarovasculaire, d’anévrisme de l’aorte abdominale) et réalisent un scanner préthérapeutique systématique de l’ensemble de l’aorte, des axes vasculaires et de l’aire cardiaque.
Courbe d’apprentissage. Le partage d’expérience et l’anticipation des complications ont été et restent encore des éléments clés dans la progression de l’utilisation de la TAVI.
Développement de programmes spécifiques pour la TAVI. L’amélioration n’a été possible que par la mise en place d’équipes pluridisciplinaires et le développement de « heart teams », permettant une prise en charge globale du patient, de sa sélection au suivi post-procédural à long terme.
Plus récemment, d’autres innovations technologiques ont été apportées afin d’améliorer encore les résultats cliniques et de réduire les complications, notamment via l’ajout de tissu sous forme de « jupette » à la base de la valve, en regard du versant de la chambre de chasse du ventricule gauche, qui diminue l’incidence des fuites périprothétiques post-implantation.
Validation scientifique par strate
Le concept d’implantation d’une valve aortique percutanée est dit « disruptif », c’est-à-dire qu’il crée une véritable rupture au sein de la prise en charge des patients porteurs d’un RAc serré symptomatique. À l’opposé d’un développement médical « classique », où l’utilisation d’un traitement interventionnel est initialement adressé aux sujets sans ou avec peu de comorbidités, puis secondairement évalué dans des sous-groupes de population à risque (comme l’angioplastie coronarienne), la TAVI a bénéficié d’emblée d’une évaluation sur des patients très à risque et comorbides. Progressivement, elle a été expérimentée sur les patients à plus faible risque pour maintenant être proposée à ceux à faible risque chirurgical.
Les résultats de l’étude américaine randomisée PARTNER US avec la valve à expansion par ballon ont confirmé l’important bénéfice de la TAVI chez les patients non opérables (réduction de mortalité de 20 % à un an)³ mais également chez ceux à haut risque chirurgical, avec une mortalité similaire entre TAVI ou RVA⁴. En France, le registre FRANCE 2, publié en 2012, rapporte les premiers résultats dans la vraie vie sur les deux modèles de valves disponibles, pour des patients à haut risque opératoire.⁵ Secondairement (publication en 2016-2017), la non-infériorité de la TAVI par rapport au RVA a été démontrée pour les patients à risque opératoire intermédiaire. Par la suite, sa supériorité à court terme par rapport au RVA a été prouvée avec les deux types de valves. Dans le groupe TAVI, ces études randomisées ont objectivé une récupération post-intervention plus rapide, ainsi qu’une qualité de vie et un statut fonctionnel NYHA meilleurs.
Les résultats de l’étude américaine randomisée PARTNER US avec la valve à expansion par ballon ont confirmé l’important bénéfice de la TAVI chez les patients non opérables (réduction de mortalité de 20 % à un an)³ mais également chez ceux à haut risque chirurgical, avec une mortalité similaire entre TAVI ou RVA⁴. En France, le registre FRANCE 2, publié en 2012, rapporte les premiers résultats dans la vraie vie sur les deux modèles de valves disponibles, pour des patients à haut risque opératoire.⁵ Secondairement (publication en 2016-2017), la non-infériorité de la TAVI par rapport au RVA a été démontrée pour les patients à risque opératoire intermédiaire. Par la suite, sa supériorité à court terme par rapport au RVA a été prouvée avec les deux types de valves. Dans le groupe TAVI, ces études randomisées ont objectivé une récupération post-intervention plus rapide, ainsi qu’une qualité de vie et un statut fonctionnel NYHA meilleurs.
Où en est-on en 2021 ?
Actuellement, la prise en charge d’un patient porteur d’un RAc symptomatique inclut une évaluation clinique, biologique, échocardiographique, angiographique et scanographique. Le but est d’évaluer le niveau de risque opératoire en prenant en compte l’ensemble des principales comorbidités.
Ensuite, une équipe multidisciplinaire « heart team » propose au patient la meilleure option thérapeutique : TAVI, chirurgie classique ou traitement médical.
Ensuite, une équipe multidisciplinaire « heart team » propose au patient la meilleure option thérapeutique : TAVI, chirurgie classique ou traitement médical.
Limites résiduelles
De nombreuses réponses techniques ou humaines ont déjà été apportées aux initiales limitations de la TAVI (v. supra).
La durabilité à long terme des valves percutanées demeure la principale inconnue. En effet, comme les bioprothèses aortiques chirurgicales, elles peuvent dégénérer via plusieurs mécanismes :
– calcifications passives secondaires ;
– thromboses valvulaires infracliniques, favorisant le développement d’inflammations et de calcifications ;
– autres mécanismes délétères : insuffisance rénale chronique ou hyperparathyroïdie.
À ce jour, le recul sur la durabilité des bioprothèses percutanées est limité, compte tenu du développement récent de la technique par rapport à la chirurgie, mais également du fait que la population initiale ayant bénéficié de TAVI était à très haut risque et âgée, avec une mortalité spontanée élevée.
Le taux de détérioration hémodynamique sévère (≈ modification des paramètres échocardiographiques) est estimé à 2,5 % à cinq ans selon les registres français.
La durabilité à long terme des valves percutanées demeure la principale inconnue. En effet, comme les bioprothèses aortiques chirurgicales, elles peuvent dégénérer via plusieurs mécanismes :
– calcifications passives secondaires ;
– thromboses valvulaires infracliniques, favorisant le développement d’inflammations et de calcifications ;
– autres mécanismes délétères : insuffisance rénale chronique ou hyperparathyroïdie.
À ce jour, le recul sur la durabilité des bioprothèses percutanées est limité, compte tenu du développement récent de la technique par rapport à la chirurgie, mais également du fait que la population initiale ayant bénéficié de TAVI était à très haut risque et âgée, avec une mortalité spontanée élevée.
Le taux de détérioration hémodynamique sévère (≈ modification des paramètres échocardiographiques) est estimé à 2,5 % à cinq ans selon les registres français.
Références
1. Iung B, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal 2003;24:1231-43.
2. Ross J Jr Braunwald E Aortic stenosis, Circulation 1968;38 (suppl. 1).
3. Leon MB, Smith CR, Mack M, et al. for the PARTNER Trial investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597-607.
4.Smith CR, Leon MB, Mack M, et al. for the PARTNER Trial investigators.Transcatheter versus aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
5. Gilard M, Eltchaninoff H, Iung B, et al. Registry of transcatheter aortic-valve implantation in high-risk patients.N Engl J Med 2012;366(18):1705-15.
2. Ross J Jr Braunwald E Aortic stenosis, Circulation 1968;38 (suppl. 1).
3. Leon MB, Smith CR, Mack M, et al. for the PARTNER Trial investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597-607.
4.Smith CR, Leon MB, Mack M, et al. for the PARTNER Trial investigators.Transcatheter versus aortic-valve replacement in high-risk patients. N Engl J Med 2011;364:2187-98.
5. Gilard M, Eltchaninoff H, Iung B, et al. Registry of transcatheter aortic-valve implantation in high-risk patients.N Engl J Med 2012;366(18):1705-15.