Connaître les principes de réalisation, transmission et utilisation des prélèvements à visée sanitaire et de recherche.
Les services d’anatomie et cytologie pathologiques sont assez souvent mal connus du médecin clinicien, radiologue ou biologiste.
Dans certaines maquettes de cursus d’internat de spécialité, un semestre dans ce service est fortement recommandé, notamment en hématologie, dermatologie ou néphrologie… Ce stage familiarise l’interne avec des principes majeurs : devenir du prélèvement après le geste chirurgical, biopsique ou la ponction de liquide, qui conditionne la qualité du rendu diagnostique par le pathologiste ; visualisation au microscope des lésions histologiques élémentaires et spécifiques qui permet une meilleure compréhension de la pathologie à traiter.
Ce chapitre rappelle les modalités optimales et recommandées d’envoi des prélèvements au service d’anatomie et cytologie pathologiques, les principes de base des techniques morphologiques utilisées : cytologie, histologie, immunohistochimie, hybridation in situ mais aussi des techniques complémentaires de cytométrie en flux et de biologie moléculaire, techniques non morphologiques sur les prélèvements tissulaires ou cellulaires, ainsi que leurs principales indications. Enfin, les principales indications de l’examen extemporané sont rappelées ainsi que son principe de réalisation, ses limites et la rédaction du compte-rendu. Le diagnostic anatomopathologique est un diagnostic multidisciplinaire. Le dialogue entre pathologiste et clinicien est essentiel. Par exemple, en hématopathologie, le diagnostic doit tenir compte de la présentation clinique, des antécédents du patient, personnels et familiaux, du bilan biologique et d’imagerie : âge, déficit immunitaire connu, primitif ou secondaire (chimiothérapie d’un cancer solide), pathologie dysimmunitaire connue, statut viral (virus d’Epstein-Barr, virus de l’hépatite C, VIH), agent pathogène bactérien (Helicobacter pylori, Campylobacter jejuni), hémogramme, ionogramme, électrophorèse des protéines sériques, myélogramme… En dermatopathologie, l’aspect clinique de la lésion biopsiée est important.
Des prélèvements peuvent être stockés congelés, dans le but d’un complément diagnostique mais également à visée potentielle de recherche ; nous rappellerons les conditions nécessaires à l’utilisation de ces prélèvements dans des travaux de recherche scientifique fondamentale et translationnelle médicale.
Le diagnostic anatomopathologique est dépendant de la qualité du prélèvement (acheminement rapide dans les conditions adéquates), de sa représentativité, de l’histologie, de la cytologie, de l’immunophénotype, mais aussi de techniques complémentaires biologiques, comme la cytogénétique des tumeurs, les études de biologie moléculaire sur prélèvements frais, congelés ou fixés en formol et inclus en paraffine, de la présence d’un agent pathogène bactérien ou viral. Tous ces éléments doivent être décrits et notifiés dans le compte-rendu.
Modalités de transmission des prélèvements au service d’anatomie et cytologie pathologiques
Tout prélèvement doit être acheminé rapidement vers le laboratoire d’accueil, c’est la règle et le critère qui déterminent la qualité de l’examen anatomopathologique. Le prélèvement doit être placé dans un récipient stérile ou propre, scellé. Les délais d’acheminement des prélèvements doivent impérativement être respectés. Les prélèvements transmis à l’état frais (liquides biologiques, sang, biopsies à l’aiguille, biopsies chirurgicales, pièces opératoires) sont soumis à des délais d’acheminement pouvant s’étendre de 0 à 24 heures, sous réserve de modalité particulière de conservation, à + 4 °C ou à température ambiante. Un prélèvement sanguin doit être adressé en moins de 4 heures et à température ambiante. Un prélèvement tissulaire doit être envoyé immédiatement ; il peut éventuellement être conservé au frais à + 4 °C dans le flacon de prélèvement ou sous vide à + 4 °C pendant plusieurs heures. Ces délais sont protocolaires, tout préleveur doit les connaître. D’un manière générale, le délai d’acheminement doit être le plus court possible.
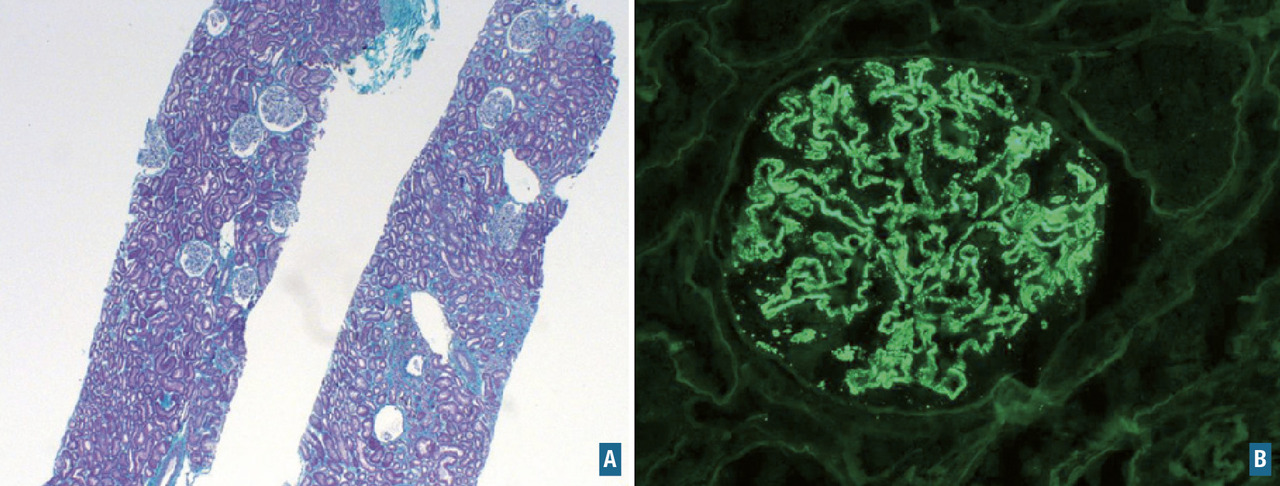
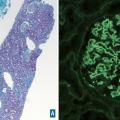
Pour les transmissions de prélèvements sur une longue distance (territoires d’outre-mer par exemple), le liquide de Michel préserve l’antigénicité des tissus, pour une étude d’immunofluorescence notamment (exemple de la biopsie rénale ou cutanée).
L’heure du prélèvement doit être notée sur la feuille de transmission. Un maximum de renseignements cliniques ou paracliniques (biologie, imagerie…) est communiqué afin d’optimiser l’interprétation. Selon l’importance et l’urgence du prélèvement, le pathologiste doit être préalablement prévenu (courriel, téléphone, réunion de concertation pluridisciplinaire).
Prise en charge du prélèvement à l’état frais et fixation
Avant même de réaliser l’examen macroscopique du prélèvement, il faut savoir tenir compte de sa nature et de son siège. La biopsie-exérèse est l’examen de choix. La ponction cytologique est un examen d’orientation, parfois utile, mais à compléter par une biopsie si elle est non contributive ou si une lésion maligne est suspectée.
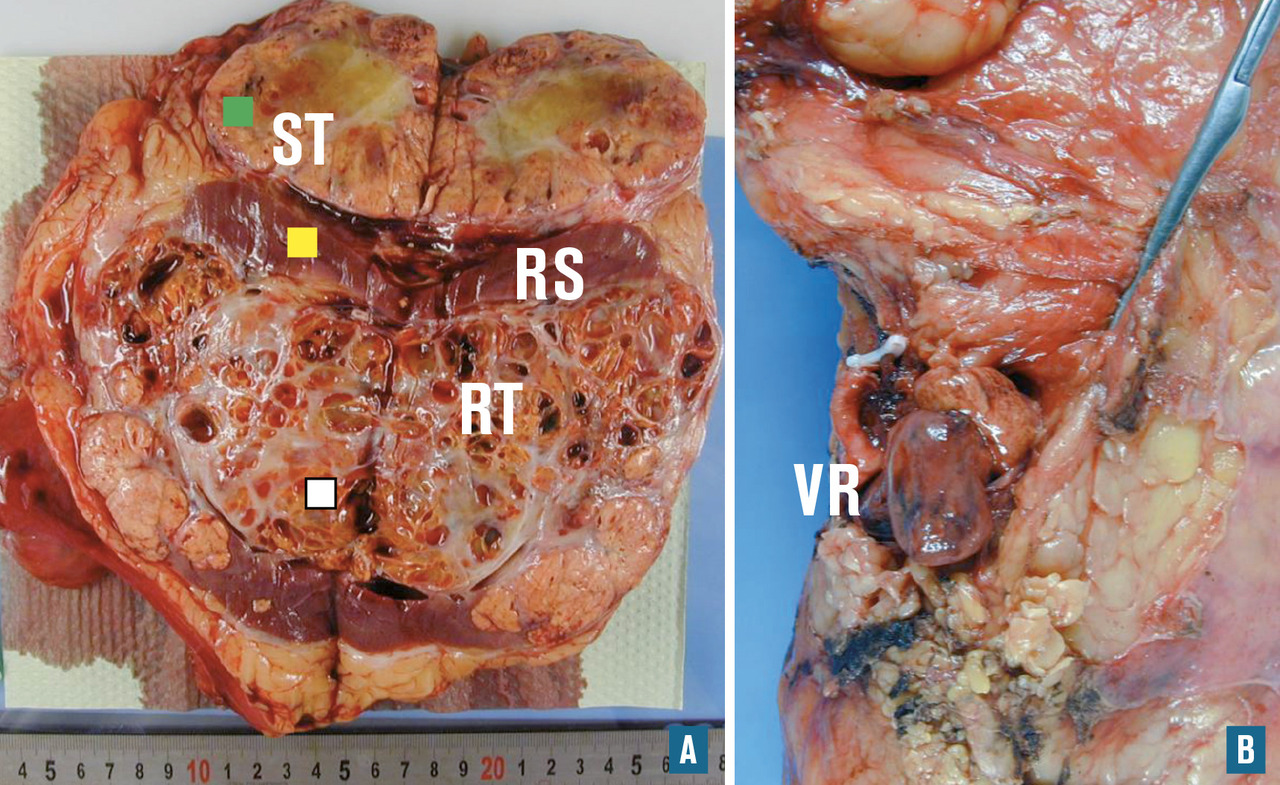
Pour une prise en charge clinique, thérapeutique, anatomopathologique et biologique optimale, le prélèvement doit être reçu à l’état frais (dans la mesure du possible) et dans les meilleurs délais. Ce prélèvement peut être traité dans des conditions non stériles ou stériles. Dans tous les cas, l’examen macroscopique est primordial pour l’interprétation du prélèvement. Il doit en préciser la taille, le poids, l’aspect (homogène, nodulaire, kystique, nécrotique…), la couleur (hémorragique, safran, blanchâtre…) et la consistance (indurée, calcifiée, liquide…). Une photo à l’état frais sous un ou plusieurs angles est le plus souvent souhaitable. Après la description, un fragment de tissu frais et, si possible, un fragment de tissu sain adjacent peuvent être congelés (
Par exemple, la prise en charge d’un prélèvement suspect d’hémopathie est standardisée et doit toujours comporter :
i) la mesure de la pièce, son aspect macroscopique, sa consistance ;
ii) des appositions de tissu frais avant sa fixation. Elles sont utiles à l’analyse cytologique après coloration par le May-Grünwald Giemsa et à l’analyse de cytogénétique moléculaire avec les études d’hybridation in situ fluorescente (FISH) ;
iii) un ou plusieurs prélèvements congelés. Ils sont utiles pour l’analyse morphologique « extemporanée » mais aussi pour certaines techniques d’immunohistochimie réalisées en congélation (immunofluorescence, notamment à la recherche de dépôt de chaînes légères d’immunoglobuline, de protéines, de fractions du complément… sur les biopsies rénales), pour les études de biologie moléculaire après extraction d’ADN ou d’ARN à partir du prélèvement tumoral et pour les études de microbiologie en cas de suspicion d’étiologie infectieuse (PCR ARN 16S, 23S, PCR virologie, culture bactérienne, culture mycologique, NGS infectieux …) ;
iv) un fragment représentatif et conséquent, le plus volumineux, doit être conservé en formol tamponné afin de privilégier l’analyse morphologique après fixation, technique de référence d’interprétation histologique. Le fixateur recommandé est le formol tamponné à 10 %. En effet, les techniques d’immunohistochimie et d’extraction d’ADN ou d’ARN sont optimisées pour des prélèvements fixés en formol tamponné. Tous les autres fixateurs altèrent les acides nucléiques et ne permettent pas d’étude moléculaire. Les résultats d’immunohistochimie peuvent également en être altérés. Des études histologiques sont plus classiquement interprétées, dans certains centres de référence, après fixation en formol acétique, qui a la particularité de pénétrer et de fixer plus rapidement le prélèvement, et d’aboutir à une morphologie de meilleure qualité ;
v) en fonction de la taille du prélèvement, des indications et des suspicions diagnostiques, les échantillonnages suivants peuvent être réalisés :
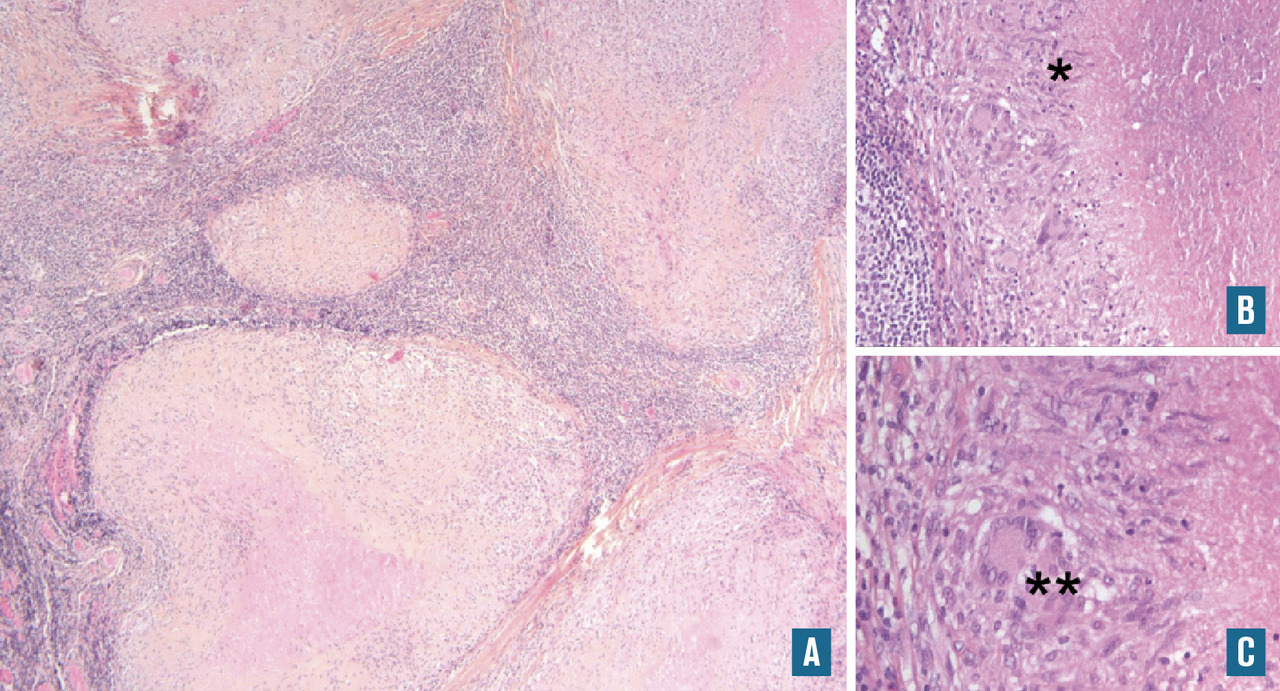
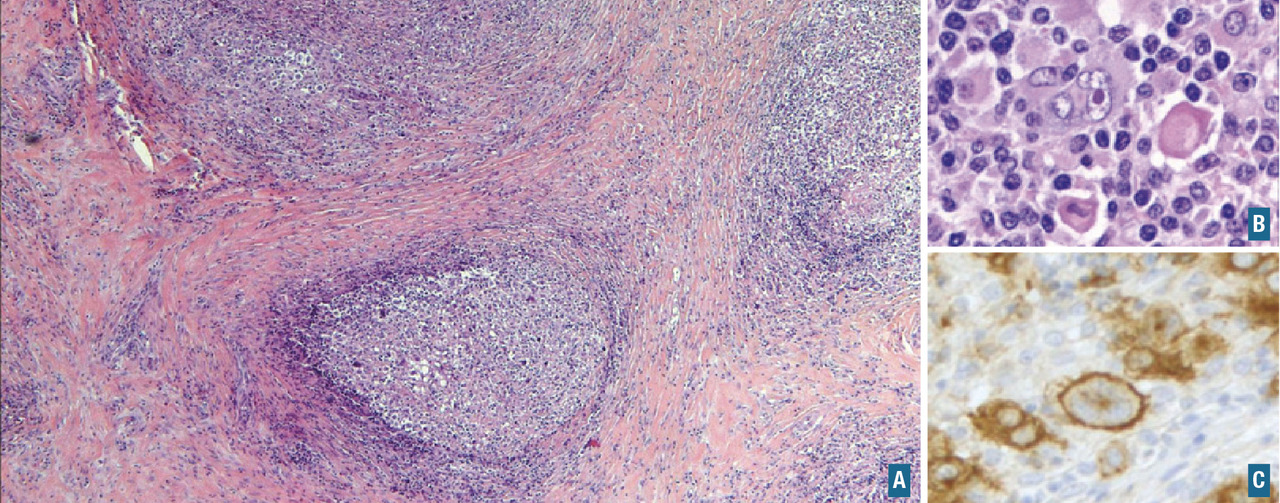
- prélèvements pour le laboratoire de microbiologie, sur tube sec et stérile (culture bactérienne, mycobactérienne, mycologique), s’il existe une suspicion d’origine infectieuse formulée sur la demande accompagnant le prélèvement ou si, lors de l’examen macroscopique, des foyers de nécrose suspects d’être d’origine infectieuse sont visualisés. Cette étude microbiologique peut également être réalisée à partir de prélèvements congelés, par exemple lorsqu’il existe des lésions de nécrose, des granulomes… (fig. 2) ;
- prélèvements pour l’analyse des cellules après mise en suspension, en cytométrie de flux dans le cas d’une suspicion d’hémopathie lymphoïde ou myéloïde, en cytogénétique conventionnelle avec étude du caryotype et études complémentaires de cytogénétique moléculaire. Ces prélèvements doivent être communiqués de manière stérile et dans un milieu de culture particulier (RPMI 1640 Medium), à température ambiante.
Principes de base de réalisation des techniques morphologiques
Les différentes étapes de la préparation des prélèvements sont : la fixation, l’inclusion et l’obtention de blocs en paraffine, les coupes à l’aide d’un microtome, la coloration (habituellement à l’hémalun-éosine).
La fixation est indispensable pour assurer la conservation des cellules et des tissus. Elle doit être adaptée à l’étude morphologique comme aux éventuelles études complémentaires, voire aux futures recherches.
L’analyse microscopique est suivie de la rédaction d’un compte-rendu. Les lames et le bloc d’inclusion sont ensuite archivés.
Cytologie
Les examens cytologiques constituent un élément d’orientation diagnostique en anatomie et cytologie pathologiques (hors myélogramme et examen direct de bactériologie lus dans les laboratoires spécialisés). Ils nécessitent une confirmation histologique. Ils sont effectués sur des liquides d’épanchement, sur des sécrétions prélevées par aspiration, sur des produits de raclage ou de ponction. Ils font l’objet de fixation immédiate par dessiccation ou par action d’une solution, comme l’alcool-éther. Après centrifugation, le culot peut être recueilli, fixé et inclus en paraffine, et ainsi soumis aux techniques histologiques usuelles.
Histologie
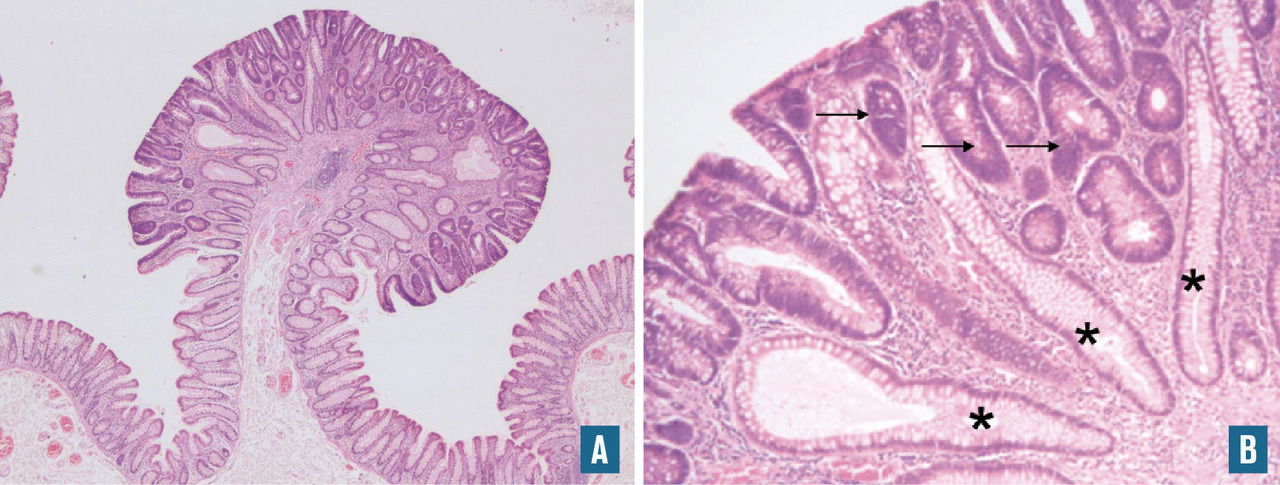
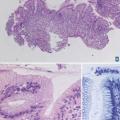
Les examens histologiques sur prélèvements biopsiques ou exérèse chirurgicale permettent, si le prélèvement est contributif et représentatif de la lésion, d’établir un diagnostic à partir de l’ensemble des données morphologiques et des lésions élémentaires visibles.
Après fixation en formol tamponné à 10 %, le prélèvement est déshydraté en alcool et inclus en paraffine. Les blocs de paraffine sont coupés au microtome en « rubans », qui sont déposés sur une lame. Après séchage, la lame est déparaffinée et prête à l’exploitation par les différentes techniques de coloration (
Immunohistochimie
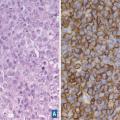
Elle consiste à effectuer sur une préparation histologique une réaction antigène-anticorps. L’antigène est porté par les cellules présentes dans le tissu ou par la matrice extracellulaire. L’anticorps peut être couplé à une enzyme (peroxydase,
Hybridation in situ
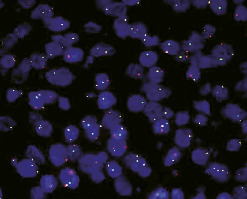
Sur coupes tissulaires ou sur étalements cellulaires, ces techniques mettent en évidence des séquences d’ARN ou d’ADN, grâce à des sondes d’acides nucléiques complémentaires couplées à une enzyme (CISH) ou un fluorochrome (FISH). Elles peuvent ainsi détecter des acides nucléiques viraux (papillomavirus, virus d’Epstein-Barr).
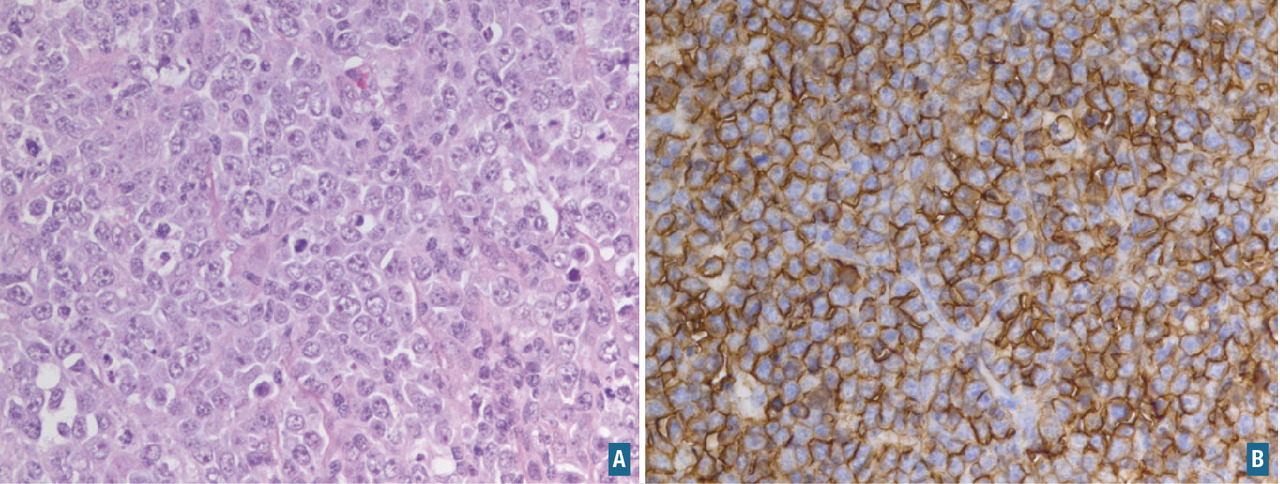
L’hybridation in situ fluorescente (FISH) ou l’hybridation in situ chromogénique (CISH) permet d’identifier dans chaque cellule la présence, le nombre et la translocation de copies d’un segment chromosomique ou de gènes donnés. Elle est utilisée pour rechercher des anomalies, qui peuvent avoir une valeur diagnostique ou pronostique dans certaines tumeurs (
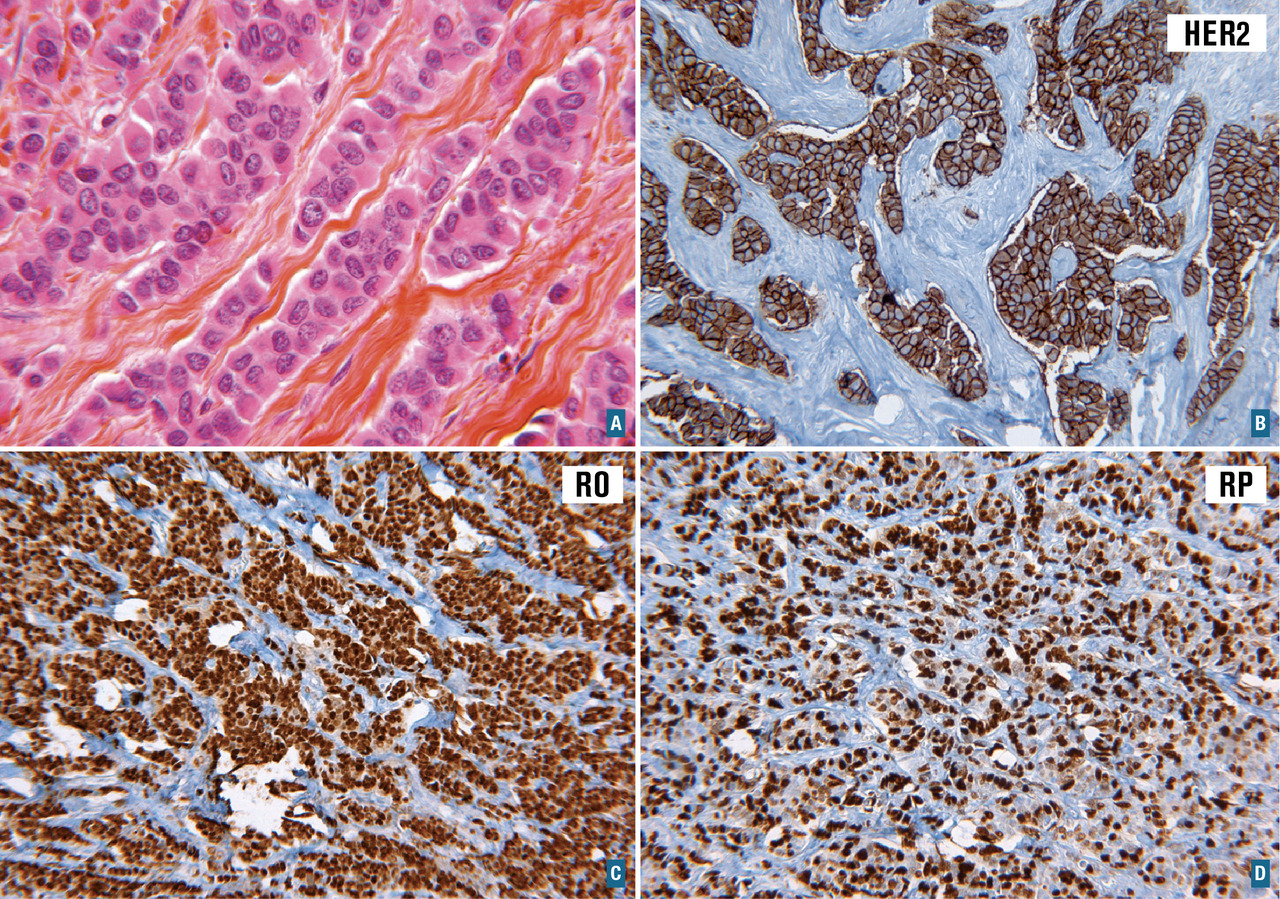
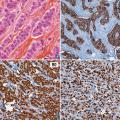
De nombreux marqueurs moléculaires sont aujourd’hui étudiés dans le but de déterminer leur capacité à prédire le pronostic et/ou la réponse aux traitements. Le plus connu est le marqueur HER2 dans le cancer du sein. Le gène codant pour la protéine HER2 est amplifié chez 20 à 30 % des patientes. La surexpression de HER2 s’accompagne d’une prolifération non contrôlée des cellules cancéreuses. Le statut d’HER2 est déterminé par immunohistochimie et confirmé par hybridation fluorescente in situ. Un traitement par anticorps monoclonal a été l’une des premières thérapies ciblées utilisées en cancérologie. Ce traitement, le trastuzumab (Herceptin), inhibe la croissance des cellules tumorales exprimant la protéine HER2 (
Techniques non morphologiques : avantages et limites
Certaines techniques complémentaires immunophénotypiques et moléculaires s’affranchissent de la morphologie. Cependant, la morphologie des prélèvements transmis par le pathologiste pour ces analyses doit toujours être vérifiée et validée afin de s’assurer que l’analyse complémentaire peut être informative et contributive. Ces techniques sont une aide au diagnostic final retenu par le pathologiste et, dans certains cas, ont un impact pronostique et/ou thérapeutique.
Analyses de biologie moléculaire et d’oncogénétique
Les principales indications des analyses de biologie moléculaire et d’oncogénétique sont :
(i) la recherche d’une clonalité lymphoïde B ou T par réarrangement clonal des gènes des immunoglobulines (IGH) ou des récepteurs T (TCR) dans les cas de suspicion de lymphome B ou de certains lymphomes T de diagnostic difficile (lymphomes T cutanés, lymphomes T de type angio-immunoblastique…) ;
(ii) la recherche de mutations spécifiques dans certaines pathologies tumorales (BRAF, TP53...) ;
(iii) le suivi moléculaire de la maladie résiduelle, plus souvent dans le sang ou la moelle (marqueurs oncogénétiques et de clonalité), la comparaison des profils de clonalité : s’agit-il d’une rechute ou d’une nouvelle pathologie lymphoïde clonale ? ;
(iv) la recherche de surexpression de gènes ou de réarrangement ou translocations (IGH-BCL2 dans les cas de lymphomes folliculaires, anomalies de ALK dans certains cancers, réarrangement des gènes EWS-FLI1 ou EWS-ERG dans le sarcome d’Ewing…) ;
(v) l’analyse des ARN permettant d’étudier le profil transcriptionnel des ARN messagers (ARNm) d’un échantillon (RNA-seq) ou d’une partie des ARNm, ciblée sur un set restreint de transcrits (RTMLPA, NanoString). Cela représente parfois une aide au diagnostic : signature moléculaire évocatrice d’un sous-type de tumeur, meilleur classement du phénotype d’origine tumorale (par exemple, dans le lymphome diffus à grandes cellules B), définition de l’origine centro-germinative ou B activé, établissement du pronostic (profil d’expression de tumeur agressive versus indolente) ou encore orientation de la prise en charge thérapeutique (ENDAT [endothelial-associated gene transcripts] dans le rejet humoral de greffon rénal).
D’une manière générale, la mise en évidence d’une clonalité ou son absence doit être interprétée en fonction de l’analyse morphologique du prélèvement testé et du contexte clinique. Une clonalité positive ne fait pas le diagnostic de lymphome, et l’absence de mise en évidence d’un clone n’élimine pas non plus le diagnostic.
Cytogénétiques conventionnelle et moléculaire
Les principales indications des analyses de cytogénétique conventionnelle et de cytogénétique moléculaire (FISH) sont :
(i) les urgences diagnostiques et thérapeutiques nécessitant la mise en évidence d’une translocation spécifique (au caryotype) ou le remaniement au locus du gène cible (FISH). Par exemple, la t(8;14) ou t(2;8) ou t(8;22), et le remaniement au locus de MYC dans le lymphome de Burkitt ;
(ii) les cas diagnostiques douteux et/ou en l’absence d’analyse possible en biologie moléculaire (étude en FISH réalisée sur coupe de prélèvement fixé et inclus en paraffine) ;
(iii) l’étude du caryotype au diagnostic et lors du suivi (anomalies chromosomiques supplémentaires) dans les myélodysplasies, la leucémie lymphoïde chronique…
Il faut souligner que la cytogénétique conventionnelle explore l’ensemble des chromosomes alors que l’hybridation in situ ne s’intéresse qu’à une ou plusieurs cibles génétiques.
Cytométrie en flux
Ces analyses sont principalement réalisées dans les laboratoires d’hématologie et d’immunologie. Elles nécessitent donc une plateforme de cytométrie en flux accessible et une expertise dans la mise en suspension des prélèvements tissulaires, ainsi que dans l’interprétation des données de cytométrie mises en évidence. Les résultats de ces analyses constituent une aide et une orientation diagnostiques rapides (co-expression de marqueurs, monotypie de chaînes légères d’immoglobulines) en moins de 24 heures. Dans tous les cas, les études de cytométrie en flux doivent être interprétées en fonction de l’analyse morphologique du prélèvement testé et du contexte clinique. Le diagnostic définitif est anatomopathologique, après intégration de l’ensemble des résultats.
Examen extemporané : principe de réalisation, principales indications et limites
L’examen histologique extemporané est un examen pratiqué pendant une intervention chirurgicale, dès que le prélèvement est effectué, non fixé, afin de donner rapidement au chirurgien une orientation diagnostique susceptible de modifier son attitude thérapeutique. La technique utilise d’abord la macroscopie puis des coupes au cryostat (cryomicrotome) et une coloration rapide, ce qui permet un résultat et une réponse en moins de 30 minutes.
Les examens extemporanés sont le plus souvent demandés dans les buts suivants :
- déterminer la nature inflammatoire ou tumorale d’une lésion ;
- en cas de tumeur, essayer de déterminer sa nature bénigne ou maligne, pour adapter le geste chirurgical ;
- vérifier que le prélèvement a intéressé un territoire lésionnel représentatif de la pathologie ;
- s’assurer que les limites de résection sont saines.
L’orientation diagnostique fournie par l’examen extemporané n’est pas aussi fiable que celle donnée après un examen conventionnel, en raison de la congélation, qui altère les cellules et rend la qualité morphologique moins bonne. La prise en charge du patient ne se fait qu’après le diagnostic définitif, nécessitant la fixation et l’inclusion en paraffine du bloc initialement congelé, ainsi que l’analyse complète du prélèvement et d’éventuelles techniques complémentaires.
Dialogue entre pathologiste et clinicien
Pathologistes et cliniciens travaillent en collaboration et en confiance.
L’anatomopathologiste a besoin du clinicien. Le pathologiste pose un diagnostic et rédige un compte-rendu qui doivent être lus et compris par le clinicien, pour la prise en charge optimale du patient, qui doit être placé au centre de la discussion.
Le diagnostic anatomopathologique est pluridisciplinaire, nécessitant la connaissance de l’ensemble des données cliniques et biologiques. Il est directement dépendant du clinicien, qui doit décider du prélèvement, de son type, de son siège... Le clinicien peut aussi aider ou orienter le pathologiste, en donnant des informations précises sur les anomalies cliniques ou biologiques.
Le pathologiste participe aujourd’hui aux réunions de concertation pluridisciplinaire (RCP) de prise en charge des patients atteints de cancer.
Le clinicien a besoin d’un diagnostic précis, fiable et rapide, mais il n’y a pas d’urgence à faire un mauvais diagnostic ! Il ne faut donc pas hésiter à émettre un doute, s’il existe, et à justifier la nécessité d’un nouveau prélèvement qui permettra de conclure à un diagnostic de certitude. Pour les tumeurs, le type doit être établi selon la classification de l'Organisation mondiale de la santé (OMS). Le clinicien doit connaître les caractéristiques histologiques et les atypies de la lésion, qui peuvent permettre de mieux comprendre le compte-rendu et le diagnostic de la maladie. L’immunohistochimie est souvent nécessaire au diagnostic. Trop de techniques complémentaires effectuées sans en indiquer clairement les résultats ou l’indication peuvent nuire à la compréhension du compte-rendu et surtout de la lésion.
Les années 2000 ont vu l’avènement des thérapies ciblées : les nouveaux médicaments développés en oncologie s’adressent à des sous-groupes de patients présentant certaines mutations ou expressions antigéniques mises en évidence par des techniques complémentaires, qui doivent être validées et précisées dans le compte-rendu.
Un diagnostic erroné est souvent synonyme de traitement inadapté. L’erreur existe, une double lecture est donc actuellement recommandée par exemple pour les mammographies, certains cancers de l’enfant (neuroblastome)… Elle permet d’assurer un diagnostic de certitude pour les patients atteints de pathologies rares ou de diagnostic difficile. Elle est actuellement recommandée par l’Institut national du cancer (INCa) pour les patients atteints de cancers rares et de lymphomes.
Compte-rendu anatomopathologique
Le compte-rendu anatomopathologique est le reflet de l’analyse systématisée d’un seul et même prélèvement tissulaire par le pathologiste, et un modèle d’intégration i) des données cliniques, paracliniques et biologiques ; ii) des analyses morphologiques (cytologiques et histologiques), immunophénotypiques, cytogénétiques et moléculaires, microbiologiques (bactériologique, virologique, mycologique). Il précise la nature de l’organe prélevé (diagnostic d’organe) s’il est visible sur le prélèvement, il décrit les lésions architecturales et morphologiques en repérant les lésions histologiques élémentaires (diagnostic de lésion), et la conclusion délivre le diagnostic final retenu.
La terminologie utilisée doit être simple, précise, facile à interpréter par le clinicien, et respecter les classifications validées à l’échelon international (classifications de l’OMS pour les tumeurs).
Si le doute existe, il doit être signalé. Un avis expert peut et doit être sollicité pour les diagnostics rares et difficiles, et un nouveau prélèvement peut être nécessaire pour aboutir au diagnostic final.
Recherche médicale scientifique fondamentale et translationnelle : exigences nécessaires pour l’utilisation des prélèvements dans des travaux de recherche
Les prélèvements, fixés ou congelés, peuvent être utilisés à visée de recherche. Ils ne peuvent l’être que i) selon la conformité aux règles éthiques ; ii) selon la loi : information du patient, gestion du consentement ; iii) en respectant les procédures d’assurance qualité et d’utilisation des prélèvements conservés. Les échantillons tissulaires, cryopréservés ou non, ne sont utilisables que s’ils sont associés à des informations (annotations) cliniques sur le patient et à des informations morphologiques concernant le prélèvement (nature du prélèvement, diagnostic porté).
Ainsi ont été créés les centres de ressources biologiques (CRB), qui permettent la collecte, le stockage, la transformation et la cession des ressources biologiques humaines dans des conditions optimales et dans le respect du droit des malades.
De nombreuses techniques sont aujourd’hui disponibles, pouvant être appliquées en routine (cytométrie en flux, morphométrie, microscopie électronique…) ou en recherche (microscopie confocale, microdissection, tissu micro-arrays, techniques non morphologiques d’analyse du transcriptome, du protéome, séquençage haut débit…).•
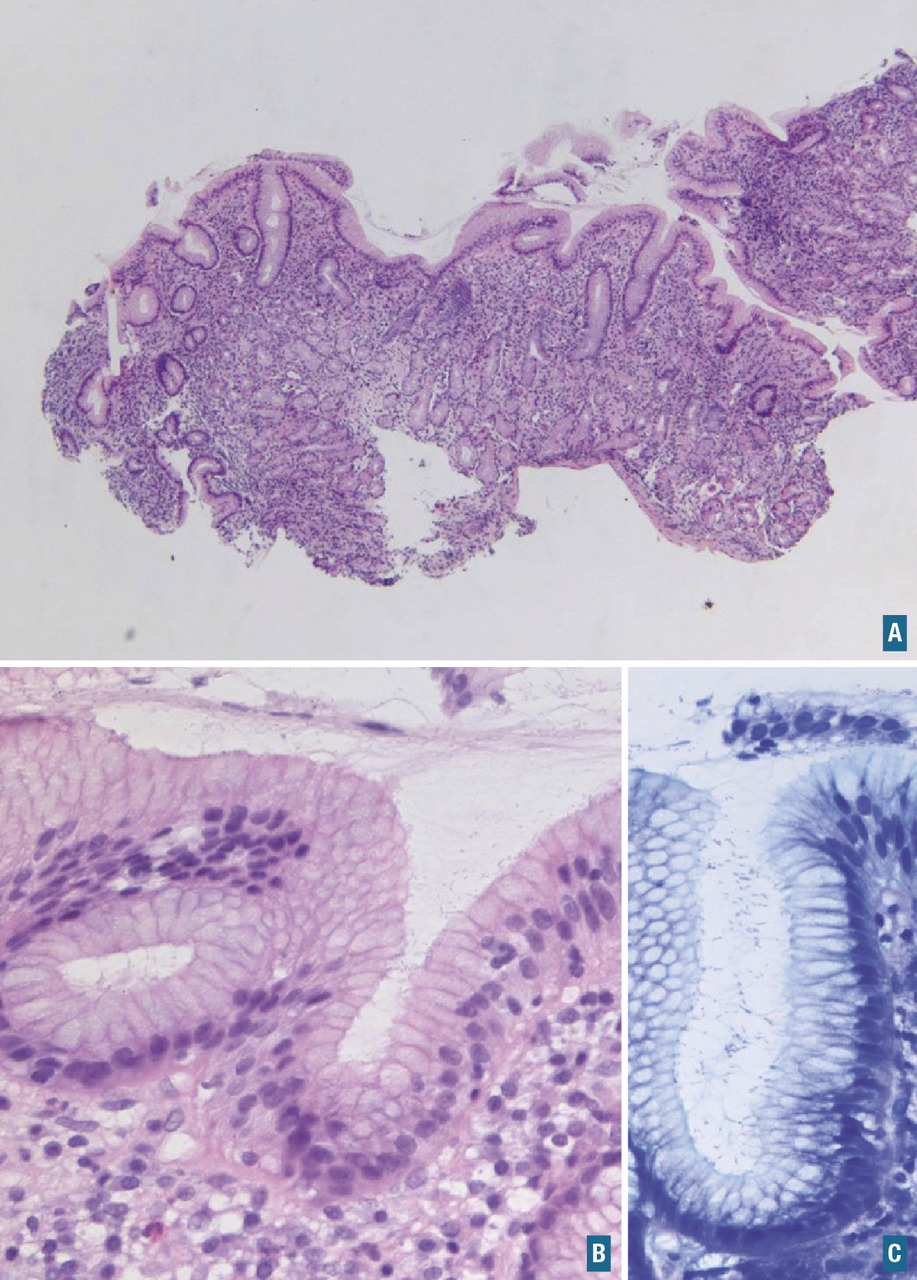
Nous remercions chaleureusement les Drs Marion Rabant (néphropathologie, figure 7, Hôpital européen Georges- Pompidou), Virginie Verkarre (uropathologie,figure 1, Hôpital européen Georges-Pompidou) et Anne de Roquancourt (pathologie mammaire,figure 9, hôpital Saint-Louis) de nous avoir communiqué leurs photos et commentaires pour l’illustration de cet article.
POINTS FORTS À RETENIR
À quoi sert l’anatomopathologie ?
L’anatomopathologie est une discipline médicale qui étudie, à partir d’un prélèvement, cellules, tissus ou organes, les lésions cellulaires et tissulaires provoquées par les maladies, en utilisant des techniques fondées sur l’analyse macroscopique et microscopique.
Elle permet de poser un diagnostic en confirmant la suspicion clinique, en précisant la nature tumorale bénigne ou maligne de la lésion selon les critères diagnostiques internationaux reconnus par l’Organisation mondiale de la santé.
En dehors du diagnostic, elle permet aujourd’hui d’obtenir des renseignements plus précis, également pronostiques, comme l’expression de marqueurs tumoraux, utiles dans la prise en charge des patients par les nouvelles thérapeutiques ciblées.
Les lésions histologiques sont confrontées aux données cliniques, biologiques et d’imagerie. La corrélation anatomoclinique est indispensable pour permettre l’interprétation des lésions et aboutir à un diagnostic. Les résultats de l’analyse sont donnés sous forme de compte-rendu écrit.
Les diagnostics difficiles existent, et il est parfois nécessaire de réaliser un second prélèvement, plus représentatif, ou de demander un avis d’expert.
Livre de pathologie générale, 2e édition. Enseignement thématique. Biopathologie tissulaire. Elsevier Masson.Collège français des pathologistes (CoPath).Coordonné par J.-F. Émile, E. Leteurtre et S. Guyétant.
Dans cet article
- Modalités de transmission des prélèvements au service d’anatomie et cytologie pathologiques
- Prise en charge du prélèvement à l’état frais et fixation
- Principes de base de réalisation des techniques morphologiques
- Techniques non morphologiques : avantages et limites
- Examen extemporané : principe de réalisation, principales indications et limites
- Dialogue entre pathologiste et clinicien
- Compte-rendu anatomopathologique
- Recherche médicale scientifique fondamentale et translationnelle : exigences nécessaires pour l’utilisation des prélèvements dans des travaux de recherche

 Encadrés
Encadrés