Le sommeil des patients dans les services de réanimation est profondément perturbé et présente des altérations spécifiques. Les principales causes sont liées à l’environnement sonore et lumineux ainsi qu’aux soins continus. Les conséquences biologiques et neuropsychologiques de la privation de sommeil ont un impact sur la morbidité et la mortalité des patients. La prise en charge repose essentiellement sur des approches non pharmacologiques visant à favoriser le « temps calme nocturne ».
Le sommeil constitue un état physiologique particulier, indispensable à la vie ; le manque de sommeil a des conséquences cognitivo-comportementales et immuno-inflammatoires délétères chez les patients fragiles hospitalisés en service de réanimation, environnement peu propice au sommeil.
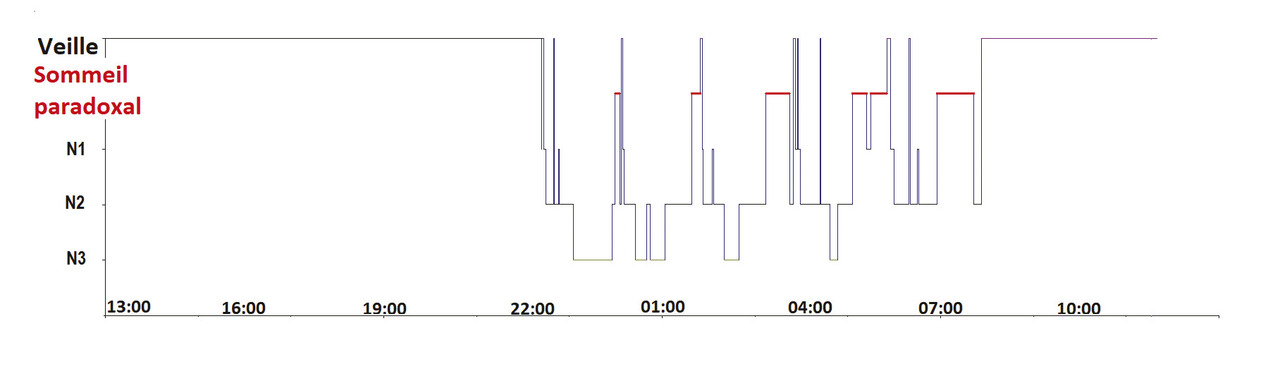
Le sommeil humain normal est monophasique, regroupé lors d’une unique phase nocturne, et composé de sommeil lent léger (stades N1 et N2), de sommeil lent profond (N3) et de sommeil paradoxal (fig. 1 ).
Le sommeil humain normal est monophasique, regroupé lors d’une unique phase nocturne, et composé de sommeil lent léger (stades N1 et N2), de sommeil lent profond (N3) et de sommeil paradoxal (
Méthodes d’étude du sommeil en réanimation
Le sommeil peut être apprécié en matière de quantité et de qualité (nombre de micro-éveils et d’éveils par heure). La polysomnographie est le gold standard pour l’étudier, mais ses difficultés pratiques de réalisation en milieu de réanimation ont conduit au développement d’alternatives.
Questionnaires à réponses subjectives
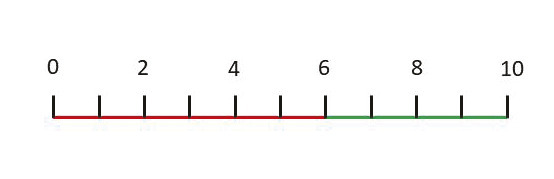
L’évaluation par les infirmières surestime significativement aussi bien la quantité1 que la qualité de sommeil2 des patients de réanimation. Parmi les mesures subjectives, le questionnaire de Richards-Campbell est le plus utilisé et le mieux validé (fig. 2 ).3 Toutefois, ce questionnaire, qui comporte six échelles visuelles, n’est utilisable que chez des patients bien réveillés et parfaitement coopératifs. Une échelle numérique du sommeil a récemment été proposée et semble utilisable chez un plus grand nombre de patients (fig. 3 ).4
Polysomnographie fiable mais difficile à réaliser
Le seul moyen fiable d’analyser le sommeil en réanimation est la polysomnographie, complétée par un enregistrement continu du niveau sonore et lumineux, et acquise pendant au moins dix-huit heures. Malheureusement, l’environnement électromagnétique, le poids et l’encombrement des polysomnographes, la gêne occasionnée pour les soignants, la disponibilité de techniciens du sommeil et les difficultés de scorage du sommeil rendent complexe sa réalisation en réanimation.
Méthodes alternatives peu satisfaisantes
L’actigraphie, qui consiste à enregistrer les mouvements du poignet à l’aide d’un accéléromètre, permet de mesurer la répartition du sommeil durant vingt-quatre heures pendant plusieurs jours de suite.5 Mais ses résultats peuvent être affaiblis en cas d’hémiplégie, de contention ou de faiblesse musculaire.1
L’indice bispectral ou l’odds ratio product (ORP)6 consiste en une analyse spectrale du signal à l’électroencéphalogramme (EEG) frontal capté par deux électrodes. Certaines équipes ont employé ce dispositif pour quantifier le sommeil, mais la comparaison avec la polysomnographie (PSG) a montré un manque de fiabilité non négligeable.7
L’indice bispectral ou l’odds ratio product (ORP)6 consiste en une analyse spectrale du signal à l’électroencéphalogramme (EEG) frontal capté par deux électrodes. Certaines équipes ont employé ce dispositif pour quantifier le sommeil, mais la comparaison avec la polysomnographie (PSG) a montré un manque de fiabilité non négligeable.7
Nombreuses altérations du sommeil
Mauvaise qualité du sommeil rapportée par les patients
Une difficulté majeure pour s’endormir ou l’incapacité à trouver un sommeil profond et réparateur sont des plaintes rapportées par près de 80 % des patients.8 La qualité du sommeil en réanimation est régulièrement estimée comme très inférieure à celle du domicile. Ces difficultés de sommeil sont si prégnantes qu’elles sont très souvent classées au deuxième rang des facteurs les plus stressants en réanimation, juste devant l’intubation endotrachéale et après la douleur.9
Aspect anormal de l’EEG de veille et de sommeil
Dès les premières études polysomnographiques effectuées dans les années 2000, des aspects anormaux de l’EEG de sommeil et de veille ont été rapportés avec, pour conséquence, un manque de fiabilité des règles conventionnelles de scorage du sommeil initialement décrites par Rechtschaffen et Kales.10 Ces anomalies à l’EEG ont conduit à l’identification d’un état de veille particulier appelé « veille pathologique » et d’un état de sommeil anormal appelé « sommeil atypique ». L’établissement de règles de scorage spécifiques11 intégrant ces états particuliers permet de reconnaître ces stades de veille et sommeil anormaux, et les recommandations récentes proposent de les employer pour quantifier le sommeil en réanimation.12 Le sommeil atypique se rencontre chez environ un tiers des patients non sédatés et conscients.13
Durée et composition du sommeil perturbées
Une variabilité très importante des durées de sommeil est fréquente ; des temps raccourcis (2 à 3 heures), proches des valeurs normales (6 à 8 heures) ou augmentées (supérieures à 8 heures) ont été rapportés.8 Si la quantité de sommeil peut être normale, sa composition est très souvent considérablement altérée. À une augmentation importante du temps passé en sommeil léger (stades N1 et N2) s’associe un déficit majeur en sommeil profond (stade N3) et en sommeil paradoxal, ce dernier pouvant disparaître complètement.14
Parallèlement, les patients présentent un sommeil très fragmenté : il est très fréquemment interrompu par des micro-éveils ou des éveils. Chez ces patients, l’indice de fragmentation du sommeil (qui additionne le nombre de micro-éveils et d’éveils par heure de sommeil) est souvent très élevé, atteignant 50 à 60 éveils/micro-éveils par heure de sommeil.14
Parallèlement, les patients présentent un sommeil très fragmenté : il est très fréquemment interrompu par des micro-éveils ou des éveils. Chez ces patients, l’indice de fragmentation du sommeil (qui additionne le nombre de micro-éveils et d’éveils par heure de sommeil) est souvent très élevé, atteignant 50 à 60 éveils/micro-éveils par heure de sommeil.14
Désorganisation nycthémérale du sommeil
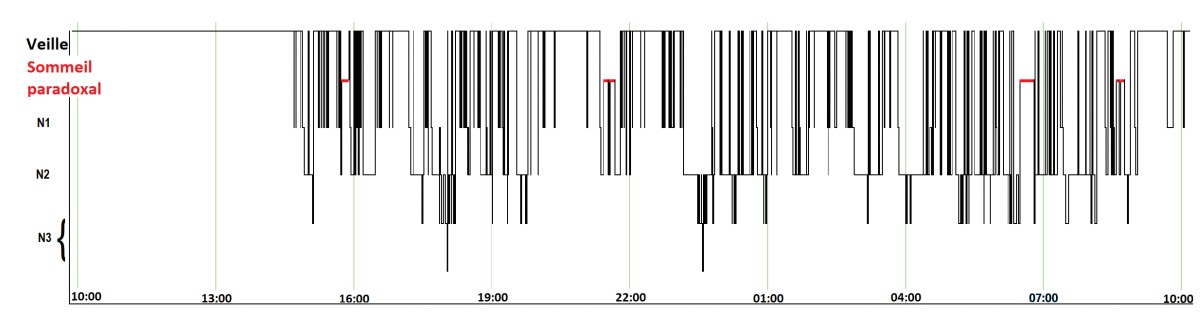
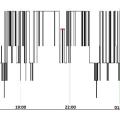
Une autre caractéristique du sommeil des patients de réanimation est la désorganisation du cycle veille-sommeil. La perte de l’alternance jour-nuit et l’alitement prolongé favorisent le sommeil diurne. La plupart des études utilisant des PSG prolongées ont montré une distribution polyphasique du sommeil sur le nycthémère, avec près de la moitié du temps de sommeil passée durant la journée (fig. 4 ).13
Dégradation des rythmes circadiens
L’horloge centrale, située dans le noyau suprachiasmatique et qui contribue à l’organisation du cycle veille-sommeil, est également profondément altérée chez ces patients. À la suite du travail princeps de Shilo et al.5 mettant en évidence une altération du rythme de sécrétion de la mélatonine, plusieurs études ont associé une diminution de la production de mélatonine sérique au sepsis ou à la sédation. Lorsqu’elle est préservée, la production circadienne de mélatonine présente très souvent un décalage du pic dans le sens d’un retard de phase.15
Multiples facteurs perturbant le sommeil en réanimation
De nombreux facteurs compromettent la qualité du sommeil en réanimation. Certains d’entre eux ne sont pas spécifiques de cette spécialité, comme le bruit ou la lumière, mais particulièrement fréquents et intenses en réanimation.
Facteurs prémorbides
Plusieurs études ont relevé qu’une plainte de mauvais sommeil préalable à l’admission et la consommation d’hypnotiques étaient des facteurs de risque de mauvaise qualité du sommeil en réanimation.16
Facteurs endogènes
La douleur est le principal facteur compromettant le sommeil en réanimation.9 L’anxiété et le stress ressentis mais également la sensation de solitude sont associés à des altérations sévères du sommeil en réanimation.17
En revanche, l’âge ou le genre, indépendamment l’un de l’autre, ne semblent pas liés à une sévérité accrue des troubles du sommeil,16 mais une association âge-genre a été rapportée dans une étude, indiquant une plus faible probabilité de trouble sévère du sommeil chez les femmes âgées.16
Les patients présentant un état confusionnel de réanimation (delirium) ont un temps total de sommeil et une fragmentation du sommeil similaires à ceux des patients sans confusion. Néanmoins, les patients avec une confusion ont un manque de sommeil paradoxal plus marqué et des troubles circadiens plus importants.18
En revanche, l’âge ou le genre, indépendamment l’un de l’autre, ne semblent pas liés à une sévérité accrue des troubles du sommeil,16 mais une association âge-genre a été rapportée dans une étude, indiquant une plus faible probabilité de trouble sévère du sommeil chez les femmes âgées.16
Les patients présentant un état confusionnel de réanimation (delirium) ont un temps total de sommeil et une fragmentation du sommeil similaires à ceux des patients sans confusion. Néanmoins, les patients avec une confusion ont un manque de sommeil paradoxal plus marqué et des troubles circadiens plus importants.18
Facteurs environnementaux
Un niveau sonore élevé, des alarmes bruyantes, une exposition continue à la lumière artificielle et des soins répartis durant vingt-quatre heures rendent difficiles l’endormissement et un sommeil continu.19 Toutefois, les pics sonores et les soins n’expliqueraient que 30 % de l’ensemble des micro-éveils et réveils ; aucune autre cause n’est clairement identifiée pour tous les autres éveils et micro-éveils.20
Diagnostic à l’admission et sévérité de la maladie
Selon les données disponibles, le diagnostic à l’admission21 et le type de chirurgie (pour les réanimations chirurgicales)23 ne sont pas associés aux perturbations du sommeil.
La sévérité de la maladie est susceptible d’être un facteur majeur d’altération du sommeil, mais la littérature n’est pas univoque. Alors que plusieurs études n’ont pas rapporté d’altérations plus importantes chez les patients les plus graves,11 deux études ont montré une association entre les scores de sévérité et les perturbations du sommeil.18
La sévérité de la maladie est susceptible d’être un facteur majeur d’altération du sommeil, mais la littérature n’est pas univoque. Alors que plusieurs études n’ont pas rapporté d’altérations plus importantes chez les patients les plus graves,11 deux études ont montré une association entre les scores de sévérité et les perturbations du sommeil.18
Support ventilatoire
Parmi les facteurs susceptibles d’influencer la qualité du sommeil en réanimation, les différents modes de support ventilatoire sont probablement les plus étudiés. Certaines études suggèrent que la ventilation assistée peut être protectrice comparée à la ventilation spontanée.23 En revanche, plusieurs autres évoquent que le mode de ventilation invasive peut impacter la survenue des perturbations du sommeil. Actuellement, la ventilation en aide inspiratoire est considérée comme plus délétère pour la qualité du sommeil que la ventilation en pression contrôlée24 ou que la ventilation assistée proportionnelle.25 Les mécanismes suspectés sont essentiellement la survenue de micro-éveils et d’éveils provoqués par des asynchronies patient-ventilateur, des apnées centrales ou des efforts inefficaces.25 La ventilation assistée neuro-asservie, qui propose une assistance proportionnelle à l’effort inspiratoire détecté par l’enregistrement de l’activité électrique du diaphragme, semble avoir un intérêt particulier en limitant les apnées centrales et les efforts inefficaces.26
Covid-19
La pandémie de Covid-19 a été associée à une dégradation de la qualité du sommeil non seulement dans la population générale mais aussi parmi les patients hospitalisés pour Covid-19, surtout ceux qui prenaient des hypnotiques auparavant.27 Dans une autre étude réalisée chez des patients atteints de Covid-19, une plainte d’insomnie était associée à une admission en réanimation plus fréquente.28
Effets des médicaments
De nombreuses molécules employées en réanimation à visée anxiolytique, antalgique ou cardiovasculaire altèrent le sommeil quand elles sont administrées chez l’adulte sain. Toutefois, les effets de ces médicaments sur le sommeil ont rarement été systématiquement étudiés chez les patients critiques et ils sont complexes, conduisant à des résultats divergents. Par exemple, plusieurs études indiquent que l’administration d’opiacés chez les patients de réanimation ne perturbe pas le sommeil,16 et qu’une diminution de l’intensité des douleurs pourrait assurer une bonne qualité de sommeil.19
De surcroît, l’effet de ces molécules peut différer significativement selon la méthode d’étude du sommeil employée. Par exemple, les patients déclarent habituellement un effet bénéfique des benzodiazépines et des hypnotiques, alors que l’analyse polysomnographique montre un effet délétère sur la qualité du sommeil avec une diminution importante du sommeil paradoxal et probablement du sommeil profond.18
Les antipsychotiques typiques (halopéridol...) et les anticonvulsivants augmentent le temps de sommeil sans affecter le sommeil profond.
Les médicaments cardiovasculaires vasopresseurs pourraient diminuer le sommeil des patients de réanimation ; l’effet des bronchodilatateurs, des corticostéroïdes n’a pas été exploré en détail.29
L’arrêt, parfois brutal, lors d’une admission en réanimation, des traitements habituels peut également provoquer des troubles du sommeil. L’exemple du rebond d’insomnie chez les patients absorbant régulièrement des hypnotiques est le plus parlant, mais il existe également, à un moindre degré, pour les autres molécules neurotropes.
Enfin, toutes les substances neurotropes peuvent modifier les aspects de l’EEG de veille et de sommeil et ainsi compliquer la reconnaissance des stades du sommeil.
De surcroît, l’effet de ces molécules peut différer significativement selon la méthode d’étude du sommeil employée. Par exemple, les patients déclarent habituellement un effet bénéfique des benzodiazépines et des hypnotiques, alors que l’analyse polysomnographique montre un effet délétère sur la qualité du sommeil avec une diminution importante du sommeil paradoxal et probablement du sommeil profond.18
Les antipsychotiques typiques (halopéridol...) et les anticonvulsivants augmentent le temps de sommeil sans affecter le sommeil profond.
Les médicaments cardiovasculaires vasopresseurs pourraient diminuer le sommeil des patients de réanimation ; l’effet des bronchodilatateurs, des corticostéroïdes n’a pas été exploré en détail.29
L’arrêt, parfois brutal, lors d’une admission en réanimation, des traitements habituels peut également provoquer des troubles du sommeil. L’exemple du rebond d’insomnie chez les patients absorbant régulièrement des hypnotiques est le plus parlant, mais il existe également, à un moindre degré, pour les autres molécules neurotropes.
Enfin, toutes les substances neurotropes peuvent modifier les aspects de l’EEG de veille et de sommeil et ainsi compliquer la reconnaissance des stades du sommeil.
Cas particulier de la sédation
La sédation et le sommeil partagent de rares similitudes : atténuation de la conscience réversible, consommation métabolique réduite, hypotonie musculaire, notamment.
Néanmoins, des différences physiologiques évidentes et majeures distinguent les deux états. L’EEG enregistré chez les patients sédatés laisse en général apparaître des ondes lentes delta, qui peuvent être confondues avec celles du sommeil profond. Le corollaire de ces observations est qu’il n’est virtuellement pas possible de scorer précisément le sommeil sans respecter une période libre après l’arrêt de la sédation. Une méta-analyse de 2018 indique l’absence d’effet du propofol sur le temps total de sommeil ou sur la composition du sommeil, hormis une diminution très marquée du sommeil paradoxal.30 Par ailleurs, le propofol pourrait avoir des effets négatifs sur les rythmes circadiens. L’administration nocturne de faibles doses de dexmédétomidine (médicament sédatif utilisé en anesthésiologie) est associée à une augmentation du sommeil léger (stade N2) et du temps de sommeil ;31 les études interrogeant les patients sont discordantes quant à son bénéfice.32
Néanmoins, des différences physiologiques évidentes et majeures distinguent les deux états. L’EEG enregistré chez les patients sédatés laisse en général apparaître des ondes lentes delta, qui peuvent être confondues avec celles du sommeil profond. Le corollaire de ces observations est qu’il n’est virtuellement pas possible de scorer précisément le sommeil sans respecter une période libre après l’arrêt de la sédation. Une méta-analyse de 2018 indique l’absence d’effet du propofol sur le temps total de sommeil ou sur la composition du sommeil, hormis une diminution très marquée du sommeil paradoxal.30 Par ailleurs, le propofol pourrait avoir des effets négatifs sur les rythmes circadiens. L’administration nocturne de faibles doses de dexmédétomidine (médicament sédatif utilisé en anesthésiologie) est associée à une augmentation du sommeil léger (stade N2) et du temps de sommeil ;31 les études interrogeant les patients sont discordantes quant à son bénéfice.32
Conséquences néfastes des altérations du sommeil démontrées
Les conséquences néfastes de la privation de sommeil chez les volontaires sains ou du manque de sommeil de bonne qualité chez les patients ont été bien établies ces dernières années.
Effets comportementaux et cognitifs de la privation de sommeil
La privation ou la restriction de sommeil produit des désordres attentionnels et mnésiques, altère la concentration et les performances pour des tâches simples, et provoque un ralentissement idéomoteur et des persévérations. La privation de sommeil prolongée de sujets sains déclenche régulièrement des distorsions sensorielles et des hallucinations.33 Tous ces effets pourraient concourir à la survenue d’un syndrome confusionnel de réanimation ou delirium. En effet, plusieurs études mentionnent une prévalence augmentée du déficit en sommeil paradoxal chez les patients présentant un syndrome confusionnel en réanimation.18
Effets respiratoires
Plusieurs études récentes rapportent une association entre la sévérité des troubles du sommeil et l’issue du séjour en réanimation. En particulier, deux études indiquent que les patients qui présentent les altérations du sommeil les plus sévères ont plus de difficultés à se sevrer de la ventilation assistée.6,34 Ces données sont à rapprocher de la perte d’endurance respiratoire provoquée par une nuit de privation de sommeil chez des sujets sains.35 Enfin, d’autres études mettent en évidence une association entre les altérations du sommeil les plus sévères, un séjour prolongé et une surmortalité.36
Persistance des troubles du sommeil
Alors que la qualité objective du sommeil s’améliore après le séjour en réanimation, 20 à 67 % des survivants se plaignent de troubles du sommeil persistants, six et douze mois après leur sortie de réanimation.37 Ceux-ci sont d’autant plus fréquents que le score de sévérité à l’admission était plus élevé et la qualité du sommeil durant le séjour était mauvaise. Ces troubles du sommeil peuvent parfois être inclus dans le cadre plus complexe du « syndrome post-réanimation ».38
Éviter les médicaments dans la prise en charge des troubles du sommeil en réanimation
Compte tenu des effets indésirables des benzodiazépines et autres hypnotiques, et du faible nombre d’études pharmacologiques randomisées contrôlées, la prise en charge des troubles du sommeil en réanimation repose essentiellement sur des approches non pharmacologiques. Les récentes recommandations de la Société américaine de réanimation exposent les dernières données de la littérature et font le point sur les différentes options thérapeutiques.12
Traitements pharmacologiques décevants
Une perfusion continue de dexmédétomidine pourrait accroître le temps de sommeil mais en augmentant le sommeil léger.32 Quelques études ont testé l’effet du propofol ou du midazolam sur le sommeil. Elles n’ont pas rapporté d’intérêt clinique en faveur de l’utilisation de ces molécules pour favoriser le sommeil. Les études qui ont exploré l’effet de la mélatonine ou d’agonistes mélatoninergiques sur le sommeil ont également été décevantes, même si certaines ont rapporté une amélioration subjective de la qualité du sommeil.39
Traitements non pharmacologiques
Partant du fait qu’il est compliqué d’induire le sommeil à l’aide de la pharmacopée chez ces patients, les efforts des cliniciens se portent sur des mesures de protection du sommeil afin, d’une part, de faciliter l’endormissement et, d’autre part, de favoriser les épisodes de sommeil prolongés.
Des outils sont en développement pour tenter de faire mieux. Ainsi, par exemple, une start-up française a récemment mis au point un moniteur de sommeil utilisant des stratégies guidées par l’EEG.45 Ce concept novateur utilise un micropolysomnographe incorporant un algorithme de scorage automatique fonctionnant en temps réel, et indiquant aux soignants si le patient dort ou non. Grâce à ce dispositif en cours de validation, les stratégies de protection du sommeil pourraient être appliquées lorsque le patient dort, et levées lorsque le patient est éveillé.
Lutte contre le stress et l’anxiété
Plusieurs équipes ont tenté d’atténuer l’anxiété à l’aide de massages, de la relaxation ou de la musicothérapie, avec des résultats variables.40Renforcement des rythmes circadiens
Une amélioration du sommeil pourrait être attendue d’un renforcement des rythmes circadiens. Ainsi, la luminothérapie matinale s’est montrée efficace pour renforcer et améliorer le rythme de la mélatonine.41 Un renforcement de l’éveil diurne, et conséquemment du sommeil nocturne, par des activités de mobilisation et d’interactions sociales (visites des familles) pourrait être obtenu, même si les données ne sont pas encore concrètement confirmées dans la littérature.Masque oculaire et bouchons d’oreilles
Le port de masque oculaire et de bouchons d’oreilles pourrait augmenter la durée de sommeil profond et raccourcir la durée des éveils nocturnes.42 Une méta-analyse suggère qu’ils sont associés à une augmentation du temps total de sommeil.43 Toutefois, ils ne sont pas toujours bien tolérés.Création de « temps calme nocturne »
Avec la réduction des niveaux sonores et lumineux nocturnes, et avec le regroupement des soins, la mise en place de « temps calme nocturne » est actuellement un des moyens les plus prometteurs pour favoriser le sommeil des patients. De nombreuses équipes ont mis en place différentes stratégies de « temps calme nocturne » au cours desquelles les soignants sont appelés à limiter les entrées dans les chambres, organiser les soins pour qu’une entrée regroupe plusieurs interventions, réduire les discussions devant les chambres, diminuer l’environnement lumineux et reporter les soins non urgents. En règle générale, ces procédures requièrent un travail d’identification des facteurs perturbateurs du sommeil et des interactions fréquentes entre l’équipe médicale et les autres intervenants (infirmiers, aides-soignants, personnels chargés du ménage). Le plus souvent, ces mesures sont appliquées de minuit à 4 h du matin, afin de permettre la réalisation des soins de change et de confort. Ces efforts réussissent en général à diminuer les perturbations environnementales et le nombre d’entrées dans les chambres.44 Malheureusement, les quelques études réalisées n’ont pas montré d’effet bénéfique sur la qualité du sommeil.21Des outils en développement
Les mesures de protection du sommeil sont parfois difficiles à mettre en place, et les premières études montrent un effet sur l’anxiété, mais pas sur la qualité du sommeil, probablement en raison de leurs applications « rigides » sur la période minuit-4 h du matin.44Des outils sont en développement pour tenter de faire mieux. Ainsi, par exemple, une start-up française a récemment mis au point un moniteur de sommeil utilisant des stratégies guidées par l’EEG.45 Ce concept novateur utilise un micropolysomnographe incorporant un algorithme de scorage automatique fonctionnant en temps réel, et indiquant aux soignants si le patient dort ou non. Grâce à ce dispositif en cours de validation, les stratégies de protection du sommeil pourraient être appliquées lorsque le patient dort, et levées lorsque le patient est éveillé.
Protéger le sommeil altéré des patients en réanimation
Les patients hospitalisés en service de réanimation présentent des altérations du sommeil très sévères, avec des conséquences négatives sur le sevrage ventilatoire et la mortalité. Des outils diagnostiques et les procédures pour protéger le sommeil de ces patients sont en cours de développement et pourraient être déployés dans un futur proche.
Références
1. Beecroft JM, Ward M, Younes M, Crombach S, Smith O, Hanly PJ. Sleep monitoring in the intensive care unit: Comparison of nurse assessment, actigraphy and polysomnography. Intensive Care Med 2008;34:2076-83.
2. Frisk U, Nordstrom G. Patients’ sleep in an intensive care unit-patients’ and nurses’perception. Intensive Crit Care Nurs 2003;19:342-9.
3. Richards KC, O’Sullivan PS, Phillips RL. Measurement of sleep in critically ill patients. J Nurs Meas 2000;8:131-44.
4. Rood P, Frenzel T, Verhage R, Bonn M, van der Hoeven H, Pickkers P, et al. Development and daily use of a numeric rating score to assess sleep quality in ICU patients. J Crit Care 2019;52:68-74.
5. Shilo L, Dagan Y, Smorjik Y, Weinberg U, Dolev S, Komptel B, et al. Patients in the intensive care unit suffer from severe lack of sleep associated with loss of normal melatonin secretion pattern. Am J Med Sci 1999;317:278-81.
6. Dres M, Younes M, Rittayamai N, Kendzerska T, Telias I, Grieco DL, et al. Sleep and pathological wakefulness at the time of liberation from mechanical ventilation (SLEEWE). A prospective multicenter physiological study. Am J Respir Crit Care Med 2019;199:1106-15.
7. LeBlanc JM, Dasta JF and Kane-Gill SL. Role of the bispectral index in sedation monitoring in the ICU. Ann Pharmacother 2006;40:490-500.
8. Drouot X, Quentin S. Sleep neurobiology and critical care illness. Sleep Med Clin 2016;11:105-13.
9. Novaes MA, Aronovich A, Ferraz MB, Knobel E. Stressors in ICU: Patients’evaluation. Intensive Care Med 1997;23:1282-5.
10. Watson PL, Ely EW, Malow B, Pandharipande P. Scoring sleep in critically ill patients: Limitations in standard methodology and the need for revised criteria. Crit Care Med 2006;34:A83.
11. Drouot X, Roche-Campo F, Thille AW, Cabello B, Galia F, Margarit L, et al. A new classification for sleep analysis in critically ill patients. Sleep Med 2012;13:7-14.
12. Devlin JW, Skrobik Y, Gelinas C, Needham DM, Slooter AJC, Pandharipande PP, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 2018;46:e825-e873.
13. Roche Campo F, Drouot X, Thille AW, Galia F, Cabello B, d’Ortho MP, et al. Poor sleep quality is associated with late noninvasive ventilation failure in patients with acute hypercapnic respiratory failure. Crit Care Med 2010;38:477-85.
14. Elliott R, McKinley S, Cistulli P, Fien M. Characterisation of sleep in intensive care using 24-hour polysomnography: An observational study. Crit Care 2013;17:R46.
15. Gehlbach BK, Chapotot F, Leproult R, Whitmore H, Poston J, Pohlman M, et al. Temporal disorganization of circadian rhythmicity and sleep-wake regulation in mechanically ventilated patients receiving continuous intravenous sedation. Sleep 2012;35:1105-14.
16. Bihari S, Doug McEvoy R, Matheson E, Kim S, Woodman RJ, Bersten AD. Factors affecting sleep quality of patients in intensive care unit. J Clin Sleep Med 2012;8:301-7.
17. Honarmand K, Rafay H, Le J, Mohan S, Rochwerg B, Devlin JW, et al. A systematic review of risk factors for sleep disruption in critically ill adults. Crit Care Med 2020;48:1066-74.
18. Trompeo AC, Vidi Y, Locane MD, Braghiroli A, Mascia L, Bosma K, et al. Sleep disturbances in the critically ill patients: Role of delirium and sedative agents. Minerva Anestesiol 2011;77:604-12.
19. Hofhuis JG, Spronk PE, van Stel HF, Schrijvers AJ, Rommes JH, Bakker J. Experiences of critically ill patients in the ICU. Intensive Crit Care Nurs 2008;24:300-13.
20. Gabor JY, Cooper AB, Crombach SA, Lee B, Kadikar N, Bettger HE, et al. Contribution of the intensive care unit environment to sleep disruption in mechanically ventilated patients and healthy subjects. Am J Respir Crit Care Med 2003;167:708-15.
21. Kamdar BB, King LM, Collop NA, Sakamuri S, Colantuoni E, Neufeld KJ, et al. The effect of a quality improvement intervention on perceived sleep quality and cognition in a medical ICU. Crit Care Med 2013;41:800-9.
22. Nicolas A, Aizpitarte E, Iruarrizaga A, Vazquez M, Margall A, Asiain C. Perception of night-time sleep by surgical patients in an intensive care unit. Nurs Crit Care 2008;13:25-33.
23. Elliott R, Rai T, McKinley S. Factors affecting sleep in the critically ill: An observational study. J Crit Care 2014;29:859-63.
24. Toublanc B, Rose D, Glerant JC, Francois G, Mayeux I, Rodenstein D, et al. Assist-control ventilation vs low levels of pressure support ventilation on sleep quality in intubated ICU patients. Intensive Care Med 2007;33:1148-54.
25. Bosma K, Ferreyra G, Ambrogio C, Pasero D, Mirabella L, Braghiroli A, et al. Patient-ventilator interaction and sleep in mechanically ventilated patients: Pressure support versus proportional assist ventilation. Crit Care Med 2007;35:1048-54.
26. Delisle S, Ouellet P, Bellemare P, Tetrault JP, Arsenault P. Sleep quality in mechanically ventilated patients: Comparison between NAVA and PSV modes. Ann Intensive Care 2011;1:42.
27. Beck F, Leger D, Fressard L, Peretti-Watel P, Verger P. Covid-19 health crisis and lockdown associated with high level of sleep complaints and hypnotic uptake at the population level. J Sleep Res 2021;30:e13119.
28. Zhang J, Xu D, Xie B, Zhang Y, Huang H, Liu H, et al. Poor-sleep is associated with slow recovery from lymphopenia and an increased need for ICU care in hospitalized patients with COVID-19: A retrospective cohort study. Brain Behav Immun 2020;88:50-8.
29. Bourne RS,Mills GH. Sleep disruption in critically ill patients--pharmacological considerations. Anaesthesia 2004;59:374-84.
30. Lewis SR, Schofield-Robinson OJ, Alderson P, Smith AF. Propofol for the promotion of sleep in adults in the intensive care unit. Cochrane Database Syst Rev 2018;1:CD012454.
31. Romagnoli S, Villa G, Fontanarosa L, Tofani L, Pinelli F, De Gaudio AR, et al. Sleep duration and architecture in non-intubated intensive care unit patients: An observational study. Sleep Med 2020;70:79-87.
32. Wu XH, Cui F, Zhang C, Meng ZT, Wang DX, Ma J, et al. Low-dose dexmedetomidine improves sleep quality pattern in elderly patients after noncardiac surgery in the intensive care unit: A pilot randomized controlled trial. Anesthesiology 2016;125:979-91.
33. Babkoff H, Sing HC, Thorne DR, Genser SG, Hegge FW. Perceptual distortions and hallucinations reported during the course of sleep deprivation. Percept Mot Skills 1989;68:787-98.
34. Thille AW, Reynaud F, Marie D, Barrau S, Rousseau L, Rault C, et al. Impact of sleep alterations on weaning duration in mechanically ventilated patients: A prospective study. Eur Respir J 2018;51(4):1702465.
35. Rault C, Sangare A, Diaz V, Ragot S, Frat JP, Raux M, et al. Impact of sleep deprivation on respiratory motor output and endurance. A physiological study. Am J Respir Crit Care Med 2020;201:976-83.
36. Knauert MP, Gilmore EJ, Murphy TE, Yaggi HK, Van Ness PH, Han L, et al. Association between death and loss of stage N2 sleep features among critically ill patients with delirium. J Crit Care 2018;48:124-9.
37. Altman MT, Knauert MP, Pisani MA. Sleep disturbance after hospitalization and critical illness: A systematic review. Ann Am Thorac Soc 2017;14:1457-68.
38. McKinley S, Aitken LM, Alison JA, King M, Leslie G, Burmeister E, et al. Sleep and other factors associated with mental health and psychological distress after intensive care for critical illness. Intensive Care Med 2012;38:627-33.
39. Gandolfi JV, Di Bernardo APA, Chanes DAV, Martin DF, Joles VB, Amendola CP, et al. The effects of melatonin supplementation on sleep quality and assessment of the serum melatonin in ICU patients: A randomized controlled trial. Crit Care Med 2020;48:e1286-e1293.
40. Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Effects of earplugs and eye masks combined with relaxing music on sleep, melatonin and cortisol levels in ICU patients: A randomized controlled trial. Crit Care 2015;19:115.
41. Gehlbach BK, Patel SB, Van Cauter E, Pohlman AS, Hall JB, Zabner J. The effects of timed light exposure in critically ill patients: A randomized controlled pilot clinical trial. Am J Respir Crit Care Med 2018;198:275-8.
42. Demoule A, Carreira S, Lavault S, Pallanca O, Morawiec E, Mayaux J, et al. Impact of earplugs and eye mask on sleep in critically ill patients: A prospective randomized study. Crit Care 2017;21:284.
43. Fang CS, Wang HH, Wang RH, Chou FH, Chang SL, Fang CJ. Effect of earplugs and eye masks on the sleep quality of intensive care unit patients: A systematic review and meta-analysis. J Adv Nurs 2021;77:4321-31.
44. Knauert MP, Pisani M, Redeker N, Murphy T, Araujo K, Jeon S, et al. Pilot study: An intensive care unit sleep promotion protocol. BMJ Open Respir Res 2019 6:e000411.
45. Rault C, Heraud Q, Ragot S, Frat JP, Thille AW, Drouot X. A real time automated sleep scoring algorithm to detect refreshing sleep in conscious ventilated critically ill patients. Neurophysiologie Clinique 2023; in press.
2. Frisk U, Nordstrom G. Patients’ sleep in an intensive care unit-patients’ and nurses’perception. Intensive Crit Care Nurs 2003;19:342-9.
3. Richards KC, O’Sullivan PS, Phillips RL. Measurement of sleep in critically ill patients. J Nurs Meas 2000;8:131-44.
4. Rood P, Frenzel T, Verhage R, Bonn M, van der Hoeven H, Pickkers P, et al. Development and daily use of a numeric rating score to assess sleep quality in ICU patients. J Crit Care 2019;52:68-74.
5. Shilo L, Dagan Y, Smorjik Y, Weinberg U, Dolev S, Komptel B, et al. Patients in the intensive care unit suffer from severe lack of sleep associated with loss of normal melatonin secretion pattern. Am J Med Sci 1999;317:278-81.
6. Dres M, Younes M, Rittayamai N, Kendzerska T, Telias I, Grieco DL, et al. Sleep and pathological wakefulness at the time of liberation from mechanical ventilation (SLEEWE). A prospective multicenter physiological study. Am J Respir Crit Care Med 2019;199:1106-15.
7. LeBlanc JM, Dasta JF and Kane-Gill SL. Role of the bispectral index in sedation monitoring in the ICU. Ann Pharmacother 2006;40:490-500.
8. Drouot X, Quentin S. Sleep neurobiology and critical care illness. Sleep Med Clin 2016;11:105-13.
9. Novaes MA, Aronovich A, Ferraz MB, Knobel E. Stressors in ICU: Patients’evaluation. Intensive Care Med 1997;23:1282-5.
10. Watson PL, Ely EW, Malow B, Pandharipande P. Scoring sleep in critically ill patients: Limitations in standard methodology and the need for revised criteria. Crit Care Med 2006;34:A83.
11. Drouot X, Roche-Campo F, Thille AW, Cabello B, Galia F, Margarit L, et al. A new classification for sleep analysis in critically ill patients. Sleep Med 2012;13:7-14.
12. Devlin JW, Skrobik Y, Gelinas C, Needham DM, Slooter AJC, Pandharipande PP, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med 2018;46:e825-e873.
13. Roche Campo F, Drouot X, Thille AW, Galia F, Cabello B, d’Ortho MP, et al. Poor sleep quality is associated with late noninvasive ventilation failure in patients with acute hypercapnic respiratory failure. Crit Care Med 2010;38:477-85.
14. Elliott R, McKinley S, Cistulli P, Fien M. Characterisation of sleep in intensive care using 24-hour polysomnography: An observational study. Crit Care 2013;17:R46.
15. Gehlbach BK, Chapotot F, Leproult R, Whitmore H, Poston J, Pohlman M, et al. Temporal disorganization of circadian rhythmicity and sleep-wake regulation in mechanically ventilated patients receiving continuous intravenous sedation. Sleep 2012;35:1105-14.
16. Bihari S, Doug McEvoy R, Matheson E, Kim S, Woodman RJ, Bersten AD. Factors affecting sleep quality of patients in intensive care unit. J Clin Sleep Med 2012;8:301-7.
17. Honarmand K, Rafay H, Le J, Mohan S, Rochwerg B, Devlin JW, et al. A systematic review of risk factors for sleep disruption in critically ill adults. Crit Care Med 2020;48:1066-74.
18. Trompeo AC, Vidi Y, Locane MD, Braghiroli A, Mascia L, Bosma K, et al. Sleep disturbances in the critically ill patients: Role of delirium and sedative agents. Minerva Anestesiol 2011;77:604-12.
19. Hofhuis JG, Spronk PE, van Stel HF, Schrijvers AJ, Rommes JH, Bakker J. Experiences of critically ill patients in the ICU. Intensive Crit Care Nurs 2008;24:300-13.
20. Gabor JY, Cooper AB, Crombach SA, Lee B, Kadikar N, Bettger HE, et al. Contribution of the intensive care unit environment to sleep disruption in mechanically ventilated patients and healthy subjects. Am J Respir Crit Care Med 2003;167:708-15.
21. Kamdar BB, King LM, Collop NA, Sakamuri S, Colantuoni E, Neufeld KJ, et al. The effect of a quality improvement intervention on perceived sleep quality and cognition in a medical ICU. Crit Care Med 2013;41:800-9.
22. Nicolas A, Aizpitarte E, Iruarrizaga A, Vazquez M, Margall A, Asiain C. Perception of night-time sleep by surgical patients in an intensive care unit. Nurs Crit Care 2008;13:25-33.
23. Elliott R, Rai T, McKinley S. Factors affecting sleep in the critically ill: An observational study. J Crit Care 2014;29:859-63.
24. Toublanc B, Rose D, Glerant JC, Francois G, Mayeux I, Rodenstein D, et al. Assist-control ventilation vs low levels of pressure support ventilation on sleep quality in intubated ICU patients. Intensive Care Med 2007;33:1148-54.
25. Bosma K, Ferreyra G, Ambrogio C, Pasero D, Mirabella L, Braghiroli A, et al. Patient-ventilator interaction and sleep in mechanically ventilated patients: Pressure support versus proportional assist ventilation. Crit Care Med 2007;35:1048-54.
26. Delisle S, Ouellet P, Bellemare P, Tetrault JP, Arsenault P. Sleep quality in mechanically ventilated patients: Comparison between NAVA and PSV modes. Ann Intensive Care 2011;1:42.
27. Beck F, Leger D, Fressard L, Peretti-Watel P, Verger P. Covid-19 health crisis and lockdown associated with high level of sleep complaints and hypnotic uptake at the population level. J Sleep Res 2021;30:e13119.
28. Zhang J, Xu D, Xie B, Zhang Y, Huang H, Liu H, et al. Poor-sleep is associated with slow recovery from lymphopenia and an increased need for ICU care in hospitalized patients with COVID-19: A retrospective cohort study. Brain Behav Immun 2020;88:50-8.
29. Bourne RS,Mills GH. Sleep disruption in critically ill patients--pharmacological considerations. Anaesthesia 2004;59:374-84.
30. Lewis SR, Schofield-Robinson OJ, Alderson P, Smith AF. Propofol for the promotion of sleep in adults in the intensive care unit. Cochrane Database Syst Rev 2018;1:CD012454.
31. Romagnoli S, Villa G, Fontanarosa L, Tofani L, Pinelli F, De Gaudio AR, et al. Sleep duration and architecture in non-intubated intensive care unit patients: An observational study. Sleep Med 2020;70:79-87.
32. Wu XH, Cui F, Zhang C, Meng ZT, Wang DX, Ma J, et al. Low-dose dexmedetomidine improves sleep quality pattern in elderly patients after noncardiac surgery in the intensive care unit: A pilot randomized controlled trial. Anesthesiology 2016;125:979-91.
33. Babkoff H, Sing HC, Thorne DR, Genser SG, Hegge FW. Perceptual distortions and hallucinations reported during the course of sleep deprivation. Percept Mot Skills 1989;68:787-98.
34. Thille AW, Reynaud F, Marie D, Barrau S, Rousseau L, Rault C, et al. Impact of sleep alterations on weaning duration in mechanically ventilated patients: A prospective study. Eur Respir J 2018;51(4):1702465.
35. Rault C, Sangare A, Diaz V, Ragot S, Frat JP, Raux M, et al. Impact of sleep deprivation on respiratory motor output and endurance. A physiological study. Am J Respir Crit Care Med 2020;201:976-83.
36. Knauert MP, Gilmore EJ, Murphy TE, Yaggi HK, Van Ness PH, Han L, et al. Association between death and loss of stage N2 sleep features among critically ill patients with delirium. J Crit Care 2018;48:124-9.
37. Altman MT, Knauert MP, Pisani MA. Sleep disturbance after hospitalization and critical illness: A systematic review. Ann Am Thorac Soc 2017;14:1457-68.
38. McKinley S, Aitken LM, Alison JA, King M, Leslie G, Burmeister E, et al. Sleep and other factors associated with mental health and psychological distress after intensive care for critical illness. Intensive Care Med 2012;38:627-33.
39. Gandolfi JV, Di Bernardo APA, Chanes DAV, Martin DF, Joles VB, Amendola CP, et al. The effects of melatonin supplementation on sleep quality and assessment of the serum melatonin in ICU patients: A randomized controlled trial. Crit Care Med 2020;48:e1286-e1293.
40. Hu RF, Jiang XY, Hegadoren KM, Zhang YH. Effects of earplugs and eye masks combined with relaxing music on sleep, melatonin and cortisol levels in ICU patients: A randomized controlled trial. Crit Care 2015;19:115.
41. Gehlbach BK, Patel SB, Van Cauter E, Pohlman AS, Hall JB, Zabner J. The effects of timed light exposure in critically ill patients: A randomized controlled pilot clinical trial. Am J Respir Crit Care Med 2018;198:275-8.
42. Demoule A, Carreira S, Lavault S, Pallanca O, Morawiec E, Mayaux J, et al. Impact of earplugs and eye mask on sleep in critically ill patients: A prospective randomized study. Crit Care 2017;21:284.
43. Fang CS, Wang HH, Wang RH, Chou FH, Chang SL, Fang CJ. Effect of earplugs and eye masks on the sleep quality of intensive care unit patients: A systematic review and meta-analysis. J Adv Nurs 2021;77:4321-31.
44. Knauert MP, Pisani M, Redeker N, Murphy T, Araujo K, Jeon S, et al. Pilot study: An intensive care unit sleep promotion protocol. BMJ Open Respir Res 2019 6:e000411.
45. Rault C, Heraud Q, Ragot S, Frat JP, Thille AW, Drouot X. A real time automated sleep scoring algorithm to detect refreshing sleep in conscious ventilated critically ill patients. Neurophysiologie Clinique 2023; in press.
Dans cet article
- Méthodes d’étude du sommeil en réanimation
- Nombreuses altérations du sommeil
- Multiples facteurs perturbant le sommeil en réanimation
- Conséquences néfastes des altérations du sommeil démontrées
- Éviter les médicaments dans la prise en charge des troubles du sommeil en réanimation
- Protéger le sommeil altéré des patients en réanimation