Taux d’incidence en France (cas notifiés) :
– a fortement augmenté, passant de moins de 1/100 000 en 1998 à 2,01/100 000 habitants en 2004 (probablement en raison d’un diagnostic plus aisé) ;
– depuis, il varie entre 1,8 et 2,46/100 000, soit 1 200 à 1 500 cas par an.
Pics : à la saison chaude, entre août et octobre (près de 60 % des cas déclarés).
Rare avant 20 ans, survient surtout après 50 ans (74 à 91 % des patients), prédominance masculine.
En cause dans moins de 2 % des pneumonies communautaires suivies en ambulatoire, < 5 % de celles admises à l’hôpital et 8 % de celles prises en charge en réanimation (40 % des malades hospitalisés).
Acquise en ville dans la majorité des cas (environ 70 %) mais aussi à l’hôpital (≈ 10 %) et lors d’un voyage (20 %).
Le plus souvent : sporadique et sans source identifiée.
Mortalité globale en France : de 10 à 11 %.
Facteurs de risque :
– immunodépression (chimiothérapie pour tumeur solide ou maladie hématologique, corticothérapie, immuno-suppresseur après transplantation ou greffe, anti-TNFα) ;
– âge avancé (> 50 ans) ;
– diabète ;
– tabagisme ;
– consommation excessive d’alcool (pas de consensus) ;
– insuffisance rénale ;
– pathologies chroniques cardiaques et pulmonaires.
Mais aucun facteur dans 20 à 30 % des cas.
Contamination aérienne par inhalation d’aérosols (réseau d’eau chaude collectif, tours de refroidissement, climatisations, douches, jacuzzi…).
Sérogroupe le plus impliqué en France : Lp1 (> 90 % des infections).
Autres espèces en cause : L. micdadei, L. bozemanii, L. longbeachae (bacilles à Gram négatif ubiquitaires de l’eau douce naturelle et des systèmes de distribution de l’eau).
Bactérie résistante à la chaleur (températures > 50 °C) pendant plusieurs heures ; mais elle ne se multiplie pas à moins de 20-25 °C (prolifération dans des amibes formant un biofilm).
– a fortement augmenté, passant de moins de 1/100 000 en 1998 à 2,01/100 000 habitants en 2004 (probablement en raison d’un diagnostic plus aisé) ;
– depuis, il varie entre 1,8 et 2,46/100 000, soit 1 200 à 1 500 cas par an.
Pics : à la saison chaude, entre août et octobre (près de 60 % des cas déclarés).
Rare avant 20 ans, survient surtout après 50 ans (74 à 91 % des patients), prédominance masculine.
En cause dans moins de 2 % des pneumonies communautaires suivies en ambulatoire, < 5 % de celles admises à l’hôpital et 8 % de celles prises en charge en réanimation (40 % des malades hospitalisés).
Acquise en ville dans la majorité des cas (environ 70 %) mais aussi à l’hôpital (≈ 10 %) et lors d’un voyage (20 %).
Le plus souvent : sporadique et sans source identifiée.
Mortalité globale en France : de 10 à 11 %.
Facteurs de risque :
– immunodépression (chimiothérapie pour tumeur solide ou maladie hématologique, corticothérapie, immuno-suppresseur après transplantation ou greffe, anti-TNFα) ;
– âge avancé (> 50 ans) ;
– diabète ;
– tabagisme ;
– consommation excessive d’alcool (pas de consensus) ;
– insuffisance rénale ;
– pathologies chroniques cardiaques et pulmonaires.
Mais aucun facteur dans 20 à 30 % des cas.
Contamination aérienne par inhalation d’aérosols (réseau d’eau chaude collectif, tours de refroidissement, climatisations, douches, jacuzzi…).
Sérogroupe le plus impliqué en France : Lp1 (> 90 % des infections).
Autres espèces en cause : L. micdadei, L. bozemanii, L. longbeachae (bacilles à Gram négatif ubiquitaires de l’eau douce naturelle et des systèmes de distribution de l’eau).
Bactérie résistante à la chaleur (températures > 50 °C) pendant plusieurs heures ; mais elle ne se multiplie pas à moins de 20-25 °C (prolifération dans des amibes formant un biofilm).
Une pneumopathie sans particularité
Très évocateurs : notion de voyage récent, absence de contrôle d’une pneumonie par bêtalactamines, cas groupés de pneumonies.
Période d’incubation : de 2 à 14 jours.
Symptômes :
– non spécifiques en phase prodromique : fièvre, céphalées, myalgies, asthénie ;
– toux non productive dans la moitié des cas ;
– douleurs thoraciques possibles ;
– manifestations digestives (diarrhée, vomissements, douleurs abdominales) et/ou neurologiques (confusion, obnubilation, crise convulsive, voire signes déficitaires focaux) ;
– pneumonie sévère.
Autres signes :
– radio non contributive (mais tendance à l’excavation chez l’immunodéprimé) ;
– insuffisance rénale et élévation des créatine phosphokinases : évocatrices mais non spécifiques (grippe par exemple).
Critères de gravité et d’hospitalisation : comorbidité, immunodépression, signes d’insuffisance respiratoire aiguë.
Période d’incubation : de 2 à 14 jours.
Symptômes :
– non spécifiques en phase prodromique : fièvre, céphalées, myalgies, asthénie ;
– toux non productive dans la moitié des cas ;
– douleurs thoraciques possibles ;
– manifestations digestives (diarrhée, vomissements, douleurs abdominales) et/ou neurologiques (confusion, obnubilation, crise convulsive, voire signes déficitaires focaux) ;
– pneumonie sévère.
Autres signes :
– radio non contributive (mais tendance à l’excavation chez l’immunodéprimé) ;
– insuffisance rénale et élévation des créatine phosphokinases : évocatrices mais non spécifiques (grippe par exemple).
Critères de gravité et d’hospitalisation : comorbidité, immunodépression, signes d’insuffisance respiratoire aiguë.
Quels outils diagnostiques ?
Détection d’antigènes urinaires :
– examen de référence : échantillon facile à obtenir, positivité dans les 2 à 4 jours suivant les premiers signes, résultats rapides ;
– peut être réalisée en ville ;
– pour le sérogroupe Lp1 : sensibilité et spécificité bonnes, voire excellentes, surtout si urines concentrées ; sensibilité plus élevée pour certains sous-types (Lp1 Mab 3/1 positif) que pour d’autres (Lp1 Mab 3/1 négatif) ; positivité pendant plusieurs semaines ou mois après la contamination (en moyenne 2 mois) ;
– mise en défaut si une autre espèce ou sérogroupe est en cause (surtout infections acquises à l’hôpital).
En cas de suspicion, prélèvement respiratoire (même si antigènes urinaires retrouvés) et transfert rapide au laboratoire pour culture de la bactérie :
– si infection acquise en ville : expectoration ;
– à l’hôpital : expectoration, aspiration trachéale ou lavage broncho-alvéolaire ;
– à réaliser avant l’antibiothérapie (mais possible après) ;
– la culture positive permet le diagnostic microbiologique mais aussi la comparaison de la souche avec celles environnementales (surveillance épidémiologique), mais elle est lente (jusqu’à 10 jours) et difficile.
PCR :
– technique d’avenir, surtout la « multiplex » qui identifie dans le même temps d’autres agents à l’origine de pneumonies ;
– plusieurs tests commercialisés : à réaliser sur prélèvements respiratoires, sang, urines ; peuvent détecter des infections autres qu’à Lp1.
Sérologie : ne permet qu’un diagnostic rétrospectif.
– examen de référence : échantillon facile à obtenir, positivité dans les 2 à 4 jours suivant les premiers signes, résultats rapides ;
– peut être réalisée en ville ;
– pour le sérogroupe Lp1 : sensibilité et spécificité bonnes, voire excellentes, surtout si urines concentrées ; sensibilité plus élevée pour certains sous-types (Lp1 Mab 3/1 positif) que pour d’autres (Lp1 Mab 3/1 négatif) ; positivité pendant plusieurs semaines ou mois après la contamination (en moyenne 2 mois) ;
– mise en défaut si une autre espèce ou sérogroupe est en cause (surtout infections acquises à l’hôpital).
En cas de suspicion, prélèvement respiratoire (même si antigènes urinaires retrouvés) et transfert rapide au laboratoire pour culture de la bactérie :
– si infection acquise en ville : expectoration ;
– à l’hôpital : expectoration, aspiration trachéale ou lavage broncho-alvéolaire ;
– à réaliser avant l’antibiothérapie (mais possible après) ;
– la culture positive permet le diagnostic microbiologique mais aussi la comparaison de la souche avec celles environnementales (surveillance épidémiologique), mais elle est lente (jusqu’à 10 jours) et difficile.
PCR :
– technique d’avenir, surtout la « multiplex » qui identifie dans le même temps d’autres agents à l’origine de pneumonies ;
– plusieurs tests commercialisés : à réaliser sur prélèvements respiratoires, sang, urines ; peuvent détecter des infections autres qu’à Lp1.
Sérologie : ne permet qu’un diagnostic rétrospectif.
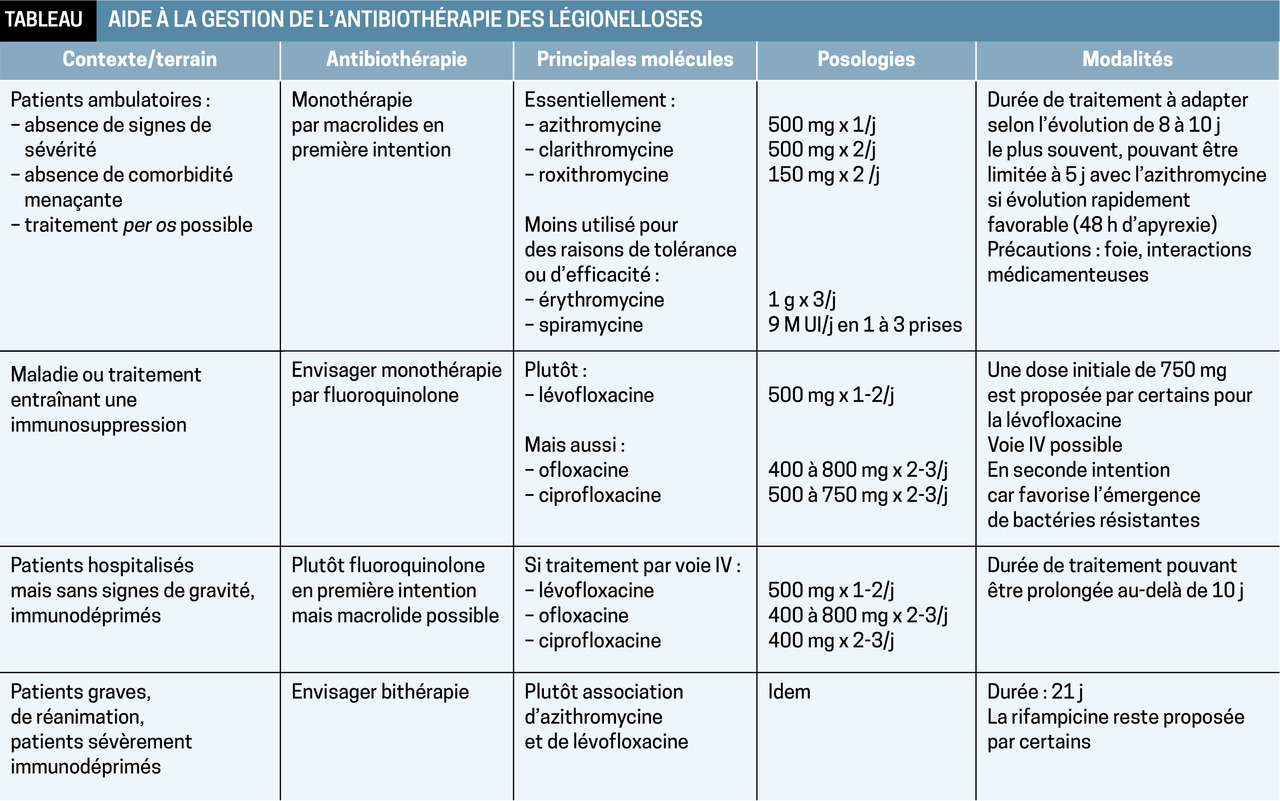
Quelle antibiothérapie ?
Traitement probabiliste précoce, qui peut être rapidement interrompu, parfois après une seule dose, si l’antigénurie s’avère négative.
En première intention, macrolides : azithromycine (le plus actif), clarithromycine ou roxithromycine sont à préférer, en raison de leur diffusion intracellulaire, à l’érythromycine (souvent mal tolérée) ou à la spiramycine (probablement moins efficace).
Chez les transplantés ou greffés : fluoroquinolones (lévofloxacine ou ofloxacine) car les macrolides peuvent modifier les concentrations sériques des immunosuppresseurs (tacrolimus et ciclosporine).
Formes sévères justifiant soins intensifs ou réanimation : association macrolides-fluoroquinolones.
Déclaration de la maladie : obligatoire, elle déclenche une enquête conduite par l’ARS.
Prévention : des mesures sont appliquées depuis 2005 aux établissements de santé, aux cures thermales, aux tours aéroréfrigérantes, afin de lutter contre la corrosion et la stagnation de l’eau.
A. Gacouin déclare n’avoir aucun lien d’intérêts.
En première intention, macrolides : azithromycine (le plus actif), clarithromycine ou roxithromycine sont à préférer, en raison de leur diffusion intracellulaire, à l’érythromycine (souvent mal tolérée) ou à la spiramycine (probablement moins efficace).
Chez les transplantés ou greffés : fluoroquinolones (lévofloxacine ou ofloxacine) car les macrolides peuvent modifier les concentrations sériques des immunosuppresseurs (tacrolimus et ciclosporine).
Formes sévères justifiant soins intensifs ou réanimation : association macrolides-fluoroquinolones.
Déclaration de la maladie : obligatoire, elle déclenche une enquête conduite par l’ARS.
Prévention : des mesures sont appliquées depuis 2005 aux établissements de santé, aux cures thermales, aux tours aéroréfrigérantes, afin de lutter contre la corrosion et la stagnation de l’eau.
Pour en savoir plus
Camou F, Issa N. Traitement des pneumopathies infectieuses. Rev Prat 2016;66: 587-92.
De Lastours V, Fantin B. Prescription des quinolones : quel avenir ? Rev Prat 2016;66:239-44.
De Lastours V, Fantin B. Prescription des quinolones : quel avenir ? Rev Prat 2016;66:239-44.