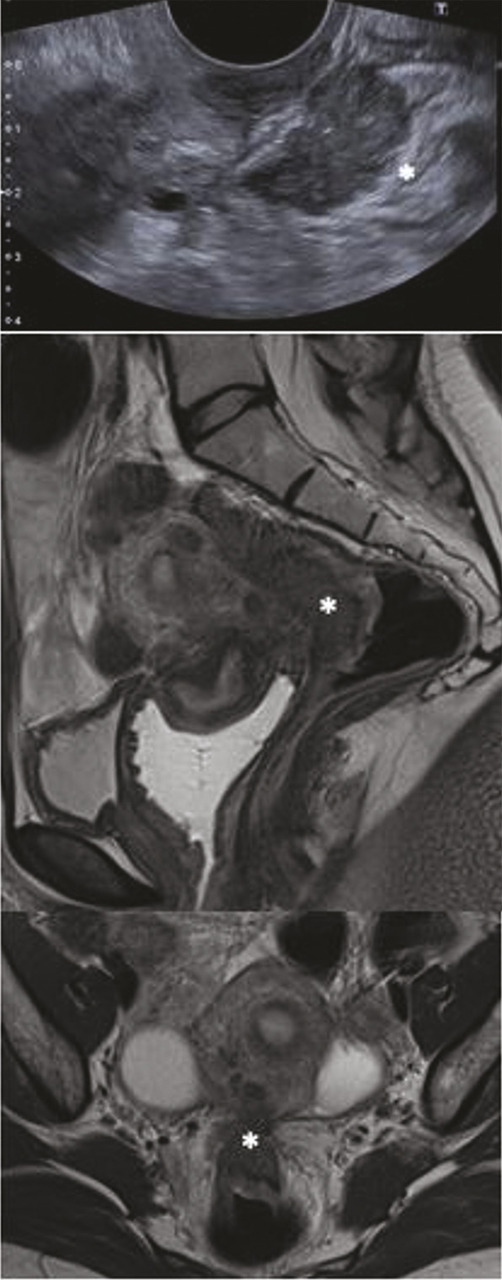
Multifactorielle et multifocale, l’endométriose est une affection préoccupante dont la prise en charge doit être multidisciplinaire et répondre aux recommandations actualisées.
L’endométriose est une maladie avant tout gynécologique dont la définition est histologique et le tableau clinique parfois complexe. Elle est définie par la prolifération de glandes ou de stroma endométrial en dehors de la cavité utérine. Sa prévalence, en augmentation ces dernières années, se situe autour de 10 % des femmes en âge de procréer.1 Hormonodépendante (aux œstrogènes), elle peut être responsable de douleurs pelviennes chroniques et d’une infertilité.
Il existe plusieurs formes d’endométriose :2 l’adénomyose, caractérisée par la prolifération du tissu endométrial dans le muscle utérin, péritonéale superficielle, ovarienne kystique (endométriome ovarien) ou pelvienne profonde (sous-péritonéale). L’atteinte digestive fait partie de l’endométriose pelvienne profonde, définie comme une lésion endométriosique pénétrant dans l’espace rétropéritonéal et/ou la paroi des organes pelviens à une profondeur d’au moins 5 mm.3 Elle est antérieure lorsqu’elle touche la vessie, et postérieure lorsqu’elle touche les ligaments utérosacrés, la cloison rectovaginale ou le rectosigmoïde.
Il existe plusieurs formes d’endométriose :2 l’adénomyose, caractérisée par la prolifération du tissu endométrial dans le muscle utérin, péritonéale superficielle, ovarienne kystique (endométriome ovarien) ou pelvienne profonde (sous-péritonéale). L’atteinte digestive fait partie de l’endométriose pelvienne profonde, définie comme une lésion endométriosique pénétrant dans l’espace rétropéritonéal et/ou la paroi des organes pelviens à une profondeur d’au moins 5 mm.3 Elle est antérieure lorsqu’elle touche la vessie, et postérieure lorsqu’elle touche les ligaments utérosacrés, la cloison rectovaginale ou le rectosigmoïde.
Une physiopathologie encore mal connue
La principale hypothèse permettrait d’expliquer la migration asymétrique des cellules endométriales en dehors de la muqueuse utérine : un reflux transtubaire (régurgitation menstruelle) par lequel les cellules endométriales migrent et se développent de manière ectopique dans le pelvis. Les autres hypothèses ne sont pas retenues (métaplasie müllérienne, cellules souches endométriales issues de la moelle osseuse, emboles lymphatiques et vasculaires). L’inflammation, des phénomènes immunitaires, des facteurs génétiques et la synthèse d’hormones stéroïdiennes sont les mécanismes associés qui favorisent l’implantation et la croissance des lésions endométriosiques.
L’extension de l’endométriose peut être précisée par le score AFSr (score de l’American Fertility Society, révisé en 1985) dont les quatre stades dépendent de l’invasion en profondeur (I : minime, II : moyenne, III : modérée, IV : sévère).4 Cette classification ne décrit que les lésions endométriosiques infiltrantes profondes, raison pour laquelle les auteurs du groupe germanophone de la Fondation de recherche sur l’endométriose (Stiftung Endometriose-Forschung [SEF]) ont proposé une nouvelle classification selon Enzian, révisée en 2011. Cette classification simplifiée compartimente les femmes atteintes en trois groupes dont le groupe C est dédié au tube digestif.5
L’extension de l’endométriose peut être précisée par le score AFSr (score de l’American Fertility Society, révisé en 1985) dont les quatre stades dépendent de l’invasion en profondeur (I : minime, II : moyenne, III : modérée, IV : sévère).4 Cette classification ne décrit que les lésions endométriosiques infiltrantes profondes, raison pour laquelle les auteurs du groupe germanophone de la Fondation de recherche sur l’endométriose (Stiftung Endometriose-Forschung [SEF]) ont proposé une nouvelle classification selon Enzian, révisée en 2011. Cette classification simplifiée compartimente les femmes atteintes en trois groupes dont le groupe C est dédié au tube digestif.5
Différents facteurs de risque
L’endométriose est multifactorielle, notamment génétique et environnementale.2 Le rôle de la génétique a été mis en évidence, et de multiples gènes impliqués, devant une prédisposition familiale importante (risque 5 fois plus élevé qu’en population générale en cas d’endométriose chez une apparentée au premier degré). L’âge, entre 25 et 35 ans, le fait d’être nulligeste, une puberté précoce, des cycles menstruels courts (avec augmentation de la durée et de l’abondance des règles), un niveau socioéconomique élevé sont des facteurs de risque. Le rôle des perturbateurs endocriniens est souvent évoqué, bien que controversé.
L’endométriose digestive en pratique clinique
L’endométriose profonde peut typiquement atteindre les ligaments utéro-sacrés (50 % des cas), le cul-de-sac vaginal postérieur (15 %), l’intestin, majoritairement la face antérieure du rectum et la jonction rectosigmoïdienne (6-30 %),6 la vessie (10 %), les uretères (3 %) et, au-delà de la cavité pelvienne, le sigmoïde, le côlon droit, l’appendice et plus rarement l’iléon terminal.2 Les lésions sont le plus souvent associées entre elles et multifocales ; 50 % des formes sévères d’endométriose profonde sont rectosigmoïdiennes. Une lésion d’endométriose digestive n’est isolée que dans 10 % des cas.
Un rythme cataménial est évocateur
Les symptômes apparaissent ou s’aggravent dans deux situations cliniques différentes. D’une part, chez la femme jeune (25-35 ans), après l’arrêt d’une contraception orale pour un projet de grossesse. D’autre part, chez la femme un peu plus âgée (au-delà de 35 ans) ayant alterné des périodes de contraception orale et de grossesse (non nullipare) et souhaitant changer de système contraceptif au profit d’un dispositif intra-utérin.
Les signes fonctionnels évocateurs d’endométriose pelvienne profonde postérieure sont des douleurs pelviennes chroniques cataméniales, incluant la dysménorrhée et la dyschésie (douleurs pelviennes le plus souvent avant la défécation), la dyspareunie profonde posturale et postérieure, par atteinte des ligaments utéro-sacrés ou de la paroi vaginale postérieure, les douleurs pelviennes chroniques hors cycle menstruel et l’infertilité.7
Il est important d’interroger la patiente sur le caractère cyclique des symptômes, avec une majoration en période périmenstruelle.
Le seul questionnaire diagnostique d’endométriose profonde, validé en langue française, est celui qui inclut les douleurs à la défécation pendant les règles et les dyspareunies profondes sévères (EVA [échelle visuelle analogique] ≥ 8). Il permet de poser le diagnostic d’endométriose profonde postérieure, avec une sensibilité de 74,5 % et une spécificité de 68,7 %.8
Les rectorragies cataméniales sont présentes dans moins de 10 % des atteintes rectales, mais ne sont pas spécifiques car il peut aussi s’agir d’une maladie hémorroïdaire cataméniale.
Les signes fonctionnels évocateurs d’endométriose pelvienne profonde postérieure sont des douleurs pelviennes chroniques cataméniales, incluant la dysménorrhée et la dyschésie (douleurs pelviennes le plus souvent avant la défécation), la dyspareunie profonde posturale et postérieure, par atteinte des ligaments utéro-sacrés ou de la paroi vaginale postérieure, les douleurs pelviennes chroniques hors cycle menstruel et l’infertilité.7
Il est important d’interroger la patiente sur le caractère cyclique des symptômes, avec une majoration en période périmenstruelle.
Le seul questionnaire diagnostique d’endométriose profonde, validé en langue française, est celui qui inclut les douleurs à la défécation pendant les règles et les dyspareunies profondes sévères (EVA [échelle visuelle analogique] ≥ 8). Il permet de poser le diagnostic d’endométriose profonde postérieure, avec une sensibilité de 74,5 % et une spécificité de 68,7 %.8
Les rectorragies cataméniales sont présentes dans moins de 10 % des atteintes rectales, mais ne sont pas spécifiques car il peut aussi s’agir d’une maladie hémorroïdaire cataméniale.
Attention à l’intestin irritable
Le syndrome de l’intestin irritable (SII) est lui aussi évocateur, avec des épisodes de diarrhée et de constipation, des douleurs abdominales à type d’épreintes ou de ténesmes. Selon une méta-analyse, il est environ 3,6 fois plus fréquent chez les femmes porteuses d’endométriose que dans la population générale.9 Il peut retarder le diagnostic et la prise en charge de l’endométriose, parfois de plusieurs années.
Enfin, un syndrome (sub)occlusif peut faire suspecter une atteinte digestive sténosante (environ 25 % des femmes souffrant d’endométriose profonde)10 ou être lié à des adhérences chez des patientes précédemment opérées d’une endométriose profonde.
Dans la littérature, la valeur prédictive positive des touchers pelviens est diversement appréciée, fonction de la prévalence et des différentes formes de la maladie. Un toucher vaginal, un examen gynécologique au spéculum et un toucher rectal sont des éléments importants de l’examen physique, bien que le toucher rectal soit anormal dans 35 % des cas d’endométriose digestive.7
Enfin, un syndrome (sub)occlusif peut faire suspecter une atteinte digestive sténosante (environ 25 % des femmes souffrant d’endométriose profonde)10 ou être lié à des adhérences chez des patientes précédemment opérées d’une endométriose profonde.
Dans la littérature, la valeur prédictive positive des touchers pelviens est diversement appréciée, fonction de la prévalence et des différentes formes de la maladie. Un toucher vaginal, un examen gynécologique au spéculum et un toucher rectal sont des éléments importants de l’examen physique, bien que le toucher rectal soit anormal dans 35 % des cas d’endométriose digestive.7
Trois examens d’imagerie font référence
Une fois le diagnostic évoqué, des examens complémentaires non invasifs s’imposent. Trois examens font référence pour étudier la progression en profondeur de l’endométriose, à savoir l’imagerie par résonance magnétique (IRM) pelvienne, l’échographie transvaginale (ETV) et l’écho-endoscopie rectale (EER). Ils doivent être réalisés par des opérateurs entraînés.
De nombreuses méta-analyses comparent les différentes techniques d’imagerie en étudiant les méthodologies et les performances.11 Ces dernières varient en fonction de la localisation de l’endométriose. L’IRM paraît être l’examen le plus complet en cas d’endométriose profonde, notamment pour effectuer le bilan d’extension et surveiller l’évolution de la maladie. Elle est souvent prescrite en cas de suspicion clinique et/ou échographique.
Une méta-analyse a comparé les résultats préopératoires des différentes imageries non invasives (ETV, IRM, EER et scanner pour poser le diagnostic de l’endométriose rectosigmoïdienne) aux données chirurgicales, considérées comme le gold standard.12 Elle conclut que la sensibilité de l’EER semble un peu supérieure à celle de l’IRM (92 % vs 86 %). Les spécificités de l’IRM et de l’ETV étaient excellentes (97 % et 96 %). Les auteurs estiment que l’ETV peut être intéressante en première ligne, par sa faisabilité et son accessibilité en pratique clinique.
Un autre travail a rapporté de bons niveaux de sensibilité et de valeur prédictive négative de l’EER pour détecter l’endométriose rectosigmoïdienne, supérieures à celles d’autres techniques13 (tableau 1 ).
Réaliser plusieurs examens complémentaires augmente de façon importante la sensibilité diagnostique. En effet, selon une étude qui a porté sur 407 patientes,14 associer l’IRM et l’écho-endoscopie rectale pour poser le diagnostic d’endométriose colorectale augmentait la sensibilité de détection de 10 %, et le diagnostic était confirmé en peropératoire dans 100 % des cas lorsque les deux examens étaient concordants (figure ).15
L’EER étant plus contraignante en termes d’organisation, elle est le plus souvent proposée dans le cadre du bilan d’extension locorégional, et surtout en préopératoire, lorsqu’une atteinte digestive est suspectée. Elle permet d’anticiper et de préciser la nature du geste chirurgical.
La coloscopie n’a que très peu d’indication car elle est le plus souvent normale. Si elle est réalisée, en cas de symptômes digestifs cycliques ou non (troubles du transit, rectorragies, douleurs abdominales), il faut se méfier d’une sténose digestive, notamment au niveau de la charnière rectosigmoïdienne, dont la muqueuse est macroscopiquement normale dans 90 % des cas.
De nombreuses méta-analyses comparent les différentes techniques d’imagerie en étudiant les méthodologies et les performances.11 Ces dernières varient en fonction de la localisation de l’endométriose. L’IRM paraît être l’examen le plus complet en cas d’endométriose profonde, notamment pour effectuer le bilan d’extension et surveiller l’évolution de la maladie. Elle est souvent prescrite en cas de suspicion clinique et/ou échographique.
Une méta-analyse a comparé les résultats préopératoires des différentes imageries non invasives (ETV, IRM, EER et scanner pour poser le diagnostic de l’endométriose rectosigmoïdienne) aux données chirurgicales, considérées comme le gold standard.12 Elle conclut que la sensibilité de l’EER semble un peu supérieure à celle de l’IRM (92 % vs 86 %). Les spécificités de l’IRM et de l’ETV étaient excellentes (97 % et 96 %). Les auteurs estiment que l’ETV peut être intéressante en première ligne, par sa faisabilité et son accessibilité en pratique clinique.
Un autre travail a rapporté de bons niveaux de sensibilité et de valeur prédictive négative de l’EER pour détecter l’endométriose rectosigmoïdienne, supérieures à celles d’autres techniques13 (
Réaliser plusieurs examens complémentaires augmente de façon importante la sensibilité diagnostique. En effet, selon une étude qui a porté sur 407 patientes,14 associer l’IRM et l’écho-endoscopie rectale pour poser le diagnostic d’endométriose colorectale augmentait la sensibilité de détection de 10 %, et le diagnostic était confirmé en peropératoire dans 100 % des cas lorsque les deux examens étaient concordants (
L’EER étant plus contraignante en termes d’organisation, elle est le plus souvent proposée dans le cadre du bilan d’extension locorégional, et surtout en préopératoire, lorsqu’une atteinte digestive est suspectée. Elle permet d’anticiper et de préciser la nature du geste chirurgical.
La coloscopie n’a que très peu d’indication car elle est le plus souvent normale. Si elle est réalisée, en cas de symptômes digestifs cycliques ou non (troubles du transit, rectorragies, douleurs abdominales), il faut se méfier d’une sténose digestive, notamment au niveau de la charnière rectosigmoïdienne, dont la muqueuse est macroscopiquement normale dans 90 % des cas.
Traitement : les recommandations de la HAS et du CNGOF
Le traitement est optimal lorsque le diagnostic est le plus précoce possible. Il peut être médical, pour la plupart des femmes concernées par l’endométriose digestive profonde, ou chirurgical. Choisi en réunion pluridisciplinaire, il tient compte des souhaits de la patiente, de la localisation anatomique, de la taille et de l’évolution des lésions. Il est fondé sur la double prise en charge des douleurs et de l’infertilité.13
Le traitement médical est symptomatique et agit sur la part inflammatoire de l’endométriose digestive, sans traiter la fibrose constituée ; la maladie peut donc poursuivre sa progression. Il permet de différer la chirurgie ou de la compléter et repose sur les anti-inflammatoires non stéroïdiens, les antalgiques ou des traitements hormonaux. Les pilules contraceptives sont des œstroprogestatifs ou des progestatifs seuls dont le but est de créer une aménorrhée.16 Celle-ci permet de soulager les douleurs et les signes digestifs. Elle n’a que peu d’effet sur les dyspareunies ou les douleurs digestives secondaires à une sténose, qui sont liées à la part fibrosante de la maladie. La prescription d’une contraception hormonale doit respecter les précautions d’emploi et contre-indications, dont la grossesse (tableau 2 ).17 Quant à l’acétate de chlormadinone, compte tenu du sur-risque démontré de méningiome, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié et mis à jour en 2021 ses recommandations d’utilisation.18
Les agonistes de la gonadolibérine (GnRh) sont une autre option thérapeutique, qui doit être de courte durée car elle favorise la déminéralisation osseuse.
Le traitement médical est symptomatique et agit sur la part inflammatoire de l’endométriose digestive, sans traiter la fibrose constituée ; la maladie peut donc poursuivre sa progression. Il permet de différer la chirurgie ou de la compléter et repose sur les anti-inflammatoires non stéroïdiens, les antalgiques ou des traitements hormonaux. Les pilules contraceptives sont des œstroprogestatifs ou des progestatifs seuls dont le but est de créer une aménorrhée.16 Celle-ci permet de soulager les douleurs et les signes digestifs. Elle n’a que peu d’effet sur les dyspareunies ou les douleurs digestives secondaires à une sténose, qui sont liées à la part fibrosante de la maladie. La prescription d’une contraception hormonale doit respecter les précautions d’emploi et contre-indications, dont la grossesse (
Les agonistes de la gonadolibérine (GnRh) sont une autre option thérapeutique, qui doit être de courte durée car elle favorise la déminéralisation osseuse.
Quelles indications pour la chirurgie ?
Le traitement chirurgical vise aussi à traiter l’endométriose symptomatique, l’objectif étant de soulager la patiente. La plupart des études portant sur la chirurgie évaluent son effet sur la douleur et l’indication d’une reprise chirurgicale. Selon une revue systématique de la littérature19 : 11,8 % des femmes opérées rappor-tent l’absence d’effet sur la douleur et 22,6 % ont dû être réopérées.
Les principales exérèses chirurgicales intéressant la sphère digestive sont la résection segmentaire, le shaving et la nodulectomie, dont la résection discoïde est la plus utilisée.13
La résection segmentaire est la technique la plus ancienne mais de moins en moins réalisée du fait de sa morbidité et de l’émergence de techniques plus conservatrices dont le pronostic fonctionnel est meilleur. Elle est indiquée en cas de contre-indication au traitement médical continu, de symptômes digestifs prédominants, d’âge jeune avec désir de grossesse, de lésion rectale étendue, d’infiltration sigmoïdienne ou de localisations multiples.
Le shaving est une technique de « pelage » de la paroi antérieure du rectum infiltrée par un nodule profond au contact. Il est plutôt destiné aux patientes sans projet de grossesse, chez lesquelles le traitement médical continu est efficace, avec des nodules de moins de 2 cm de diamètre, ou entre 2 et 4 cm mais sans atteinte de la sous-muqueuse. Une atteinte du sigmoïde contre-indique cette technique.
Enfin, la nodulectomie concerne les atteintes digestives intermédiaires de la musculeuse ou de la circonférence de la paroi digestive chez des patientes dont le traitement médical n’est pas efficace ou contre-indiqué, avec un désir de grossesse.
Un consensus d’experts, publié en 2016, propose un algorithme de choix thérapeutique chirurgical chez les patientes douloureuses avec endométriose profonde.20
Un questionnaire de qualité de vie comportant 36 items (SF-36 questionnaire) pour les patientes qui reçoivent un traitement médical ou chirurgical de l’endométriose profonde a été mis au point et évalué. Il semble être un outil pratique pré- et post-thérapeutique pour évaluer l’efficacité de la prise en charge de ces patientes.21
Les principales exérèses chirurgicales intéressant la sphère digestive sont la résection segmentaire, le shaving et la nodulectomie, dont la résection discoïde est la plus utilisée.13
La résection segmentaire est la technique la plus ancienne mais de moins en moins réalisée du fait de sa morbidité et de l’émergence de techniques plus conservatrices dont le pronostic fonctionnel est meilleur. Elle est indiquée en cas de contre-indication au traitement médical continu, de symptômes digestifs prédominants, d’âge jeune avec désir de grossesse, de lésion rectale étendue, d’infiltration sigmoïdienne ou de localisations multiples.
Le shaving est une technique de « pelage » de la paroi antérieure du rectum infiltrée par un nodule profond au contact. Il est plutôt destiné aux patientes sans projet de grossesse, chez lesquelles le traitement médical continu est efficace, avec des nodules de moins de 2 cm de diamètre, ou entre 2 et 4 cm mais sans atteinte de la sous-muqueuse. Une atteinte du sigmoïde contre-indique cette technique.
Enfin, la nodulectomie concerne les atteintes digestives intermédiaires de la musculeuse ou de la circonférence de la paroi digestive chez des patientes dont le traitement médical n’est pas efficace ou contre-indiqué, avec un désir de grossesse.
Un consensus d’experts, publié en 2016, propose un algorithme de choix thérapeutique chirurgical chez les patientes douloureuses avec endométriose profonde.20
Un questionnaire de qualité de vie comportant 36 items (SF-36 questionnaire) pour les patientes qui reçoivent un traitement médical ou chirurgical de l’endométriose profonde a été mis au point et évalué. Il semble être un outil pratique pré- et post-thérapeutique pour évaluer l’efficacité de la prise en charge de ces patientes.21
Une démarche collégiale
L’endométriose digestive fait partie intégrante de l’endométriose profonde. Sa prise en charge est multidisciplinaire car les lésions digestives ne sont que rarement isolées. Le traitement de l’infertilité, des douleurs, des signes digestifs est complexe et repose sur une batterie d’examens complémentaires. L’IRM pelvienne, l’échographie transvaginale et l’écho-endoscopie rectale constituent le trépied diagnostique de cette maladie, qui permet d’adapter au mieux les décisions thérapeutiques. Celles-ci dépendent aussi des choix de la patiente, notamment de son désir de grossesse. La prise en charge peut être médicale seule, chirurgicale seule ou mixte.
Références
1. Sarria-Santamera A, Orazumbekova B, Terzic M, Issanov A, Chaowen C, Asùnsolo-del-Barco A. Systematic review and meta-analysis of incidence and prevalence of endometriosis. Healthcare 2020;9(1):29.
2. Recommandations pour la pratique clinique élaborées par le CNGOF. Prise en charge de l’endométriose. Texte des recommandations. J Gynecol Obstet Biol Reprod 2007;36:186-90.
3. Fritel X. Les formes anatomocliniques de l’endométriose. J Gynecol Obstet Biol Reprod 2007;36:113-8.
4. No authors listed. Revised American Fertility Society classification of endometriosis: 1985. Fertil Steril 1985;43:351-2.
5. Haas D, Shebl O, Shamiyeh A, Oppelt P. The rASRM score and the Enzian classification for endometriosis: their strengths and weaknesses. Acta Obstet Gynecol Scand 2013;92:3-7.
6. Régenet N, Metairie S, Cousin GM, Lehur PA. Colorectal endometriosis. Diagnosis and management. Ann Chir 2001;126:734-42.
7. Palazzo L, Roseau G. Comment faire le diagnostic d’une endométriose rectosigmoïdienne ? Post’U 2013;281-92. Disponible sur : https://www.fmcgastro.org/wp-content/uploads/file/pdf-2013/diagnostic-endometriose.pdf
8. Chapron C, Barakat H, Fritel X, Dubuisson JB, Breart G, Fauconnier A. Presurgical diagnosis of posterior deep infiltrating endometriosis based on a standardized questionnaire. Hum Reprod 2005;20:507-13.
9. Chiaffarino F, Cipriani S, Ricci E, Mauri PA, Esposito G, Barretta M, et al. Endometriosis and irritable bowel syndrome: a systematic review and meta-analysis. Arch Gynecol Obstet 2021;303:17-25.
10. Roman H, Ness J, Suciu N, Bridoux V, Gourcerol G, Leroi AM, et al. Are digestive symptoms in women presenting with pelvic endometriosis specific to lesion localizations? A preliminary prospective study. Hum Reprod 2012;27:3440-9.
11. Guerriero S, Saba L, Pascual MA, Ajossa S, Rodriguez I, Mais V, et al. Transvaginal ultrasound vs magnetic resonance imaging for diagnosing deep infiltrating endometriosis: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2018;51:586-95.
12. Gerges B, Li W, Leonardi M, Mol BW, Condous G. Optimal imaging modality for detection of rectosigmoid deep endometriosis: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2021;58:190-200.
13. Roseau G. Endométriose colo-rectale, comment diagnostiquer et traiter ? Post’U 2020;277-86. Disponible sur : https://www.fmcgastro.org/wp-content/uploads/2020/05/277_020_Roseau.pdf
14. Kanté F, Belghiti J, Roseau G, Thomassin-Naggara I, Bazot M, Daraï E, et al. Comparison of the accuracy of rectal endoscopic sonography and magnetic resonance imaging in the diagnosis of colorectal endometriosis. Gynecol Obstet Fertil Senol 2017;45:131-6.
15. Thomassin-Naggara I, Maitrot-Mantelet L, Bordonné C, Millischer-Bellaiche AE. L’imagerie dans le diagnostic de l’endométriose. AP-HP 2021. Disponible sur : https://www.aphp.fr/patient-public/endometriose/recommandations-endometriose/limagerie-dans-le-diagnostic-de
16. Millochau JC, Abo C, Darwish B, Huet E, Dietrich G, Roman H. Continuous amenorrhea may be insufficient to stop the progression of colorectal endometriosis. J Minim Invasive Gynecol 2016;23:839-42.
17. CNGOF. Recommandations pour la pratique clinique. Contraception. 2018. Disponible sur : http://www.cngof.fr/pratiques-cliniques/recommandations-pour-la-pratique-clinique?folder=RPC%2BCOLLEGE%252F2018
18. ANSM. Situations pour lesquelles l’utilisation de Lutényl/Lutéran peut être envisagée ou non au regard du rapport bénéfice-risque, et conduite à tenir. 2021. Disponible sur : https://ansm.sante.fr/dossiers-thematiques/lutenyl-luteran/recommandations-dutilisation-et-de-suivi-des-femmes
19. Singh SS, Gude K, Perdeaux E, Gattrell WT, Becker CM. Surgical outcomes in patients with endometriosis: a systematic review. J Obstet Gynaecol Can 2020;42:881-888.e11.
20. Vanhie A, Meuleman C, Tomassetti C, Timmerman D, D’Hoore A, Wolthuis A, et al. Consensus on recording deep endometriosis surgery: the CORDES statement. Hum Reprod 2016;31:1219-23. Erratum in: Hum Reprod 2016;31:2660.
21. Sima RM, Pleş L, Socea B, Sklavounos P, Negoi I, Stănescu AD, et al. Evaluation of the SF-36 questionnaire for assessment of the quality of life of endometriosis patients undergoing treatment: A systematic review and meta-analysis. Exp Ther Med 2021;22:1283.
2. Recommandations pour la pratique clinique élaborées par le CNGOF. Prise en charge de l’endométriose. Texte des recommandations. J Gynecol Obstet Biol Reprod 2007;36:186-90.
3. Fritel X. Les formes anatomocliniques de l’endométriose. J Gynecol Obstet Biol Reprod 2007;36:113-8.
4. No authors listed. Revised American Fertility Society classification of endometriosis: 1985. Fertil Steril 1985;43:351-2.
5. Haas D, Shebl O, Shamiyeh A, Oppelt P. The rASRM score and the Enzian classification for endometriosis: their strengths and weaknesses. Acta Obstet Gynecol Scand 2013;92:3-7.
6. Régenet N, Metairie S, Cousin GM, Lehur PA. Colorectal endometriosis. Diagnosis and management. Ann Chir 2001;126:734-42.
7. Palazzo L, Roseau G. Comment faire le diagnostic d’une endométriose rectosigmoïdienne ? Post’U 2013;281-92. Disponible sur : https://www.fmcgastro.org/wp-content/uploads/file/pdf-2013/diagnostic-endometriose.pdf
8. Chapron C, Barakat H, Fritel X, Dubuisson JB, Breart G, Fauconnier A. Presurgical diagnosis of posterior deep infiltrating endometriosis based on a standardized questionnaire. Hum Reprod 2005;20:507-13.
9. Chiaffarino F, Cipriani S, Ricci E, Mauri PA, Esposito G, Barretta M, et al. Endometriosis and irritable bowel syndrome: a systematic review and meta-analysis. Arch Gynecol Obstet 2021;303:17-25.
10. Roman H, Ness J, Suciu N, Bridoux V, Gourcerol G, Leroi AM, et al. Are digestive symptoms in women presenting with pelvic endometriosis specific to lesion localizations? A preliminary prospective study. Hum Reprod 2012;27:3440-9.
11. Guerriero S, Saba L, Pascual MA, Ajossa S, Rodriguez I, Mais V, et al. Transvaginal ultrasound vs magnetic resonance imaging for diagnosing deep infiltrating endometriosis: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2018;51:586-95.
12. Gerges B, Li W, Leonardi M, Mol BW, Condous G. Optimal imaging modality for detection of rectosigmoid deep endometriosis: systematic review and meta-analysis. Ultrasound Obstet Gynecol 2021;58:190-200.
13. Roseau G. Endométriose colo-rectale, comment diagnostiquer et traiter ? Post’U 2020;277-86. Disponible sur : https://www.fmcgastro.org/wp-content/uploads/2020/05/277_020_Roseau.pdf
14. Kanté F, Belghiti J, Roseau G, Thomassin-Naggara I, Bazot M, Daraï E, et al. Comparison of the accuracy of rectal endoscopic sonography and magnetic resonance imaging in the diagnosis of colorectal endometriosis. Gynecol Obstet Fertil Senol 2017;45:131-6.
15. Thomassin-Naggara I, Maitrot-Mantelet L, Bordonné C, Millischer-Bellaiche AE. L’imagerie dans le diagnostic de l’endométriose. AP-HP 2021. Disponible sur : https://www.aphp.fr/patient-public/endometriose/recommandations-endometriose/limagerie-dans-le-diagnostic-de
16. Millochau JC, Abo C, Darwish B, Huet E, Dietrich G, Roman H. Continuous amenorrhea may be insufficient to stop the progression of colorectal endometriosis. J Minim Invasive Gynecol 2016;23:839-42.
17. CNGOF. Recommandations pour la pratique clinique. Contraception. 2018. Disponible sur : http://www.cngof.fr/pratiques-cliniques/recommandations-pour-la-pratique-clinique?folder=RPC%2BCOLLEGE%252F2018
18. ANSM. Situations pour lesquelles l’utilisation de Lutényl/Lutéran peut être envisagée ou non au regard du rapport bénéfice-risque, et conduite à tenir. 2021. Disponible sur : https://ansm.sante.fr/dossiers-thematiques/lutenyl-luteran/recommandations-dutilisation-et-de-suivi-des-femmes
19. Singh SS, Gude K, Perdeaux E, Gattrell WT, Becker CM. Surgical outcomes in patients with endometriosis: a systematic review. J Obstet Gynaecol Can 2020;42:881-888.e11.
20. Vanhie A, Meuleman C, Tomassetti C, Timmerman D, D’Hoore A, Wolthuis A, et al. Consensus on recording deep endometriosis surgery: the CORDES statement. Hum Reprod 2016;31:1219-23. Erratum in: Hum Reprod 2016;31:2660.
21. Sima RM, Pleş L, Socea B, Sklavounos P, Negoi I, Stănescu AD, et al. Evaluation of the SF-36 questionnaire for assessment of the quality of life of endometriosis patients undergoing treatment: A systematic review and meta-analysis. Exp Ther Med 2021;22:1283.