Le diagnostic des cancers du poumon repose sur l’examen anatomopathologique. Le pathologiste a un rôle primordial dans leur prise en charge du fait de la complexification de l’arsenal thérapeutique des stades avancés (chimiothérapies cytotoxiques, thérapies ciblées, immunothérapie) qui nécessite l’identification précise des différents sous-types histologiques, en utilisant une terminologie conforme aux recommandations de la classification de l’Organisation mondiale de la santé.1 De plus, le pathologiste est dans une problématique d’épargne tissulaire, le diagnostic se faisant le plus souvent sur des « petits prélèvements », devant permettre à la fois le diagnostic et, si nécessaire, la caractérisation moléculaire.
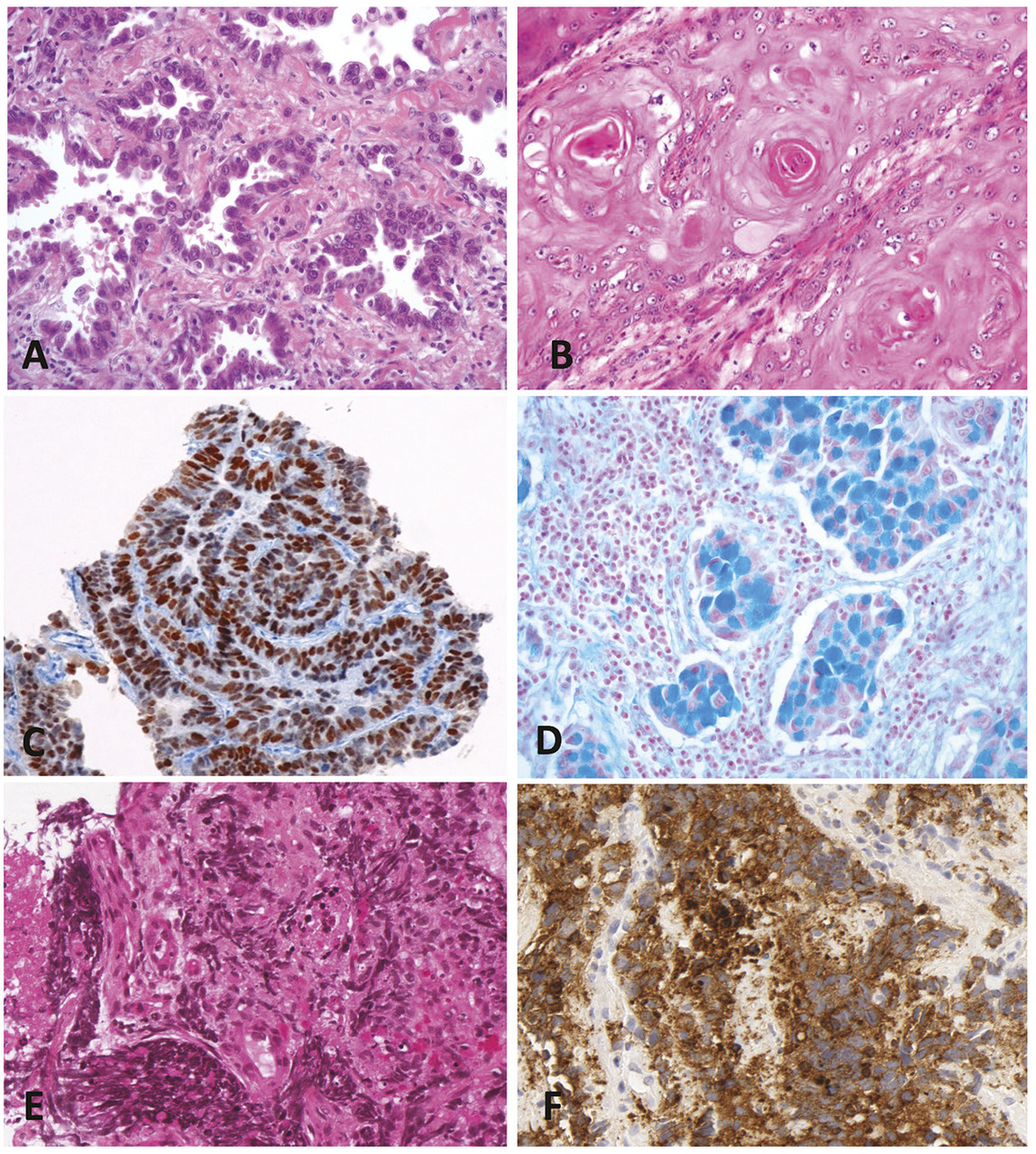
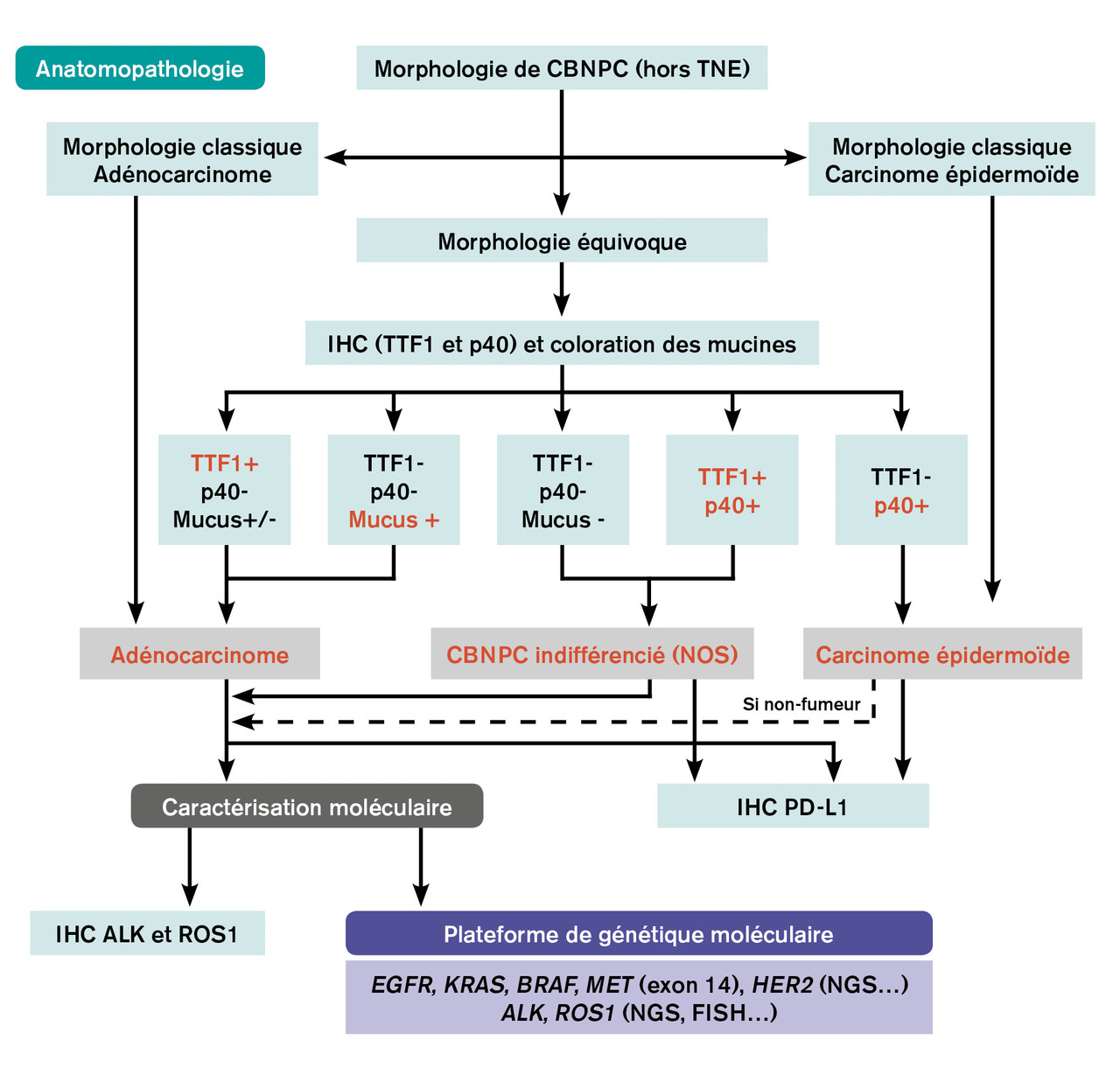
Les cancers bronchopulmonaires non à petites cellules (CBNPC) représentent environ 85 % des cancers du poumon. Les formes les plus fréquentes sont l’adénocarcinome et le carcinome épidermoïde (fig. 1 ).2 Si aucune différenciation morphologique n’est évidente sur les prélèvements biopsiques et/ou cytologiques, une coloration des mucines et une étude immunohistochimique sont réalisées (en règle générale : un marqueur de différenciation malpighienne p40 et un marqueur glandulaire TTF1) [fig. 2 ]. L’expression du biomarqueur PD-L1 est recherchée systématiquement sur les CBNPC par technique d’immunohistochimie standardisée. L’expression de PD-L1 conditionne la prescription de certaines immunothérapies en monothérapie. En cas de CBNPC non épidermoïde métastatique ou localement avancé, une recherche d’altérations moléculaires doit être systématiquement demandée sur les gènes EGFR, KRAS, BRAF, HER2, MET (exon 14), HER2 (mutations) ou les gènes ALK et ROS1 (réarrangement). Cette « cartographie » moléculaire est réalisée dans des plateformes génétiques indépendantes des laboratoires d’anatomopathologie. La recherche d’altérations moléculaires par séquençage de nouvelle génération sur l’ADN et l’ARN augmente considérablement le nombre de biomarqueurs analysés sur un seul échantillon (fig. 2 ). L’absence de tabagisme, ou le sevrage très prolongé, augmente de façon très importante la probabilité de survenue d’une altération moléculaire ciblable telle qu’une mutation d’EGFR ou un réarrangement ALK ou ROS1, dont l’identification a une implication thérapeutique dès la première ligne de traitement avec la prescription d’une thérapie ciblée et non d’une chimiothérapie ou immunothérapie.
L’évolution rapide des stratégies thérapeutiques ciblées adjuvantes après chirurgie imposera bientôt la caractérisation moléculaire des CBNPC à des stades opérables.3 Les carcinomes à petites cellules représentent environ 15 % des cancers du poumon. Ce sont des tumeurs de haut grade de malignité, de différenciation neuroendocrine. Le diagnostic de carcinome à petites cellules repose sur des critères morphologiques (petites cellules bleues en nappe, chromatine finement granuleuse, nécrose) et immunohistochimiques (expression d’un ou plusieurs marqueurs neuroendocrines, indice de prolifération [Ki-67] très élevé) [fig. 1 ]. Les carcinomes à petites cellules sont caractérisés par des inactivations des gènes TP53 et RB1, mais leur recherche n’est pas réalisée en routine, n’ayant pas d’implication thérapeutique à l’heure actuelle.
Les cancers bronchopulmonaires non à petites cellules (CBNPC) représentent environ 85 % des cancers du poumon. Les formes les plus fréquentes sont l’adénocarcinome et le carcinome épidermoïde (
L’évolution rapide des stratégies thérapeutiques ciblées adjuvantes après chirurgie imposera bientôt la caractérisation moléculaire des CBNPC à des stades opérables.3 Les carcinomes à petites cellules représentent environ 15 % des cancers du poumon. Ce sont des tumeurs de haut grade de malignité, de différenciation neuroendocrine. Le diagnostic de carcinome à petites cellules repose sur des critères morphologiques (petites cellules bleues en nappe, chromatine finement granuleuse, nécrose) et immunohistochimiques (expression d’un ou plusieurs marqueurs neuroendocrines, indice de prolifération [Ki-67] très élevé) [
Références
1. Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society international ultidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011;6:244‑85.
2. http://referentiels-aristot.com/
3. Tagrisso Phase III ADAURA trial will be unblinded early after overwhelming efficacy in the adjuvant treatment of patients with EGFR-mutated lung cancer [news release, avril 2020]. https://bit.ly/34xHVAd
2. http://referentiels-aristot.com/
3. Tagrisso Phase III ADAURA trial will be unblinded early after overwhelming efficacy in the adjuvant treatment of patients with EGFR-mutated lung cancer [news release, avril 2020]. https://bit.ly/34xHVAd