Le vieillissement de la population laisse présager une forte augmentation du nombre de démences dans les années à venir.1 Alors que le diagnostic de certitude des démences est encore à ce jour anatomopathologique, le développement des nouveaux biomarqueurs permet de mettre en évidence la maladie du vivant du patient.
Ainsi, la maladie d’Alzheimer peut être détectée à un stade préclinique en mettant en évidence trois biomarqueurs qui sont la présence de plaques amyloïdes, l’accumulation de la protéine tau phosphorylée au niveau du cortex et enfin la neurodégénérescence, c’est-à-dire la dysfonction et la mort neuronale.
Plusieurs techniques existent pour mesurer ces biomarqueurs. L’analyse du liquide cérébrospinal, l’imagerie moléculaire par tomographie avec émission de positons (TEP) ou par scintigraphie (plus rarement en 2020) et l’imagerie morphologique (imagerie par résonance magnétique [lRM]) et la tomodensitométrie (en cas de contre-indications à l’IRM) [v . tableau 1
Nous aborderons dans cet encadré l’imagerie moléculaire qui peut faire le diagnostic de la maladie d’Alzheimer précocement, alors que le patient n’a que peu de troubles et avant le stade de la démence.
Ainsi, la maladie d’Alzheimer peut être détectée à un stade préclinique en mettant en évidence trois biomarqueurs qui sont la présence de plaques amyloïdes, l’accumulation de la protéine tau phosphorylée au niveau du cortex et enfin la neurodégénérescence, c’est-à-dire la dysfonction et la mort neuronale.
Plusieurs techniques existent pour mesurer ces biomarqueurs. L’analyse du liquide cérébrospinal, l’imagerie moléculaire par tomographie avec émission de positons (TEP) ou par scintigraphie (plus rarement en 2020) et l’imagerie morphologique (imagerie par résonance magnétique [lRM]) et la tomodensitométrie (en cas de contre-indications à l’IRM) [
Nous aborderons dans cet encadré l’imagerie moléculaire qui peut faire le diagnostic de la maladie d’Alzheimer précocement, alors que le patient n’a que peu de troubles et avant le stade de la démence.
Mise en évidence de la maladie d’Alzheimer in vivo
Il est possible de mettre en évidence les lésions de la maladie d’Alzheimer en TEP en explorant trois biomarqueurs : la présence de peptides amyloïdes, la présence de la protéine tau, et la mise en évidence de la neurodégénérescence. Pour cela, trois traceurs marqués par un produit radioactif peuvent être injectés aux patients et détectés ensuite par la TEP.
Traceurs TEP amyloïdes et tau
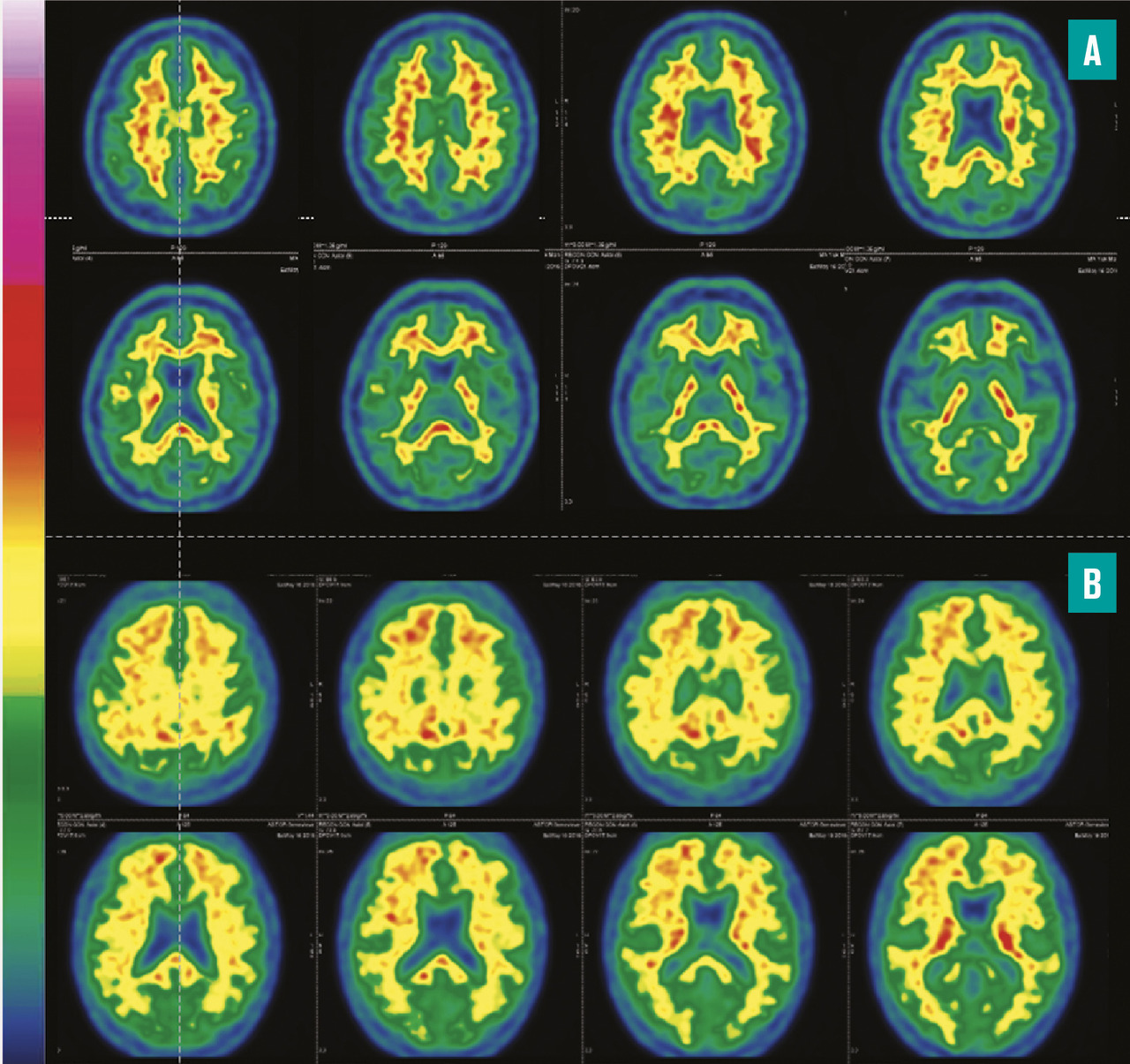
Les traceurs TEP de la plaque amyloïde et tau permettent de détecter de manière reproductible et robuste l’accumulation de ces biomarqueurs au niveau du cortex. De plus, contrairement à l’analyse du liquide cérébrospinal qui permet également de les détecter, la TEP permet une analyse régionale, ce qui peut être intéressant quand il y a peu de zones atteintes. En revanche, comparativement à l’analyse du liquide cérébrospinal, le prix de ces deux traceurs est élevé et reste non remboursé par la Sécurité sociale. La TEP utilisant les marqueurs de la plaque amyloïde permet d’éliminer, si elle est normale, la maladie d’Alzheimer dans la plupart des cas. En revanche, certains chevauchements existent avec d’autres maladies neurodégénératives. De plus, certains sujets considérés « sains » cliniquement peuvent avoir une accumulation de plaques amyloïdes sans exprimer cliniquement les symptômes ou avoir un déficit cognitif léger sans retentissement sur la vie quotidienne. En routine, malgré leurs performances, ces traceurs TEP sont en général remplacés par le dosage dans le liquide cérébrospinal.2
La TEP cérébrale au 18FDG
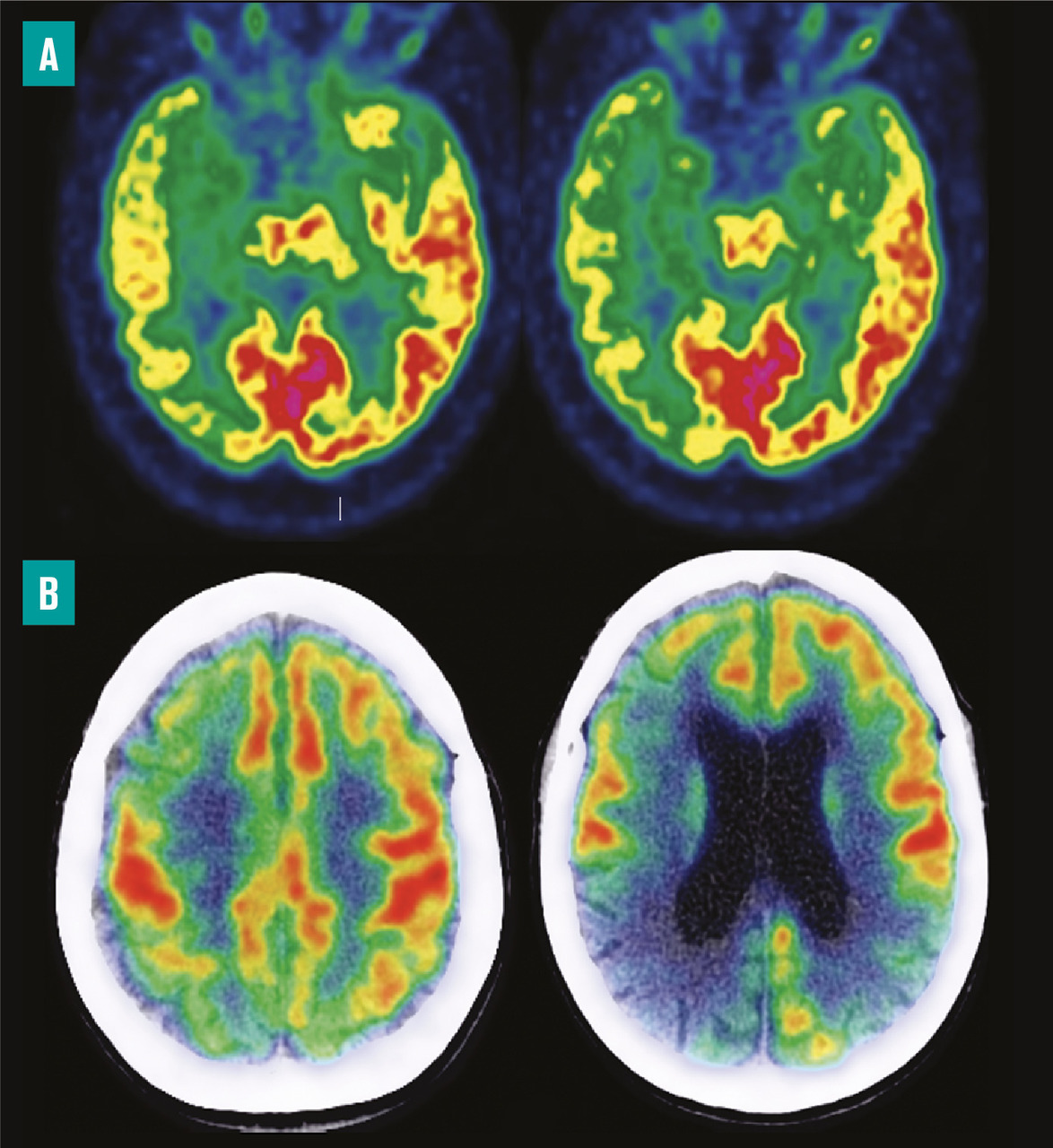
Le traceur TEP de la neurodégénérescence est le 18fluorodésoxyglucose (18FDG), un glucose marqué par un fluor radioactif. La TEP au 18FDG permet de mesurer de manière précoce, reproductible et robuste le dysfonctionnement régional neuronal qui se traduit par un hypométabolisme glucidique. Cet hypométabolisme apparaîtra sur l’image sous forme d’une hypofixation. C’est actuellement, en routine, la technique de choix en imagerie pour détecter la neurodégénérescence. La TEP a largement remplacé la scintigraphie dont le principe est similaire mais les performances et la reproductibilité sont plus faibles. L’IRM reste indispensable pour éliminer d’autres causes de troubles cognitifs, mais elle est souvent normale pour l’âge ou montre tardivement une atrophie non spécifique.
La TEP cérébrale au 18FDG permet l’étude, au repos, de la consommation régionale de glucose et reflète l’activité neuronale. Les modifications fonctionnelles secondaires à la souffrance neuronale présente au cours des maladies neurodégénératives précèdent souvent la survenue d’une atrophie témoin de la perte neuronale. Ces modifications précèdent la phase symptomatique et ainsi constituent une aide au diagnostic des patients atteints d’une maladie d’Alzheimer à un stade prédémentiel. En outre, la TEP cérébrale au 18FDG permet de s’affranchir des mécanismes de la réserve cognitive, qui permet à certains patients de compenser une perte neuronale et d’obtenir de bons résultats lors de l’évaluation neuropsychologique. Le profil en TEP au 18FDG d’une maladie d’Alzheimer se définit par un hypométabolisme qui débute souvent par le cortex temporal interne (hippocampe), le précuneus et le cingulum postérieur, puis affecte le cortex associatif postérieur avant de devenir diffus, pouvant atteindre le cortex frontal. L’hypofixation peut être asymétrique, parfois unilatérale au début de la maladie. En revanche, une relative préservation du cortex primaire, des noyaux de la base et du cervelet est généralement rapportée.3 La présentation et la sévérité des anomalies sont bien corrélées aux altérations cognitives. La présence d’anomalies sur la TEP au 18FDG fait progresser la probabilité du diagnostic chez les patients ayant une preuve d’une accumulation des plaques amyloïdes. De plus, on peut prédire une expression plus rapide des troubles cognitifs liés à la maladie environ deux ans avant l’apparition des signes cliniques.4, 5 La large utilisation du 18FDG est facilitée par la simplicité de son utilisation et son innocuité. L’injection peut être réalisée chez un patient à jeun, avec une fonction rénale altérée ou un terrain allergique. En revanche, elle est contre-indiquée chez la femme enceinte ou allaitante. L’examen dure environ 10 minutes.
La TEP cérébrale au 18FDG permet l’étude, au repos, de la consommation régionale de glucose et reflète l’activité neuronale. Les modifications fonctionnelles secondaires à la souffrance neuronale présente au cours des maladies neurodégénératives précèdent souvent la survenue d’une atrophie témoin de la perte neuronale. Ces modifications précèdent la phase symptomatique et ainsi constituent une aide au diagnostic des patients atteints d’une maladie d’Alzheimer à un stade prédémentiel. En outre, la TEP cérébrale au 18FDG permet de s’affranchir des mécanismes de la réserve cognitive, qui permet à certains patients de compenser une perte neuronale et d’obtenir de bons résultats lors de l’évaluation neuropsychologique. Le profil en TEP au 18FDG d’une maladie d’Alzheimer se définit par un hypométabolisme qui débute souvent par le cortex temporal interne (hippocampe), le précuneus et le cingulum postérieur, puis affecte le cortex associatif postérieur avant de devenir diffus, pouvant atteindre le cortex frontal. L’hypofixation peut être asymétrique, parfois unilatérale au début de la maladie. En revanche, une relative préservation du cortex primaire, des noyaux de la base et du cervelet est généralement rapportée.3 La présentation et la sévérité des anomalies sont bien corrélées aux altérations cognitives. La présence d’anomalies sur la TEP au 18FDG fait progresser la probabilité du diagnostic chez les patients ayant une preuve d’une accumulation des plaques amyloïdes. De plus, on peut prédire une expression plus rapide des troubles cognitifs liés à la maladie environ deux ans avant l’apparition des signes cliniques.4, 5 La large utilisation du 18FDG est facilitée par la simplicité de son utilisation et son innocuité. L’injection peut être réalisée chez un patient à jeun, avec une fonction rénale altérée ou un terrain allergique. En revanche, elle est contre-indiquée chez la femme enceinte ou allaitante. L’examen dure environ 10 minutes.
Références
1. Helmer C, Pérès K, Letenneur L, et al. Dementia in subjects aged 75 years or over within the PAQUID cohort: prevalence and burden by severity. Dement Geriatr Cogn Disord 2006;22:87-94.
2. Ramusino MC, Garibotto V, Bacchin R, et al. Incremental value of amyloid-PET versus CSF in the diagnosis of Alzheimer’s disease. Eur J Nucl Med Mol Imaging 2020;47:270-80.
3. Marcus C, Mena E, Subramaniam RM. Brain PET in the diagnosis of Alzheimer's disease. Clin Nucl Med 2014;39:e413-22.
4. Herholz K, Westwood S, Haense C, Dunn G. Evaluation of a calibrated (18)F-FDG PET score as a biomarker for progression in Alzheimer disease and mild cognitive impairment. J Nucl Med 2011;52:1218-26.
5. Prestia A, Caroli A, van der Flier WM, et al. Prediction of dementia in MCI patients based on core diagnostic markers for Alzheimer disease. Neurology 2013;80:1048-56.
2. Ramusino MC, Garibotto V, Bacchin R, et al. Incremental value of amyloid-PET versus CSF in the diagnosis of Alzheimer’s disease. Eur J Nucl Med Mol Imaging 2020;47:270-80.
3. Marcus C, Mena E, Subramaniam RM. Brain PET in the diagnosis of Alzheimer's disease. Clin Nucl Med 2014;39:e413-22.
4. Herholz K, Westwood S, Haense C, Dunn G. Evaluation of a calibrated (18)F-FDG PET score as a biomarker for progression in Alzheimer disease and mild cognitive impairment. J Nucl Med 2011;52:1218-26.
5. Prestia A, Caroli A, van der Flier WM, et al. Prediction of dementia in MCI patients based on core diagnostic markers for Alzheimer disease. Neurology 2013;80:1048-56.