Si elle a bel et bien transformé la prise en charge des cancers, l’immunothérapie peut induire des réponses tumorales parfois paradoxales et des effets indésirables spécifiques, qui justifient un suivi médical particulier.
Avec plus de 150 000 décès en 2018 en France, le cancer est la première cause de mortalité chez l’homme et la deuxième chez la femme.1 Bien que son incidence se soit stabilisée chez l’homme ces dernières années, elle poursuit son augmentation chez la femme, et le nombre annuel de nouveaux diagnostics de cancers ne cesse de croître (382 000 en 2018). Du fait de sa fréquence, le cancer concerne l’ensemble des intervenants du système de santé. L’oncologie fait l’objet d’importantes recherches thérapeutiques, c’est une spécialité en perpétuelle évolution.
En une décennie, l’immunothérapie est devenue l’un des principaux traitements anticancéreux. Ses indications sont de plus en plus larges, et concernent une grande partie des cancers, principalement en phase métastatique, mais aussi les formes localisées. Cependant, ces traitements diffèrent radicalement de la chimiothérapie, non seulement par leur mécanisme d’action mais également par leurs effets indésirables. Ils nécessitent donc une adaptation des pratiques en oncologie, et une formation de l’ensemble des soignants qui interviennent auprès des patients.
En une décennie, l’immunothérapie est devenue l’un des principaux traitements anticancéreux. Ses indications sont de plus en plus larges, et concernent une grande partie des cancers, principalement en phase métastatique, mais aussi les formes localisées. Cependant, ces traitements diffèrent radicalement de la chimiothérapie, non seulement par leur mécanisme d’action mais également par leurs effets indésirables. Ils nécessitent donc une adaptation des pratiques en oncologie, et une formation de l’ensemble des soignants qui interviennent auprès des patients.
Un rationnel biologique et des mécanismes d’action bien compris
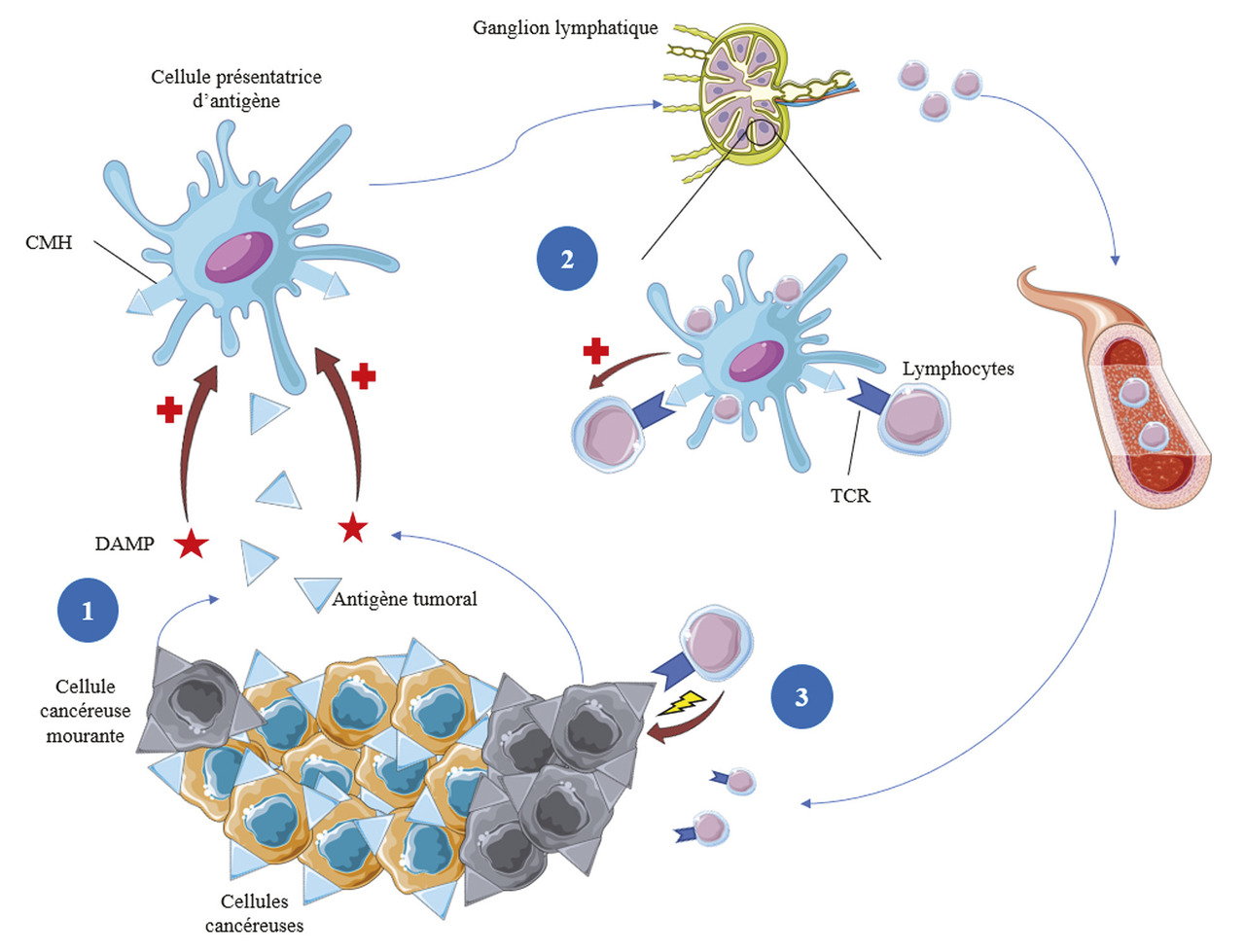
Les cellules tumorales sont des cellules anormales qui sont en principe identifiées puis éliminées par notre système immunitaire, principalement par les lymphocytes T. Ce cycle d’immunité antitumorale (fig. 1 ) débute par la reconnaissance d’antigènes tumoraux par une cellule présentatrice d’antigène (CPA), le plus souvent une cellule dendritique, au contact de la tumeur.2 Si la CPA reçoit simultanément un signal de danger (ou DAMP, pour damage-associated molecular pattern), traduisant la mort cellulaire, elle devient immunogène, en exprimant à sa surface l’antigène tumoral, chargé sur un complexe majeur d’histocompatibilité (CMH), ainsi que d’autres protéines pro-inflammatoires.
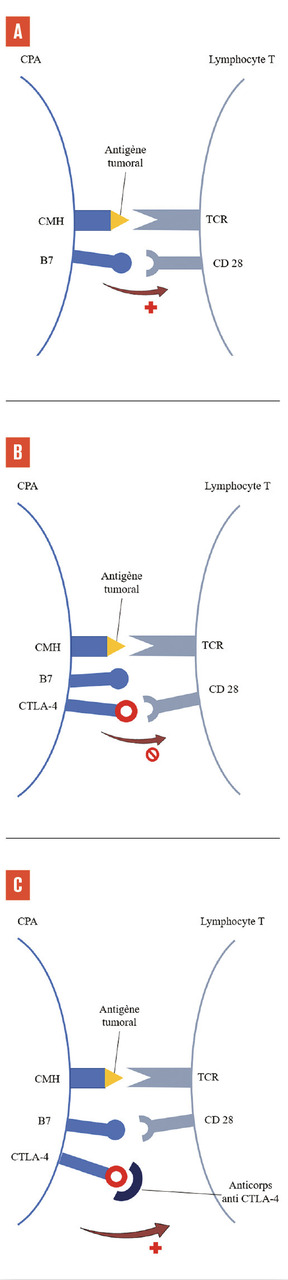
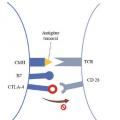
Une fois activée, la cellule présentatrice d’antigène migre vers un organe lymphoïde, où elle peut interagir avec les lymphocytes, via la liaison entre le CMH chargé avec l’antigène tumoral et le T-cell receptor (TCR) du lymphocyte T, constituant le « premier signal » (fig. 2A ).3 Afin d’être activé, le lymphocyte doit recevoir un « deuxième signal » : l’interaction du récepteur CD28, à la surface du lymphocyte T, et du ligand B7, à la surface de la cellule présentatrice d’antigène. Enfin, un « troisième signal », optionnel et médié par l’interaction de récepteurs costimulateurs (comme OX-40), peut amplifier l’activation du lymphocyte.4 À l’inverse, il existe des signaux inhibiteurs, qui modèrent, voire empêchent, l’activation du lymphocyte et évitent une réponse inflammatoire excessive, comme les points de contrôle immunitaire CTLA-4 (cytolytic T lymphocyte-associated protein 4) [fig. 2B ].
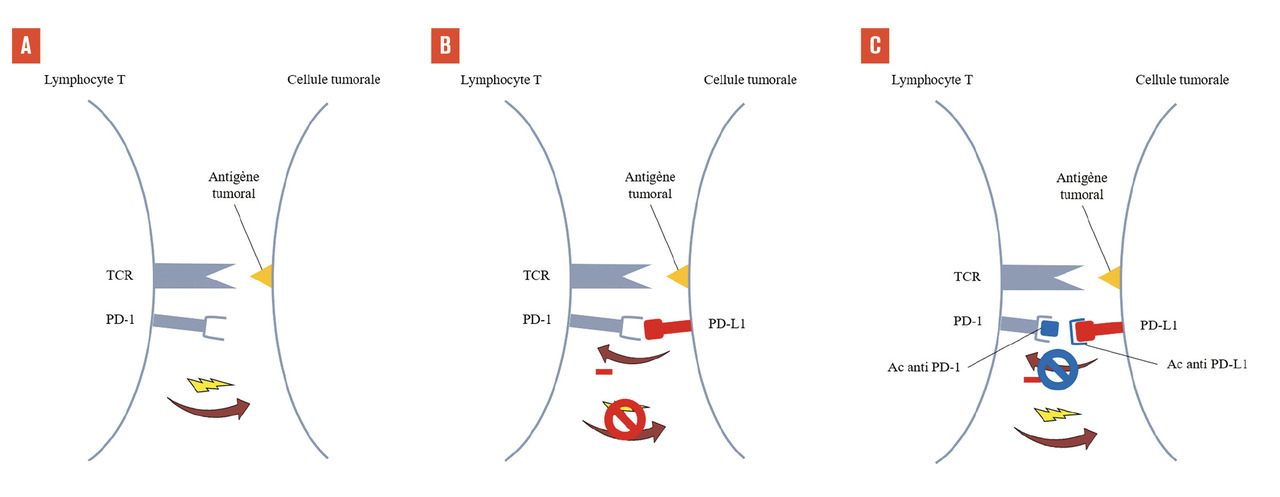
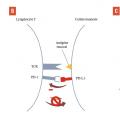
Les lymphocytes T activés prolifèrent alors, puis migrent vers le site tumoral, où ils reconnaissent les cellules tumorales via l’interaction de leur TCR avec l’antigène de la tumeur, et peuvent ainsi activer leurs mécanismes de lyse cellulaire pour les détruire (fig. 3A ). Cette lyse induit la libération d’antigènes tumoraux et de signaux de danger qui amplifient la réponse immunitaire. De la même manière que lors de l’interaction CPA-lymphocyte dans le ganglion lymphatique, il existe en périphérie des signaux de costimulation qui amplifient la réponse immunitaire, et des points de contrôle immunitaire (comme les protéines PD-1, programmed cell death 1, et PD-L1, programmed death-ligand 1) qui l’inhibent (fig. 3B ).
Une fois activée, la cellule présentatrice d’antigène migre vers un organe lymphoïde, où elle peut interagir avec les lymphocytes, via la liaison entre le CMH chargé avec l’antigène tumoral et le T-cell receptor (TCR) du lymphocyte T, constituant le « premier signal » (
Les lymphocytes T activés prolifèrent alors, puis migrent vers le site tumoral, où ils reconnaissent les cellules tumorales via l’interaction de leur TCR avec l’antigène de la tumeur, et peuvent ainsi activer leurs mécanismes de lyse cellulaire pour les détruire (
Restaurer une réponse immunitaire antitumorale
En réponse à cette immunité antitumorale, les cellules cancéreuses développent de multiples mécanismes d’échappement et/ou d’inhibition du système immunitaire, et ainsi continuent à proliférer. Cet immuno-editing peut reposer sur l’expression, par les cellules tumorales, de signaux inhibiteurs du système immunitaire, comme les checkpoints immunitaires, ou sur l’altération de leur micro-environnement en modifiant les cellules du stroma pour les rendre immunorégulatrices.2
Le but de l’immunothérapie est de contrer ces différents mécanismes pour lever l’inhibition du système immunitaire par la tumeur et restaurer une réponse immunitaire antitumorale.
Le but de l’immunothérapie est de contrer ces différents mécanismes pour lever l’inhibition du système immunitaire par la tumeur et restaurer une réponse immunitaire antitumorale.
Quels sont les principaux types d’immunothérapie et leurs indications ?
Les immunothérapies les plus utilisées en oncologie actuellement sont les inhibiteurs des points de contrôle immunitaire (immune checkpoint inhibitors, ICI). Il s’agit d’anticorps monoclonaux administrés par voie intraveineuse qui ciblent le ligand ou le récepteur du point de contrôle immunitaire pour bloquer son action inhibitrice et restaurer une immunité antitumorale.4
Le premier anticorps développé, l’ipilimumab, cible CTLA-4.5 CTLA-4 est normalement exprimé à la surface des lymphocytes T, et agit comme ligand alternatif de CD28 à B7. En empêchant la liaison CD28-B7, le « deuxième signal » est bloqué, ce qui empêche l’activation du lymphocyte T par la cellule présentatrice d’antigène dans les ganglions. L’anticorps anti-CTLA-4 empêche la liaison de CTLA-4 à B7 et permet donc de restaurer le « deuxième signal » CD28-B7 (fig. 2C ).
Le premier anticorps développé, l’ipilimumab, cible CTLA-4.5 CTLA-4 est normalement exprimé à la surface des lymphocytes T, et agit comme ligand alternatif de CD28 à B7. En empêchant la liaison CD28-B7, le « deuxième signal » est bloqué, ce qui empêche l’activation du lymphocyte T par la cellule présentatrice d’antigène dans les ganglions. L’anticorps anti-CTLA-4 empêche la liaison de CTLA-4 à B7 et permet donc de restaurer le « deuxième signal » CD28-B7 (
Le couple PD-1/PD-L1 principale cible de l’immunothérapie
Le deuxième point de contrôle immunitaire, qui constitue actuellement la principale cible en immunothérapie, est le couple PD-1/PD-L1.6 PD-1 est un récepteur exprimé par les lymphocytes T activés. La liaison avec son principal ligand, PD-L1, exerce un effet inhibiteur sur la prolifération et la cytotoxicité du lymphocyte. PD-L1 est exprimé par de nombreuses cellules tumorales, ce qui entraîne l’inactivation des lymphocytes T effecteurs lorsqu’ils pénètrent dans l’environnement tumoral et bloque leur activité de lyse tumorale. Ce point de contrôle immunitaire peut être ciblé soit par des anticorps anti-PD-1 (nivolumab, pembrolizumab, cémiplimab), soit par des anticorps anti-PD-L1 (durvalumab, atézolizumab, avélumab), pour empêcher la liaison PD-1/PD-L1 et donc inhiber le signal inhibiteur exercé par les cellules tumorales sur les lymphocytes T (fig. 3C ). Les principales indications des inhibiteurs des points de contrôle immunitaire ciblant PD-1/PD-L1 sont résumées dans le tableau .
Des anticorps ciblant d’autres points de contrôle immunitaire, comme TIM-3 ou LAG-3, sont en cours de développement.4
Des anticorps ciblant d’autres points de contrôle immunitaire, comme TIM-3 ou LAG-3, sont en cours de développement.4
Les cellules T à récepteur antigénique chimérique en hématologie
Les cellules T à récepteur antigénique chimérique (chimeric antigen receptor T cells, CAR T-cells) constituent une autre approche, actuellement utilisée en hématologie, notamment contre les leucémies aiguës lymphoblastiques B.7 Il s’agit d’une thérapie génique et cellulaire qui utilise des lymphocytes T dont le T-cell receptor a été modifié pour fixer directement un antigène tumoral et activer le lymphocyte sans nécessiter de co-signaux.8
Pour cela, les patients doivent subir une cytaphérèse afin d’extraire une partie de leurs lymphocytes T circulants, qui sont mis en contact avec des CPA artificielles et des cytokines pour les stimuler et déclencher leur multiplication. Leur TCR est ensuite génétiquement modifié en utilisant un lentivirus ou un rétrovirus. Puis ces CAR-T cells sont réinjectées aux patients sous une surveillance renforcée, du fait d’un risque de syndrome de relargage cytokinique. Cependant, cette thérapie s’est, à ce jour, révélée peu efficace en oncologie solide, possiblement en lien avec la difficulté pour ces CAR-T cells d’accéder aux différents sites tumoraux et de surmonter le micro-environnement immunorégulateur du cancer.9
De nouvelles formes d’immunothérapies sont encore en développement en oncologie : des anticorps agonistes des récepteurs de costimulation (« troisième signal »), des anticorps bispécifiques, ciblant simultanément les cellules immunitaires et les cellules tumorales, ou des vaccins antitumoraux, par exemple.4
Pour cela, les patients doivent subir une cytaphérèse afin d’extraire une partie de leurs lymphocytes T circulants, qui sont mis en contact avec des CPA artificielles et des cytokines pour les stimuler et déclencher leur multiplication. Leur TCR est ensuite génétiquement modifié en utilisant un lentivirus ou un rétrovirus. Puis ces CAR-T cells sont réinjectées aux patients sous une surveillance renforcée, du fait d’un risque de syndrome de relargage cytokinique. Cependant, cette thérapie s’est, à ce jour, révélée peu efficace en oncologie solide, possiblement en lien avec la difficulté pour ces CAR-T cells d’accéder aux différents sites tumoraux et de surmonter le micro-environnement immunorégulateur du cancer.9
De nouvelles formes d’immunothérapies sont encore en développement en oncologie : des anticorps agonistes des récepteurs de costimulation (« troisième signal »), des anticorps bispécifiques, ciblant simultanément les cellules immunitaires et les cellules tumorales, ou des vaccins antitumoraux, par exemple.4
Une surveillance clinique, biologique et radiologique spécifique
L’arrivée de ces nouveaux traitements dans la pratique clinique, notamment des inhibiteurs des points de contrôle immunitaire, a profondément modifié la prise en charge des patients en oncologie. En effet, outre de nouvelles indications, l’immunothérapie peut être responsable de réponses tumorales et de toxicités inédites qui nécessitent une surveillance particulière.
Des réponses tumorales atypiques
Dès le début de l’immunothérapie, des réponses tumorales atypiques ont été observées, comme des réponses complètes prolongées malgré l’arrêt du traitement, des pseudo-progressions, des hyperprogressions.10
Une pseudoprogression est définie comme une augmentation initiale du volume tumoral après initiation de l’immunothérapie, suivie d’une réponse tumorale (partielle ou complète) sans que le traitement ait été modifié. La phase de progression initiale peut s’accompagner d’une impression de bénéfice clinique, comme une diminution des douleurs ou une amélioration de l’état général. Face à une progression initiale de la tumeur, l’hypothèse d’une pseudo-progression peut donc faire discuter la poursuite d’une immunothérapie, sous couvert d’une surveillance clinique et radiologique renforcée.
À l’inverse, de brutales accélérations de la croissance tumorale après le début d’une immunothérapie ont été décrites sous le terme d’hyperprogression. Elle s’associe à une altération de l’état général, à des symptômes liés au cancer, et impose l’arrêt immédiat de l’immunothérapie. Toute immunothérapie nécessite donc une surveillance clinique, biologique et radiologique particulière.
Une pseudoprogression est définie comme une augmentation initiale du volume tumoral après initiation de l’immunothérapie, suivie d’une réponse tumorale (partielle ou complète) sans que le traitement ait été modifié. La phase de progression initiale peut s’accompagner d’une impression de bénéfice clinique, comme une diminution des douleurs ou une amélioration de l’état général. Face à une progression initiale de la tumeur, l’hypothèse d’une pseudo-progression peut donc faire discuter la poursuite d’une immunothérapie, sous couvert d’une surveillance clinique et radiologique renforcée.
À l’inverse, de brutales accélérations de la croissance tumorale après le début d’une immunothérapie ont été décrites sous le terme d’hyperprogression. Elle s’associe à une altération de l’état général, à des symptômes liés au cancer, et impose l’arrêt immédiat de l’immunothérapie. Toute immunothérapie nécessite donc une surveillance clinique, biologique et radiologique particulière.
Des toxicités inédites
L’immunothérapie et en particulier les ICI sont également responsables de nouvelles formes de toxicités. En effet, bien qu’en général mieux supportée qu’une chimiothérapie, l’immunothérapie peut être responsable d’une levée de l’autotolérance immunitaire, et entraîner divers effets secondaires inflammatoires.11 Ces effets indésirables pourraient provenir de l’activation de lymphocytes T autoréactifs, de la sécrétion d’auto-anticorps et/ou de la libération de cytokines pro-inflammatoires.
Certaines de ces toxicités sont fréquentes, mais en général peu sévères, comme les toxicités cutanées (habituellement de simples rashs, résolutifs sous traitement topique) ou une thyroïdite, responsable d’une hyperthyroïdie transitoire puis d’une hypothyroïdie. Cependant, ces toxicités immuno-induites peuvent atteindre l’ensemble de l’organisme : hypophysite, colite, hépatite, arthrite, myosite, néphrite, etc. De plus, certaines comportent un risque létal, comme les pneumopathies, les colites ou les myocardites. Enfin, bien que ces toxicités surviennent en général au cours des premières semaines et mois suivant le début de l’immunothérapie, des effets indésirables tardifs ont été décrits, certains plus d’un an après l’arrêt de l’immunothérapie.12
Certaines de ces toxicités sont fréquentes, mais en général peu sévères, comme les toxicités cutanées (habituellement de simples rashs, résolutifs sous traitement topique) ou une thyroïdite, responsable d’une hyperthyroïdie transitoire puis d’une hypothyroïdie. Cependant, ces toxicités immuno-induites peuvent atteindre l’ensemble de l’organisme : hypophysite, colite, hépatite, arthrite, myosite, néphrite, etc. De plus, certaines comportent un risque létal, comme les pneumopathies, les colites ou les myocardites. Enfin, bien que ces toxicités surviennent en général au cours des premières semaines et mois suivant le début de l’immunothérapie, des effets indésirables tardifs ont été décrits, certains plus d’un an après l’arrêt de l’immunothérapie.12
Tout nouveau symptôme doit alerter
Une immunothérapie impose donc une surveillance clinique et biologique qui diffère radicalement de celle de la chimiothérapie. Tout nouveau symptôme doit faire rechercher une toxicité immunomédiée et discuter l’introduction précoce de corticoïdes, avec une attention particulière aux signes respiratoires et digestifs, les pneumopathies et les colites étant les plus à risque de décès iatrogènes.11 La prise en charge de ces toxicités nécessite également une collaboration rapprochée avec les différents spécialistes d’organes, pour pouvoir les explorer et les traiter.
La recherche de biomarqueurs de réponse reste centrale
L’immunothérapie constitue une avancée majeure pour la prise en charge de nombreux cancers. Les indications de traitement, notamment par inhibiteurs des points de contrôle immunitaire ciblant PD-1/PD-L1, sont de plus en plus nombreuses et font l’objet de multiples publications scientifiques. De plus, des combinaisons de traitements, incluant une ou plusieurs immunothérapies, sont de plus en plus utilisées, comme des associations d’anti-PD-(L)1 à des anti-CTLA-4, avec des chimiothérapies ou des thérapies ciblées. Il s’agit donc d’un domaine en plein développement.
Cependant, de nombreuses questions restent en suspens, notamment au sujet des biomarqueurs prédictifs de réponse à l’immunothérapie. En effet, seuls 10 à 50 % des patients développent une réponse complète ou partielle à une monothérapie anti-PD-(L)1, selon le type de cancer primitif.13 L’expression de PD-L1 à la surface des cellules tumorales est utilisée comme un facteur prédictif de réponse, et est notamment un critère de prescription d’immunothérapie dans certaines indications. Néanmoins, sa capacité de prédiction est très imparfaite, et la recherche de biomarqueurs de réponse reste une question centrale en immuno-oncologie.14
Du fait du risque de toxicités immunomédiées, la prise en charge et le suivi des patients qui reçoivent une immunothérapie nécessitent une attention particulière, une collaboration avec les spécialistes d’organes, et aussi avec la médecine de ville, pour identifier et traiter précocement ces effets indésirables potentiellement sévères.
Cependant, de nombreuses questions restent en suspens, notamment au sujet des biomarqueurs prédictifs de réponse à l’immunothérapie. En effet, seuls 10 à 50 % des patients développent une réponse complète ou partielle à une monothérapie anti-PD-(L)1, selon le type de cancer primitif.13 L’expression de PD-L1 à la surface des cellules tumorales est utilisée comme un facteur prédictif de réponse, et est notamment un critère de prescription d’immunothérapie dans certaines indications. Néanmoins, sa capacité de prédiction est très imparfaite, et la recherche de biomarqueurs de réponse reste une question centrale en immuno-oncologie.14
Du fait du risque de toxicités immunomédiées, la prise en charge et le suivi des patients qui reçoivent une immunothérapie nécessitent une attention particulière, une collaboration avec les spécialistes d’organes, et aussi avec la médecine de ville, pour identifier et traiter précocement ces effets indésirables potentiellement sévères.
Références
1. SPF. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018 - Tumeurs solides : étude à partir des registres des cancers du réseau Francim [en ligne]. 2018 [cité le 5 avril 2021]. Disponible sur : https://www.santepubliquefrance.fr
2. Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature 2011;480:480-9.
3. Rotte A, Jin JY, Lemaire V. Mechanistic overview of immune checkpoints to support the rational design of their combinations in cancer immunotherapy. Ann Oncol 2018;29:71-83.
4. Lohmueller J, Finn OJ. Current modalities in cancer immunotherapy: Immunomodulatory antibodies, CARs and vaccines. Pharmacol Ther 2017;178:31-47.
5. Lipson EJ, Drake CG. Ipilimumab: an anti-CTLA-4 antibody for metastatic melanoma. Clin Cancer Res 2011;17:6958-62.
6. Hamanishi J, Mandai M, Matsumura N, Abiko K, Baba T, Konishi I. PD-1/PD-L1 blockade in cancer treatment: perspectives and issues. Int J Clin Oncol 2016;21:462-73.
7. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 2018;378:439-48.
8. Barrett DM, Singh N, Porter DL, Grupp SA, June CH. Chimeric antigen receptor therapy for cancer. Annu Rev Med 2014;65:333-47.
9. Ma S, Li X, Wang X, Cheng L, Li Z, Zhang C, et al. Current Progress in CAR-T Cell Therapy for Solid Tumors. Int J Biol Sci 2019;15:2548-60.
10. Borcoman E, Kanjanapan Y, Champiat S, Kato S, Servois V, Kurzrock R, et al. Novel patterns of response under immunotherapy. Ann Oncol 2019;30:385-96.
11. Kennedy LB, Salama AKS. A review of cancer immunotherapy toxicity. CA Cancer J Clin 2020;70:86-104.
12. Owen CN, Bai X, Quah T, Lo SN, Allayous C, Callaghan S, et al. Delayed immune-related adverse events with anti-PD1-based immunotherapy in melanoma. Ann Oncol 2021;32(7):917-25.
13. Hirsch L, Zitvogel L, Eggermont A, Marabelle A. PD-Loma: a cancer entity with a shared sensitivity to the PD-1/PD-L1 pathway blockade. Br J Cancer 2019;120:3-5.
14. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017;541:321-30.
2. Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature 2011;480:480-9.
3. Rotte A, Jin JY, Lemaire V. Mechanistic overview of immune checkpoints to support the rational design of their combinations in cancer immunotherapy. Ann Oncol 2018;29:71-83.
4. Lohmueller J, Finn OJ. Current modalities in cancer immunotherapy: Immunomodulatory antibodies, CARs and vaccines. Pharmacol Ther 2017;178:31-47.
5. Lipson EJ, Drake CG. Ipilimumab: an anti-CTLA-4 antibody for metastatic melanoma. Clin Cancer Res 2011;17:6958-62.
6. Hamanishi J, Mandai M, Matsumura N, Abiko K, Baba T, Konishi I. PD-1/PD-L1 blockade in cancer treatment: perspectives and issues. Int J Clin Oncol 2016;21:462-73.
7. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 2018;378:439-48.
8. Barrett DM, Singh N, Porter DL, Grupp SA, June CH. Chimeric antigen receptor therapy for cancer. Annu Rev Med 2014;65:333-47.
9. Ma S, Li X, Wang X, Cheng L, Li Z, Zhang C, et al. Current Progress in CAR-T Cell Therapy for Solid Tumors. Int J Biol Sci 2019;15:2548-60.
10. Borcoman E, Kanjanapan Y, Champiat S, Kato S, Servois V, Kurzrock R, et al. Novel patterns of response under immunotherapy. Ann Oncol 2019;30:385-96.
11. Kennedy LB, Salama AKS. A review of cancer immunotherapy toxicity. CA Cancer J Clin 2020;70:86-104.
12. Owen CN, Bai X, Quah T, Lo SN, Allayous C, Callaghan S, et al. Delayed immune-related adverse events with anti-PD1-based immunotherapy in melanoma. Ann Oncol 2021;32(7):917-25.
13. Hirsch L, Zitvogel L, Eggermont A, Marabelle A. PD-Loma: a cancer entity with a shared sensitivity to the PD-1/PD-L1 pathway blockade. Br J Cancer 2019;120:3-5.
14. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017;541:321-30.