Le groupe d’experts de la Nouvelle Société francophone d’athérosclérose (NSFA) démontre que la Lp(a) est un facteur de risque reconnu de maladie cardiovasculaire et propose des recommandations applicables en prévention cardiovasculaire. Une version élargie en langue anglaise peut être consultée.1
La lipoprotéine(a) contient 30 à 45 % de cholestérol
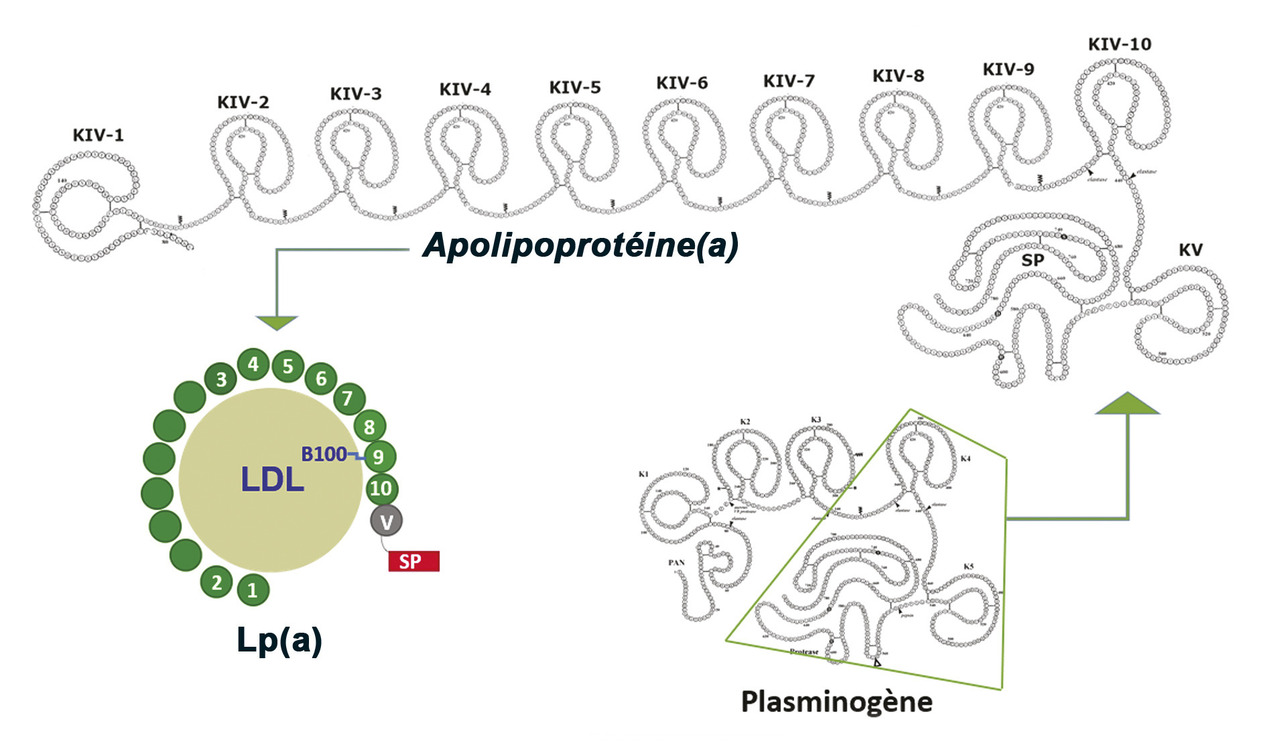
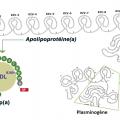
Le plasminogène est une molécule à chaîne unique constituée d’une région N-terminale, de cinq domaines « kringle » (K, structures hélicoïdales en forme de bretzel) et de la région protéinase (SP). Les K1 et K4 contiennent chacun un site qui assure la liaison du plasminogène à la fibrine (appelé site de liaison à la lysine, ou LBS) où il est transformé en plasmine, l’enzyme fibrinolytique. L’apo(a) présente de nombreuses séquences homologues (de 75 à 94 %) du K4 du plasminogène et des copies uniques du K5 et de la région sérine-protéinase n’ayant pas d’activité profibrinolytique (
Il existe dix types de copies du K4 du plasminogène dans l’apo(a). La copie KIV de type 9 permet la formation du complexe avec l’Apo B-100 ; la copie de type 10 contient un LBS de liaison à la fibrine, et la copie de type 2, présente en nombre variable (de 2 à 40), est à l’origine des isoformes dont la taille et la masse moléculaire varient entre 250 et 800 kDa, selon les individus (polymorphisme de taille).
La taille de l’apo(a) inversement liée à la concentration plasmatique de Lp(a)
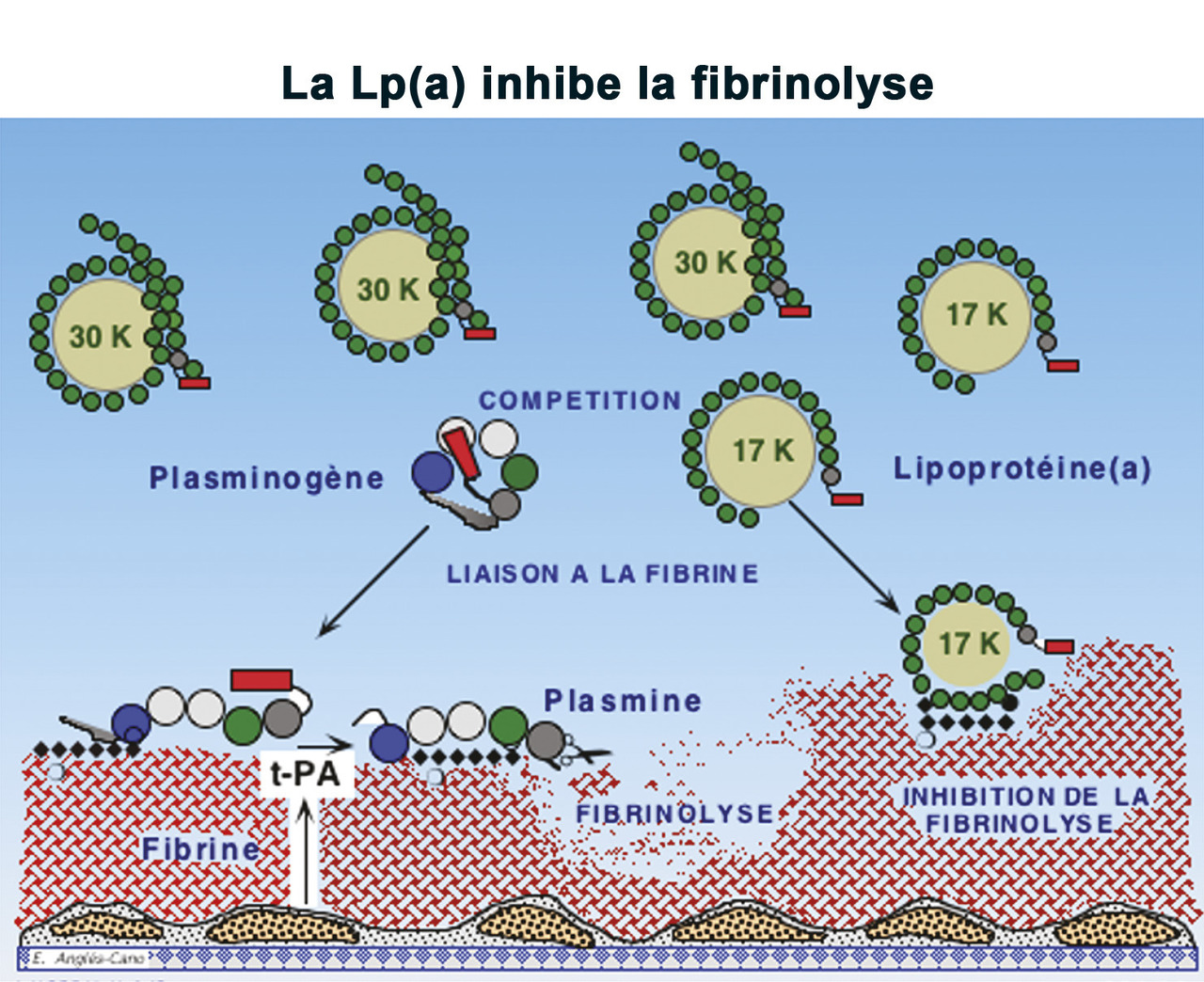
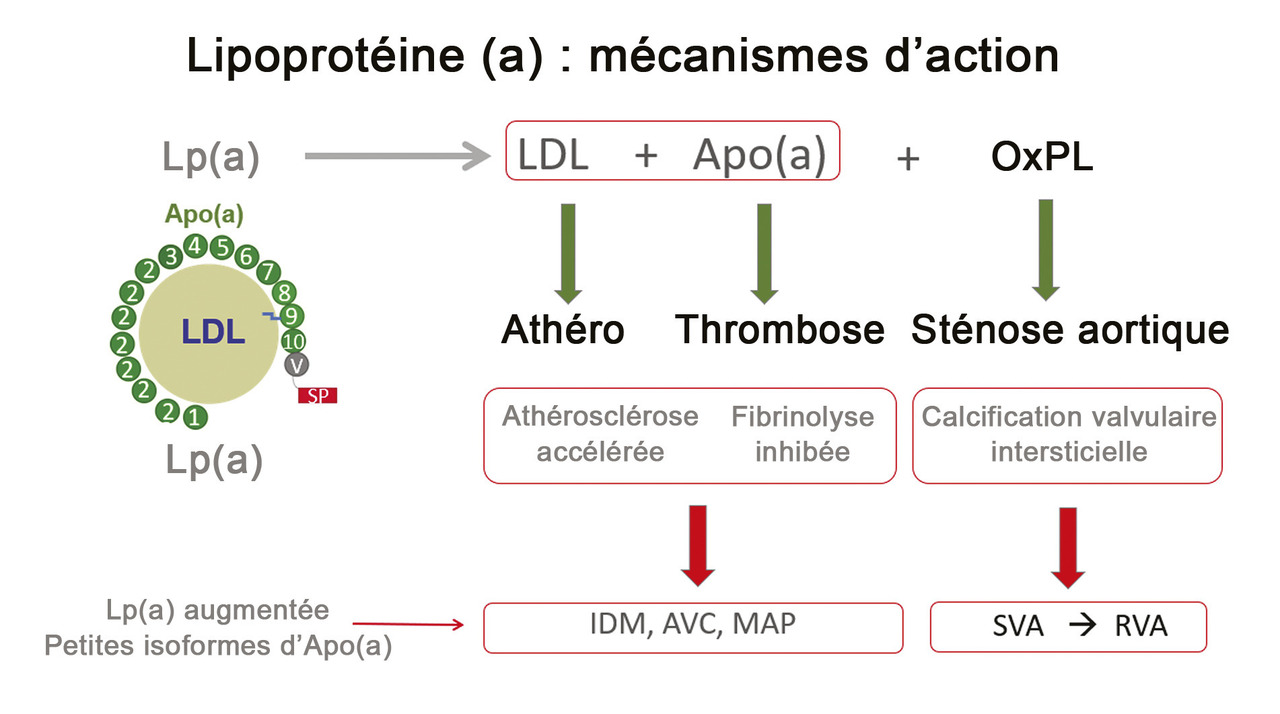
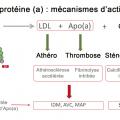
Les mécanismes impliqués dans l’augmentation du risque d’athérothrombose par la Lp(a) sont liés à sa structure unique (
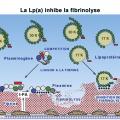
Une action prothrombotique et antifibrinolytique
La Lp(a) impliquée dans différentes maladies
Quels liens avec athérotrombose et sténose aortique ?
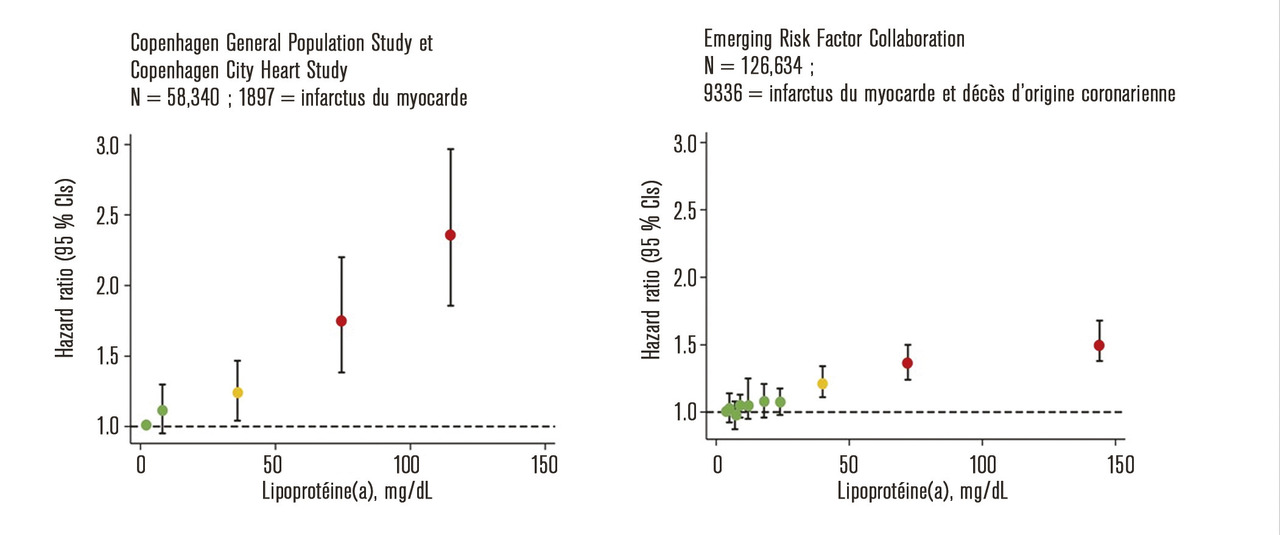
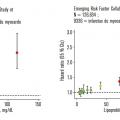
Le lien de causalité entre élévation de la Lp(a) et l’augmentation du risque cardiovasculaire a été confirmé par l’évaluation des isoformes d’apo(a) dans de larges cohortes et les études de randomisation mendélienne. En effet, plus la proportion d’isoformes de faible masse moléculaire est importante, plus la concentration de Lp(a) est élevée et plus le risque de maladie cardiovasculaire augmente (isoformes de petite taille versus isoformes de grande taille, le risque relatif de maladie cardiovasculaire et d’AVC est respectivement de 2,06 et 2,14).3
Les données de prévention primaire ont aussi été validées en prévention secondaire ; ainsi, chez les patients victimes d’IDM précoce, la prévalence des valeurs de Lp(a) dépassant 125 nmol/L (environ 0,50 g/L) est significativement supérieure à celle de la population générale (20 % vs 30 % ; p < 0,001).8 Des données récentes (UK Biobank et Jackson Heart Study) montrent qu’une élévation de 120 nmol/L de la Lp(a) s’associe à une augmentation de 42 % du risque de maladie coronarienne.
Enfin, il est intéressant de noter que les mutations ponctuelles de la séquence d’ADN (SNP, pour single nucleotide polymorphisms) les plus fréquemment associées aux isoformes d’apo(a) de petite taille (rs 10455872 et rs 3798220) sont également associées à une augmentation du risque d’IDM beaucoup plus marquée chez les porteurs des deux polymorphismes.
La sténose aortique, maladie valvulaire la plus fréquente, est le plus souvent due à une calcification dégénérative de la valve aortique liée à l’âge.9 Chez les sujets âgés, ayant des concentrations de Lp(a) élevées (225 nmol/L, soit environ 0,9 g/L), Lp(a) et apo(a) sont observées dans les lésions intimales des sténoses aortiques valvulaires. Le degré de sténose aortique est en rapport avec la quantité de phospholipides oxydés liés à l’Apo B-100 au sein de la Lp(a).
D’autres risques dépendent de la concentration de Lp(a) et des mécanismes en jeu
De nombreuses publications ont évalué la relation entre Lp(a) et diabète de type 2. Elles objectivent un lien probable entre des concentrations très basses de Lp(a) (inférieures ou égales à 25 nmol/L [soit environ 0,1 g/L]) et le risque de diabète de type 2, sans que les mécanismes puissent en être précisés. À l’opposé, les concentrations élevées s’associent à un surcroît de risque cardiovasculaire, tant chez le diabétique de type 2 que chez le diabétique de type 1.
Chez les patients atteints d’une hypercholestérolémie familiale (HF) homo- (HoF) ou hétérozygote (HeF), l’élévation associée des concentrations plasmatiques de Lp(a) majore le risque cardiovasculaire déjà très élevé. Elle doit donc être systématiquement dosée. Le niveau de risque cardiovasculaire des patients dont la Lp(a) est supérieure à 1,8 g/L (environ 450 nmol/L) est comparable à celui des patients qui ont une hypercholestérolémie familiale, mais ils sont probablement deux fois plus nombreux.
Enfin, malgré le rôle avéré des isoformes de Lp(a) dans l’athérothrombose, les études de randomisation mendélienne ou cliniques considérant l’élévation de Lp(a) n’objectivent pas de lien clair avec la maladie thromboembolique veineuse (MTEV) chez l’adulte, sinon en présence d’une thrombophilie. En réalité, le mécanisme de formation des thrombus artériels et veineux est différent. La paroi vasculaire lésée caractérise l’athérothrombose alors que, dans la veine, la stase sanguine joue un rôle prépondérant.
Comment mesurer la Lp(a) ?
La concentration de Lp(a) doit être mesurée par un test immunologique qui ne soit pas affecté par la variation de taille de l’apo(a). Cette concentration est actuellement exprimée en termes de masse, en g/L (ou mg/dL). Des travaux sont en cours afin d’exprimer la concentration en nombre de particules de Lp(a) par unité de volume : en nmol/L.10
Un seuil provisoire
Des concentrations plasmatiques élevées de Lp(a) peuvent également influencer la valeur du LDL-cholestérol. En effet, les équations utilisées pour calculer le LDL-cholestérol incluent le contenu en cholestérol de la Lp(a), ce qui est également vrai pour la plupart des dosages de LDL-cholestérol. Si l’on considère qu’une particule de Lp(a) est composée d’environ 30 à 45 % de cholestérol en poids, une surestimation de la concentration de LDL-cholestérol est observée chez les sujets dont les concentrations de Lp(a) sont élevées.
Lorsque les valeurs de Lp(a) sont exprimées en g/L, la correction simplifiée empirique est la suivante :
LDL-cholestérol corrigé pour la Lp(a) (g/L) = LDL-cholestérol (g/L) − [Lp(a) (g/L) × 0,30].
Le paramètre le plus puissant pour prédire le risque cardiovasculaire associé à la Lp(a) reste sa concentration circulante.
De nouveaux espoirs thérapeutiques
Actuellement, aucun traitement pharmacologique disponible n’abaisse spécifiquement les concentrations de Lp(a), mais de nouveaux médicaments sont en cours d’étude. Ces médicaments pourraient faire l’objet d’une utilisation future, si les résultats de ces essais confirment que la réduction de la Lp(a) diminue les événements cardiovasculaires.11
Les Inhibiteurs de PCSK9 (proprotein convertase subtilisine/kexine type 9)
Inhibiteurs de la Lp(a) : des résultats spectaculaires
La LDL-aphérèse pour des indications très spécifiques
La valeur cible de Lp(a) reste à définir
L’arrivée récente (inhibiteurs de PCSK9) ou prochaine (ONAS et siARN) de nouvelles thérapeutiques anti-apo(a), susceptibles d’en diminuer spécifiquement et significativement la concentration circulante, véhicule de grands espoirs pour les sujets à haut risque cardiovasculaire insuffisamment contrôlés. En termes de diminution de sa concentration, la valeur cible reste à préciser, en gardant à l’esprit que les études récentes de randomisation mendélienne montrent qu’une réduction de 0,7 à 1 g/L (164 à 250 nmol/L) de la Lp(a) pourrait produire un effet équivalent à celui d’une diminution 0,4 g/L (1,0 mmol/L) de LDL-cholestérol.
Points essentiels
La lipoprotéine(a) est constituée d’une lipoparticule LDL athérogène et d’une apolipoprotein(a) potentiellement thrombogène.
Sa concentration plasmatique est génétiquement déterminée, très constante pour un individu donné mais décrivant une variation interindividuelle de 1 à 1 000.
L’augmentation de sa concentration circulante est liée à celle du risque d’athérothrombose chez l’adulte, de sténose valvulaire aortique chez le sujet âgé et de maladie thromboembolique chez l’enfant.
Son dosage présente un intérêt dans la stratification du risque cardiovasculaire en prévention primaire et l’explication d’un surcroît de risque en prévention secondaire. Le praticien doit être suffisamment informé de ces indications.
En cas de Lp(a) élevée, le LDL-cholestérol doit être calculé comme suit :
LDL-cholestérol corrigé par la Lp(a) (g/L) = LDL-cholestérol (g/L) − [Lp(a) (g/L) × 0,30].
La Lp(a) doit être mesurée une fois dans les situations suivantes : sujets à haut risque cardiovasculaire ou ayant des antécédents familiaux de maladie coronarienne prématurée, hypercholestérolémie familiale, diabète de type 1 ou de type 2 et insuffisance rénale chronique.
Chez les patients d’origine caucasienne, une concentration de Lp(a) supérieure ou égale à 125 nmol/L (environ 0,5 g/L) suggère une augmentation du risque de maladie athérothrombotique.
Si la Lp(a) est supérieure à 250 nmol/L (environ 1 g/L), le traitement hypolipémiant doit être intensifié, et un traitement antiagrégant plaquettaire mérite d’être considéré si l’on suspecte une athérosclérose infraclinique (i.e. score calcique coronarien supérieur à 400 UA [unités Agatston], sténose carotidienne supérieure à 50 %).
L’indication de son dosage ainsi que son remboursement devraient être reconsidérés : d’une part du fait de l’arrivée sur le marché de nouvelles thérapies susceptibles de réduire significativement sa concentration circulante (inhibiteurs de PCSK9, oligonucléotides antisens et siARN anti-apo(a)) car une réduction de 0,7 à 1 g/L (environ 164 à 250 nmol/L) de la Lp(a) pourrait produire un effet équivalant à celui d’une diminution de 0,4 g/L (environ 1,0 mmol/L) de LDL-cholestérol ; d’autre part à long terme, pour améliorer l’identification des sujets à haut risque cardiovasculaire et leur prise en charge.
2. Kronenberg F. Human genetics and the causal role of lipoprotein(a) for various diseases. Cardiovasc Drugs Ther 2016;30:87-100.
3. Nordestgaard BG, Langsted A. Lipoprotein (a) as a cause of cardiovascular disease: insights from epidemiology, genetics, and biology. J Lipid Res 2016;57:1953-75.
4. Boffa MB, Koschinsky ML. Oxidized phospholipids as a unifying theory for lipoprotein(a) and cardiovascular disease. Nat Rev Cardiol 2019;16:305-18.
5. Angles-Cano E, de la Pena Diaz A, Loyau S. Inhibition of fibrinolysis by lipoprotein(a). Ann N Y Acad Sci 2001;936:261-75.
6. Emerging Risk Factors Collaboration; Erqou S, Kaptoge S, Perry PL, Di Angelantonio E, Thompson A, Ian R White, et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. JAMA 2009;302:412-23.
7. Nordestgaard BG, Chapman MJ, Ray K, Boren J, Andreotti F, Watts GF, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J 2010;31:2844-53.
8. Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017;38:2459-72.
9. Kamstrup PR, Tybjaerg-Hansen A, Nordestgaard BG. Elevated lipoprotein(a) and risk of aortic valve stenosis in the general population. J Am Coll Cardiol 2014;63:470-7.
10. IFCC, International Federation of Clinical Chemistry and Laboratory Medicine. Apolipoproteins by Mass Spectrometry (WG-APO MS) [en ligne]. 2021 [cité le 8 décembre 2021] Disponible sur : www.ifcc.org/ifcc-scientific-division/sd-working-groups/wg-apo-ms/
11. Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I, Tardif JC, Baum SJ, Steinhagen-Thiessen E, et al. Lipoprotein(a) reduction in persons with cardiovascular disease. N Engl J Med 2020;382:244-55.

 Encadrés
Encadrés