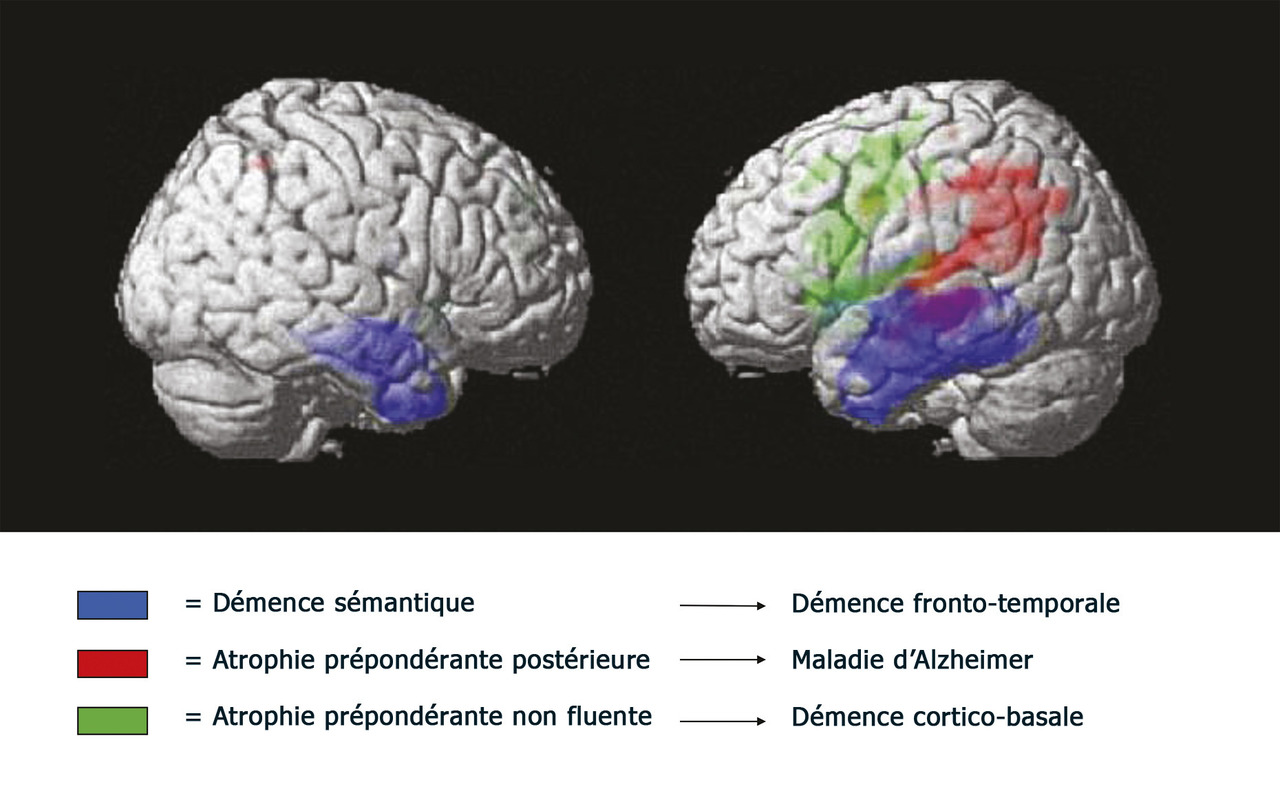
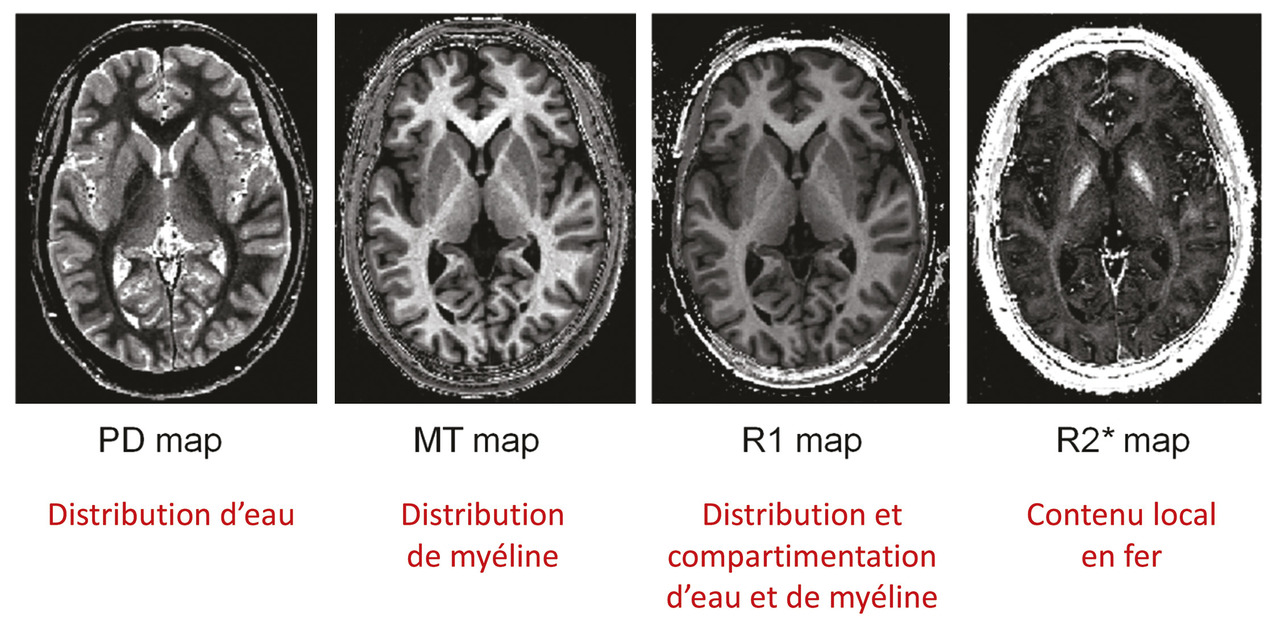
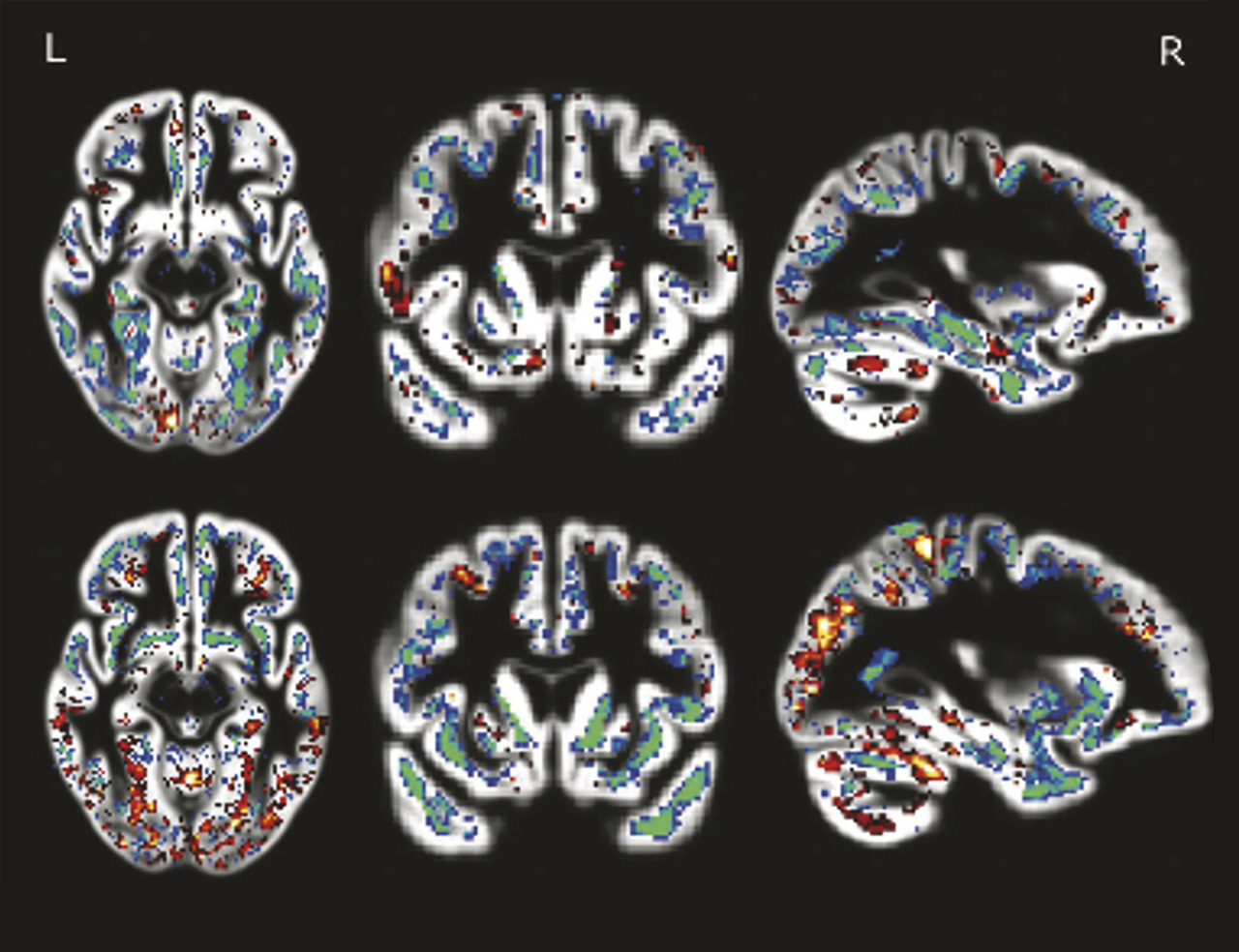
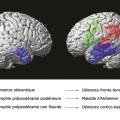
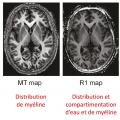
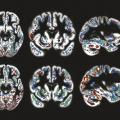
Pour visualiser le cerveau d’un patient atteint de maladie d’Alzheimer, le recours aux imageries par résonance magnétique (IRM) de haute performance semble clairement la meilleure attitude (fig. 1 à 4 ). Toutefois, l’élimination de nombreuses causes de démence peut être obtenue par une bonne anamnèse clinique. Cependant, de nombreuses études montrent qu’une bonne anamnèse un bilan neuropsychologique classique associés à des tests sanguins de routine sont insuffisants pour faire un diagnostic précis d’un patient atteint de démence.1 Ainsi, chaque patient ayant un bilan diagnostique standard devrait aussi avoir une IRM ou une tomodensitométrie pour exclure les rares méningiomes ou anévrismes massifs à croissance lente, les accidents vasculaires cérébraux silencieux et/ou les maladies vasculaires diffuses, car ils sont tous potentiellement traitables.
Imprécision diagnostique
Mais la question qui s’impose est de savoir s’il est utile de distinguer la maladie d’Alzheimer d’autres causes dégénératives de démence. D’habitude, avec l’élimination chez les personnes âgées des causes génétiques rares ou non dégénératives (par exemple traumatiques), un diagnostic de « démence type Alzheimer » est couramment posé, et le nihilisme thérapeutique s’installe. Pourquoi diagnostiquer la maladie d’Alzheimer plutôt que la démence fronto-temporale, d’autant plus qu’un syndrome de démence chez un individu change souvent de catégorie diagnostique au fil du temps ?2 Au cours des deux dernières décennies, la focalisation sur l’amyloïde en tant que facteur causal de la démence dégénérative a conduit à la mise au point de médicaments produisant des résultats limités et parfois malheureux. Une bonne raison pourrait être alors de mieux définir les cohortes pour les essais cliniques. Cependant, des études post-mortem font état d’une erreur de diagnostic clinique de la maladie d’Alzheimer de 30 %, même dans les meilleurs hôpitaux universitaires.1 Plus récemment, on a reconnu la capacité du cerveau humain à compenser la neurodégénérescence. Ainsi, des modifications pathologiques cliniquement compensées, spécifiques de la maladie d’Alzheimer, peuvent exister dans les cerveaux de personnes âgées normales, ce qui introduit une erreur supplémentaire dans le recrutement de cohortes de malades et de témoins pour les essais. On pourrait conclure qu’à ce jour les essais contrôlés randomisés portent sur un syndrome (démence) plutôt que sur une maladie (maladie d’Alzheimer).
Le défi est de taille, les patients sont nombreux et leur degré de dépendance est un problème de fond en matière de politique de santé. Ainsi, il n’y a pas de raison de succomber au pessimisme et au nihilisme clinique. La recherche de tests pour identifier spécifiquement la maladie d’Alzheimer, même dans les phases précliniques, a commencé. Les efforts se sont concentrés sur le génotypage et sur les modifications inflammatoires et biochimiques du sang et du liquide cérébrospinal.3 Ensemble, ces biomarqueurs amélioraient quelque peu les taux de diagnostics différentiels de la démence malgré les inconvénients des ponctions lombaires et des hospitalisations. La preuve de leur exactitude diagnostique provient en grande partie d’études de groupes transversaux, les études longitudinales sont peu fréquentes et celles validées par l’examen post-mortem le sont encore moins.
L’IRM fournit-elle un biomarqueur anatomique non invasif précis pour diagnostiquer les individus sans les hospitaliser ? L’analyse visuelle ne peut certainement pas le faire ; aucun radiologue, même expérimenté, ne diagnostique la maladie d’Alzheimer à partir d’une IRM clinique. De nombreuses études comparant les cohortes de patients et de témoins par IRM (structurelles et fonctionnelles) montraient différents profils d’atrophie cérébrale associés à des démences dégénératives.4 Jusqu’à présent, les analyses d’images d’individus n’ont pas été suffisamment sensibles pour identifier ces profils d’atrophie. De nombreux progrès dans la collecte des IRM sensibles aux différentes caractéristiques de tissus cérébraux sont en cours de développement ; il faut donc espérer qu’une association de profils IRM permettra une telle identification individuelle dans l’avenir.
Le défi est de taille, les patients sont nombreux et leur degré de dépendance est un problème de fond en matière de politique de santé. Ainsi, il n’y a pas de raison de succomber au pessimisme et au nihilisme clinique. La recherche de tests pour identifier spécifiquement la maladie d’Alzheimer, même dans les phases précliniques, a commencé. Les efforts se sont concentrés sur le génotypage et sur les modifications inflammatoires et biochimiques du sang et du liquide cérébrospinal.3 Ensemble, ces biomarqueurs amélioraient quelque peu les taux de diagnostics différentiels de la démence malgré les inconvénients des ponctions lombaires et des hospitalisations. La preuve de leur exactitude diagnostique provient en grande partie d’études de groupes transversaux, les études longitudinales sont peu fréquentes et celles validées par l’examen post-mortem le sont encore moins.
L’IRM fournit-elle un biomarqueur anatomique non invasif précis pour diagnostiquer les individus sans les hospitaliser ? L’analyse visuelle ne peut certainement pas le faire ; aucun radiologue, même expérimenté, ne diagnostique la maladie d’Alzheimer à partir d’une IRM clinique. De nombreuses études comparant les cohortes de patients et de témoins par IRM (structurelles et fonctionnelles) montraient différents profils d’atrophie cérébrale associés à des démences dégénératives.4 Jusqu’à présent, les analyses d’images d’individus n’ont pas été suffisamment sensibles pour identifier ces profils d’atrophie. De nombreux progrès dans la collecte des IRM sensibles aux différentes caractéristiques de tissus cérébraux sont en cours de développement ; il faut donc espérer qu’une association de profils IRM permettra une telle identification individuelle dans l’avenir.
Ce que le recours à l’intelligence artificielle peut changer
Les avancées majeures récentes en informatique, notamment en gestion et analyse de données, offrent une autre vision pour l’avenir. L’apprentissage automatique permet aux ordinateurs d’analyser des images IRM structurelles standard afin de distinguer avec précision les personnes montrant un profil d’atrophie spécifique, un motif caractéristique de la maladie d’Alzheimer validé par l’autopsie.5 La possibilité de classer les individus par IRM change radicalement la donne ! Ces images d’IRM représentent ainsi des biomarqueurs anatomiques spécifiques à la maladie d’Alzheimer.
Une étude a examiné un groupe de patients atteints de maladie d’Alzheimer et un groupe de volontaires sains, les deux appartenant à la cohorte clinique ADNI, disponible en ligne pour la recherche. Seulement 15 des 20 patients ayant une maladie d’Alzheimer diagnostiquée cliniquement avaient le motif IRM typique de la maladie d’Alzheimer, de sorte que 5 n’avaient pas une démence due à la maladie d’Alzheimer. Trois IRM de 20 volontaires normaux montraient le motif d’atrophie typique de la maladie d’Alzheimer, suggérant qu’il s’agissait de sujets atteints de la maladie d’Alzheimer compensée. Une autre étude épidémiologique montre que le motif d’atrophie spécifique de la maladie d’Alzheimer a une valeur pronostique par rapport à l’apparition de symptômes de la démence. À terme, il pourrait être possible d’évaluer les effets des traitements associés aux motifs types d’atrophie cérébrale par des essais cliniques fondés sur des cohortes beaucoup plus homogènes et petits. Des tentatives de corrélations des marqueurs génétiques, biochimiques et anatomiques (IRM) ensemble sont en cours d’exploration pour affiner un diagnostic encore plus précis et plus précoce.
Actuellement, l’intelligence artificielle et les métadonnées sont au centre des intérêts du public. Pour les médecins, ils incitent à développer des diagnostics de démence plus ciblés chez les personnes âgées. La médecine a besoin d’un meilleur diagnostic, sans cela la découverte des mécanismes et des causes de la maladie d’Alzheimer, sans parler des traitements efficaces de la maladie, restera fortuite. La manière la plus appropriée d’avancer consiste à sensibiliser les patients et leurs familles à la nécessité de participer à la recherche clinique moderne et à inciter les responsables politiques de la santé à mettre en place les infrastructures nécessaires. Le domaine de la démence a besoin d’optimisme, et les nouvelles technologies le lui fournissent. L’IRM structurelle moderne ne peut contribuer à l’amélioration du diagnostic que grâce à une coopération entre patients, praticiens, radiologues et chercheurs scientifiques.
Une étude a examiné un groupe de patients atteints de maladie d’Alzheimer et un groupe de volontaires sains, les deux appartenant à la cohorte clinique ADNI, disponible en ligne pour la recherche. Seulement 15 des 20 patients ayant une maladie d’Alzheimer diagnostiquée cliniquement avaient le motif IRM typique de la maladie d’Alzheimer, de sorte que 5 n’avaient pas une démence due à la maladie d’Alzheimer. Trois IRM de 20 volontaires normaux montraient le motif d’atrophie typique de la maladie d’Alzheimer, suggérant qu’il s’agissait de sujets atteints de la maladie d’Alzheimer compensée. Une autre étude épidémiologique montre que le motif d’atrophie spécifique de la maladie d’Alzheimer a une valeur pronostique par rapport à l’apparition de symptômes de la démence. À terme, il pourrait être possible d’évaluer les effets des traitements associés aux motifs types d’atrophie cérébrale par des essais cliniques fondés sur des cohortes beaucoup plus homogènes et petits. Des tentatives de corrélations des marqueurs génétiques, biochimiques et anatomiques (IRM) ensemble sont en cours d’exploration pour affiner un diagnostic encore plus précis et plus précoce.
Actuellement, l’intelligence artificielle et les métadonnées sont au centre des intérêts du public. Pour les médecins, ils incitent à développer des diagnostics de démence plus ciblés chez les personnes âgées. La médecine a besoin d’un meilleur diagnostic, sans cela la découverte des mécanismes et des causes de la maladie d’Alzheimer, sans parler des traitements efficaces de la maladie, restera fortuite. La manière la plus appropriée d’avancer consiste à sensibiliser les patients et leurs familles à la nécessité de participer à la recherche clinique moderne et à inciter les responsables politiques de la santé à mettre en place les infrastructures nécessaires. Le domaine de la démence a besoin d’optimisme, et les nouvelles technologies le lui fournissent. L’IRM structurelle moderne ne peut contribuer à l’amélioration du diagnostic que grâce à une coopération entre patients, praticiens, radiologues et chercheurs scientifiques.
Références
1. Beach TG1, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol 2012;71:266-73.
2. Kertesz A, McMonagle P, Blair M, Davidson W, Munoz DG. The evolution and pathology of frontotemporal dementia. Brain 2005;128:1996-2005.
3. Dubois B, Feldman HH, Jacova C, et al. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurology 2014;13:614-629.
4. Jack CR. Alzheimer disease: new concepts on its neurobiology and the clinical role imaging will play. Radiology 2012;263:344-61.
5. Klöppel S, Stonnington CM, Chu C, et al. Automatic classification of MR scans in Alzheimer’s disease. Brain 2008;131:681-9.
2. Kertesz A, McMonagle P, Blair M, Davidson W, Munoz DG. The evolution and pathology of frontotemporal dementia. Brain 2005;128:1996-2005.
3. Dubois B, Feldman HH, Jacova C, et al. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurology 2014;13:614-629.
4. Jack CR. Alzheimer disease: new concepts on its neurobiology and the clinical role imaging will play. Radiology 2012;263:344-61.
5. Klöppel S, Stonnington CM, Chu C, et al. Automatic classification of MR scans in Alzheimer’s disease. Brain 2008;131:681-9.