Argumenter l'attitude thérapeutique et planifier le suivi du patient.
Épidémiologie de la lithiase urinaire
La prévalence de la maladie lithiasique n’a cessé d’augmenter depuis 50 ans dans les pays occidentaux. D’après l’étude SU.VI.MAX, des antécédents de coliques néphrétiques (CN) ont été retrouvés chez 13,6 % des hommes et 7,6 % des femmes en France. Ces chiffres sous-estiment la fréquence réelle de la lithiase du fait de la fréquence importante de calculs asymptomatiques. Les apports sodés et protéiques, qui ont augmenté au cours du XXe siècle, majorent la calciurie et donc la formation de calculs oxalocalciques. L’épidémie de syndrome métabolique et de diabète favorise la formation de calculs d’acide urique.
L’âge a une influence sur la composition des calculs. Les maladies génétiques rares mais sévères sont plus fréquentes chez les enfants (cystinurie, hyperoxalurie primaire, mutations de l’adénine phosphoribosyl-transférase [APRT]) et les calculs d’acide urique associés au syndrome métabolique et au diabète plus fréquents avec le vieillissement.
Les principales conséquences de la maladie lithiasique sont la morbidité induite par les coliques néphrétiques et les conséquences rénales : infections ou évolution vers l’insuffisance rénale. L’impact économique de la maladie lithiasique est important puisque sur les 120 000 cas annuels de coliques néphrétiques survenant en France, la moitié va nécessiter un geste urologique, soit un coût d’au moins 300 millions d’euros par an.
Mécanismes de la lithogenèse
Les calculs peuvent se former dans le tubule, à la pointe de la papille rénale ou dans les cavités urinaires. La lithogenèse papillaire est due à des plaques interstitielles de phosphate de calcium (carbapatite) à la pointe des papilles (plaques de Randall). Ces plaques finissent par rompre l’urothélium et affleurent au contact de l’urine. Les cristaux urinaires d’oxalate de calcium monohydraté (whewellite) ont une affinité particulière pour ces plaques et forment sur celles-ci des calculs oxalocalciques. Il existe une épidémie de calculs générés sur ces plaques chez les jeunes adultes, peut-être particulièrement sensibles à la vitamine D.
Composition et structure des calculs
Les phases cristallines les plus fréquentes sont l’oxalate de calcium monohydraté (whewellite), qui témoigne d’une concentration élevée de l’urine en oxalate (hyperoxalurie)
Manifestations lithiasiques
Colique néphrétique
Signes cliniques
La douleur est unilatérale lombaire maximale en arrière, irradiant vers la fosse iliaque, la région inguinale et les organes génitaux externes. La douleur est violente, très intense, continue avec des paroxysmes, sans position antalgique.La cause la plus fréquente de colique néphrétique est la migration d’un calcul dans l’uretère sous-pyélique qui entraîne la mise en tension du haut appareil urinaire, mais toute obstruction urétérale peut entraîner une colique néphrétique. La disparition de la douleur n’implique pas l’élimination du calcul.
Signes associés : il n’y a ni fièvre ni anurie dans le cadre d’une colique néphrétique simple. Des signes digestifs type nausées et vomissements ou retard du transit sont possibles, l’abdomen reste souple, mais la fosse lombaire est sensible.
La présence de signes urinaires est évocatrice, notamment l’hématurie. Il existe parfois une pollakiurie, une dysurie lors de l’émission du calcul, surtout chez l’homme.
La bandelette urinaire retrouve très fréquemment une hématurie microscopique : son absence doit faire évoquer des diagnostics différentiels.
Diagnostics différentiels
Colique néphrétique non lithiasique : le début peut être brutal ou plus torpide, et le diagnostic repose sur l’imagerie. Parmi les causes les plus fréquentes, on dénombre :les obstacles endoluminaux : tumeurs, caillots (malformations vasculaires…), nécrose papillaire, corps étrangers, parasites ou filaments mycéliens ;
les sténoses de la jonction pyélo-urétérale ;
les compressions extrinsèques : fibrose rétropéritonéale, grossesse (compression de l’uretère droit), tumeurs, anévrismes aortiques…
Autres causes (non exhaustives) de syndromes douloureux abdomino- lombaires : parmi elles, appendicite, pancréatite, colique hépatique, ulcère digestif, grossesse extra-utérine, salpingite, torsion de kyste de l’ovaire, hernies étranglées…
Il faut évoquer par principe la fissuration de l’anévrisme aortique et l’ischémie mésentérique.
Par ailleurs, les infarctus rénaux peuvent mimer une colique néphrétique : l’imagerie rénale et des LDH élevées permettent de rectifier le diagnostic.
Imagerie
L’imagerie est nécessaire pour affirmer la présence du calcul, son retentissement sur le rein et pour éliminer les diagnostics différentiels.Au cours de la colique néphrétique, il faut réaliser soit une échographie rénale et un cliché d’abdomen sans préparation de face en position allongée, soit un scanner rénal, en général sans injection de produit de contraste (sauf si un diagnostic différentiel est envisagé). Le cliché d’abdomen sans préparation permet de visualiser le calcul si celui-ci a une densité calcique (donc pas l’acide urique) avec une faible sensibilité. L’échographie abdominale permet de mettre en évidence la dilatation des cavités pyélocalicielles au bout de plusieurs heures, mais les calculs sont peu visibles le long de l’uretère. Le scanner est plus performant pour mettre en évidence tous les calculs, la seule limite étant l’irradiation qui justifie la prescription d’un scanner « basse dose ». Il s’agit de l’examen à privilégier en cas de colique néphrétique compliquée (sauf chez la femme enceinte). Le scanner rénal permet d’analyser précisément le nombre et la taille des calculs, leur localisation et leur densité (en unités Hounsfield), basse en cas de calcul non calcique.
Colique néphrétique compliquée
Il s’agit dans tous les cas d’une urgence qui implique un traitement et une hospitalisation en urgence :colique néphrétique fébrile ou associée à un sepsis : elle impose un drainage en urgence des urines (néphrostomie si nécessaire) et une antibiothérapie probabiliste très précoce ;
colique néphrétique hyperalgique ;
colique néphrétique avec insuffisance rénale obstructive : obstacle sur un rein unique anatomique ou fonctionnel, empierrement lithiasique bilatéral, justifiant le drainage en urgence ;
colique néphrétique avec rupture de la voie excrétrice ;
colique néphrétique sur un terrain particulier ou avec des facteurs de gravité liés aux calculs ;
colique néphrétique survenant au cours de la grossesse, chez un greffé ou un insuffisant rénal.
Traitement de la colique néphrétique
Il s’agit d’un traitement essentiellement médical reposant sur la prescription d’anti-inflammatoires non stéroïdiens (AINS) qui diminuent la pression dans les cavités pyélocalicielles et la douleur. Le kétoprofène IV (100 mg en 20 minutes, IVL, maximum 3 fois/j) et le diclofénac IM ont l’autorisation de mise sur le marché dans la colique néphrétique. La prescription d’AINS est contre-indiquée en cas de fièvre et sepsis, d’insuffisance rénale, d’obstacle complet sur les voies urinaires ou au 3e trimestre de la grossesse.Les traitements antalgiques sont associés aux AINS, de niveau I (paracétamol) ou III (morphiniques : buprénorphine ou titration en morphine IV) en fonction de l’échelle visuelle analogique de la douleur, ainsi que parfois les antispasmodiques (phloroglucinol).
Autres manifestations de la lithiase urinaire
Traitement urologique des calculs
Lithotritie extracorporelle (LEC)
La lithotritie extracorporelle est contre-indiquée en cas d’infection urinaire, de troubles de l’hémostase et de prise d’anticoagulants, d’anévrisme vasculaire ou en cas de grossesse. Les calculs très denses au scanner (brushite, whewellite) et les calculs de cystine sont souvent résistants. La lithotritie extracorporelle peut se compliquer d’hématomes rénaux et d’hématurie, et de contusions rénales. Si le calcul persiste après deux séances de lithotritie extracorporelle, une autre technique doit être envisagée.
En général, la lithotritie extracorporelle est réalisée à distance de la colique néphrétique mais peut être utile en urgence en cas de colique néphrétique simple.
Urétéro(réno)scopie
Le principe consiste à introduire par les voies naturelles sous anesthésie générale un endoscope de diamètre réduit afin d’extraire ou fragmenter le calcul (laser holmium-YAG), y compris dans les cavités rénales. Une caméra permet de visualiser les cavités urinaires et de diriger le geste. L’intérêt majeur de cette technique est de fragmenter tous les calculs et d’en évacuer tous les fragments. Le taux de succès est meilleur que pour la lithotritie extracorporelle, environ 95 %, mais les complications sont plus fréquentes, notamment une perforation de l’uretère (1-10 %), plus rarement un stripping de l’uretère ou une hémorragie.
Néphrolithotomie percutanée (NLPC)
Les contre-indications sont les troubles de l’hémostase ou la prise d’anticoagulants, les infections urinaires, les anomalies vasculaires sur le trajet du geste et l’hypertension artérielle non contrôlée.
Les principales complications sont le risque de saignement, plus rarement la création de fistules artérioveineuses, la perforation pyélique ou d’organes de voisinage (côlon), et les complications infectieuses.
Chirurgie par voie cœlioscopique ou à ciel ouvert
Choix de la procédure urologique
La stratégie dépend du calcul (taille, localisation, nombre, composition/dureté), de la voie excrétrice (sténose, diverticule…), du terrain (âge, risque anesthésique, obésité, anticoagulants, grossesse…), du patient (profession, choix personnels), de la disponibilité des techniques sur le plateau opératoire et de leur maîtrise par l’urologue.
Chez l’enfant, la lithotritie extracorporelle est privilégiée en raison de la bonne compliance des uretères. Chez la femme enceinte, lithotritie extracorporelle et néphrolithotomie percutanée sont contre-indiquées. La mise en place d’une sonde JJ changée régulièrement (risque d’incrustation) permet d’attendre l’accouchement avant d’envisager l’intervention.
Explorations étiologiques de la lithiase
Éléments clés de l’interrogatoire
maladie lithiasique : âge de début, côté, symptômes, activité (nombre d’épisodes/an), interventions urologiques (type et date), analyse du calcul, cas familiaux (arbre généalogique), notion de néphrocalcinose ou de maladie rénale ;
autres antécédents : facteurs de risque cardiovasculaires, syndrome métabolique, diarrhées, endocrinopathies… ;
environnement : profession, déshydratation, sport… ;
infections urinaires : type, fréquence, germes, antibiothérapies ;
anomalies urologiques, signes fonctionnels urinaires ;
traitements, y compris suppléments en vitamines (C ou D), régimes ;
habitudes alimentaires : 1) volume quotidien et type des boissons ; 2) aliments riches en oxalate ou en précurseurs : cacao/chocolat noir, épinards, oseille, rhubarbe, betteraves, blettes, fruits secs, akènes, vitamine C en comprimés, thé, viande, gélatine, carambole, polyols ; 3) apports calciques : parts de produits laitiers par jour (lait, fromage, yaourt), eaux riches en calcium ; 4) apports en protéines et en sel.
Examen clinique
Examens biologiques de première intention
Sang : calcémie totale, phosphatémie, uricémie, créatininémie, glycémie à jeun.
Une hypercalcémie (plus de 2,6 mmol/L) oriente vers une hyperparathyroïdie, nécessitant un dosage de parathormone (PTH) et un nouveau dosage de calcémie (ionisée si possible).
Une phosphatémie basse (≤ 0,8 mmol/L) oriente vers une fuite rénale de phosphates.
Une uricémie élevée et une glycémie élevée sont des arguments en faveur d’un syndrome métabolique, voire d’un diabète.
La fonction rénale est évaluée par la créatininémie.
Urines des 24 heures : volume, calciurie, créatininurie, uricurie, urée urinaire, natriurèse.
Le recueil est réalisé au mieux de 20 heures à 20 heures. Le volume urinaire est déterminant. La créatininurie permet de savoir si le recueil sur 24 heures est correct. La créatininurie chez l’homme est de 150 à 250 µmol/kg/24 h (environ 15 mmol/j) et de 100 à 200 µmol/kg/24 h chez la femme (environ 10 mmol/j).
L’hypercalciurie est le second facteur de risque de calcul, après la diurèse insuffisante. On parle d’hypercalciurie de débit quand celle-ci dépasse 0,1 mmol/kg/j ou plus de 7 mmol/j. On parle d’hypercalciurie de concentration lorsque celle-ci dépasse 3,8 mmol/L. Les principales causes d’hypercalciurie à rechercher sont l’hypercalcémie
Les apports sodés quotidiens sont évalués par la natriurèse de 24 heures (en mmol) en divisant celle-ci par 17 pour obtenir les apports de NaCl en grammes (ex : 170 mmol = 10 g).
Les apports protéiques sont évalués en g/j en divisant l’urée urinaire des 24 heures (en mmol) par 5 (ex : 500 mmol = 100 g).
Une uricurie supérieure à 5 mmol/24 heures définit une hyperuricurie de débit, souvent liée à des excès de consommation de purines (abats, gibiers) et/ou de sucres industriels (fructose).
Urines du réveil : densité, pH, bandelette réactive et/ou examen cytobactériologique des urines (ECBU) et cristallurie si disponible.
Une densité urinaire > 1.020 témoigne d’urines concentrées et d’un risque de récidive élevé chez un patient lithiasique.
Un pH urinaire < 5,4 témoigne d’un risque de sursaturation en acide urique, un pH urinaire > 6,6 d’un risque de sursaturation en phosphates.
La bandelette ou l’ECBU mettent en évidence de façon directe ou indirecte la présence de germes ou d’hématies.
Cristallurie
Examens de seconde intention
La bicarbonatémie peut se discuter en première intention et permet de diagnostiquer des acidoses métaboliques (HCO3- < 22 mmol/L).
La magnésémie peut être diminuée dans certaines néphropathies associées à des néphrocalcinoses (syndrome de Bartter, mutation des claudines 16 ou 19) ou en cas de traitement par thiazidiques.
L’oxalurie peut être dosée en cas de cristaux ou calculs évocateurs d’hyperoxalurie.
Le citrate est, avec le magnésium urinaire, le seul inhibiteur de la minéralisation dosé. On observe une hypocitraturie au cours des acidoses métaboliques et dans les ectasies tubulaires précalicielles (maladie de Cacchi-Ricci). La recherche d’une hypocitraturie doit se faire en absence d’infection urinaire sur un prélèvement recueilli sur antiseptique.
L’existence d’une hypercalciurie non diététique justifie la réalisation d’un test de charge orale en calcium (test de Pak) qui permet d’évaluer les participations digestive, rénale et osseuse dans la genèse de l’hypercalciurie.
Analyse des calculs
Grandes causes de la maladie lithiasique
Lithiases dépendantes d’une hypercalciurie
Lithiases calciques avec hypercalcémie
L’hypercalcémie induit une hypercalciurie. Le prototype de l’hypercalcémie chronique est l’hyperparathyroïdie primaire. Les calculs contiennent souvent de l’oxalate de calcium dihydraté (weddellite) et des phosphates calciques (carbapatite ou brushite) du fait de la fuite rénale de phosphate et de la résorption osseuse.Lithiases calciques diététiques, dépendant d’excès d’apports protéiques et sodés (et plus rarement calciques)
Ces calculs sont très fréquents. Il s’agit le plus souvent de calculs formés de weddellite, dépendante de l’hypercalciurie, associée à la whewelliteLithiases calciques non diététiques
Elles nécessitent des compléments d’exploration dont un test de Pak et sont souvent associées à une hyperabsorption digestive du calcium, liée fréquemment à un taux élevé de calcitriol ou à une sensibilité accrue à la vitamine D.Cas plus rares de calculs calciques
La présence d’une hypercalciurie dans un contexte d’urines alcalines induit la précipitation de phosphate de calcium. Cela s’observe dans les acidoses tubulaires distales (génétiques ou acquises : syndrome de Gougerot-Sjögren) ou en cas de prise prolongée d’acétazolamide ou de topiramate.Lithiases dépendant d’une hyperoxalurie
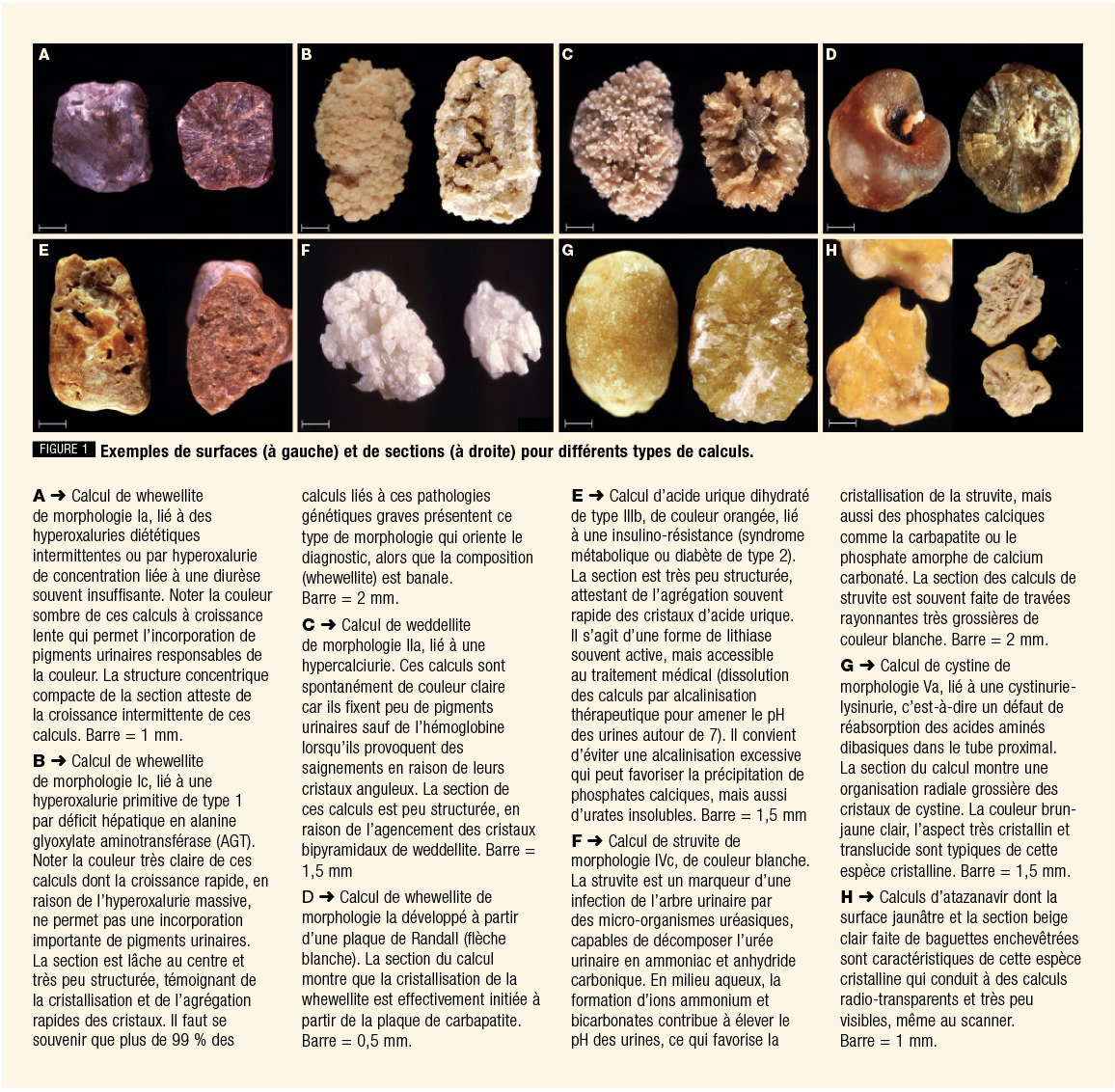
Calculs classiques de whewellite (type Ia, fig. 1A)
L’hyperoxalurie peut être liée à un excès d’apports d’oxalate ou de précurseurs d’oxalate, mais le plus souvent il s’agit d’une hyperoxalurie de concentration liée à une diurèse insuffisante qui induit la cristallisation de whewellite. Ce type de calcul, très fréquent, se développe souvent sur une plaque de Randall papillaire.Calculs dépendants d’une hyperoxalurie entérique
Les diarrhées de malabsorption (maladie de Crohn, grêle court...) majorent la présence d’acides gras libres dans le tube digestif qui fixent le calcium du bol alimentaire et empêchent sa complexation à l’oxalate alimentaire. L’oxalate libre est alors absorbé dans le côlon et induit une hyperoxalurie majeure responsable de calculs récidivants, voire d’insuffisance rénale terminale.Calculs dépendants d’une hyperoxalurie génétique
Les mutations autosomiques récessives de trois enzymes hépatiques (AGT, GRHPR et HOGA1) peuvent conduire à une production accrue d’oxalate qui va précipiter massivement dans les urines dès l’enfance, induisant lithiase, néphrocalcinose et souvent une insuffisance rénale terminale. L’aspect des calculs, très clair et bourgeonnant, oriente le diagnostic, qui est confirmé par les analyses génétiquesCalculs d’acide urique
Calculs infectieux
Calculs de cystine
Calculs médicamenteux
Traitement médical préventif de la maladie lithiasique
Diurèse abondante
Diminution de la calciurie
Les apports calciques ne doivent jamais être trop réduits en cas de lithiase calcique car la diminution des apports calciques favorise l’absorption de l’oxalate alimentaire. D’autre part, les patients lithiasiques sont à risque accru de déminéralisation osseuse. Sauf exception, des apports calciques normaux de 1 g/j (3 produits laitiers) doivent être maintenus, si possible au cours des repas pour complexer l’oxalate.
Si l’hypercalciurie n’est pas diététique, d’autres explorations doivent être envisagées (dosages des métabolites de la vitamine D, test de Pak).
Une hypercalciurie non diététique associée à une lithiase récidivante et/ou à une déminéralisation osseuse doit faire discuter la prescription de diurétiques thiazidiques, qui diminuent la calciurie si le régime est peu salé, idéalement associés à de l’amiloride pour limiter le risque d’hypokaliémie. La kaliémie, la créatininémie et la glycémie doivent être surveillées sous traitement.
Diminution de l’oxalurie
En cas d’hyperoxalurie génétique, une boisson d’au moins 3 à 4 L/j est nécessaire. L’ajout de diurétiques thiazidiques et de citrate de potassium jusqu’à 8 g/j diminue la sursaturation en oxalate de calcium. Certaines mutations répondent partiellement à un traitement par vitamine B6. En cas d’insuffisance rénale terminale, le traitement repose sur une greffe combinée de rein et de foie pour corriger le déficit enzymatique hépatique.
Prévention des calculs d’acide urique
Tout calcul d’acide urique doit inciter à traiter les facteurs de risque cardiovasculaires sous-jacents (hypertension artérielle, diabète, dyslipidémie…).
Prévention des calculs infectieux
Prévention des calculs de cystine
Conclusion
La lithiase rénale, oxalocalcique et urique notamment, affecte désormais près de 10 % de la population.
Un interrogatoire complet et des examens biologiques doivent être réalisés dès la première manifestation clinique de la lithiase, ainsi que l’analyse morpho-constitutionnelle du calcul s’il est disponible.
L’analyse de la cristallurie et/ou du calcul permet de diagnostiquer des maladies génétiques conduisant à l’insuffisance rénale parfois terminale (cystinurie, hyperoxalurie primaire et déficit en adénine phosphoribosyltransférase).
La survenue d’une colique néphrétique fébrile nécessite un drainage des voies urinaires en urgence, l’antibiothérapie probabiliste seule ne peut suffire.
Les calculs d’acide urique, radiotransparents, révèlent souvent un syndrome métabolique ou un diabète devant être pris en charge. Le traitement des calculs repose sur une diurèse alcaline (objectif : pH = 6,5-7,0).
Une diurèse supérieure à 2 L/j, une diminution des apports sodés et protéiques afin de diminuer la calciurie, le maintien d’apports calciques normaux et la diminution des aliments riches en oxalate sont les bases du traitement de la lithiase oxalocalcique.
POINTS FORTS À RETENIR
La lithiase rénale, oxalocalcique et urique notamment, affecte désormais près de 10 % de la population.
Un interrogatoire complet et des examens biologiques doivent être réalisés dès la première manifestation clinique de la lithiase, ainsi que l’analyse morpho-constitutionnelle du calcul s’il est disponible.
L’analyse de la cristallurie et/ou du calcul permet de diagnostiquer des maladies génétiques conduisant à l’insuffisance rénale parfois terminale (cystinurie, hyperoxalurie primaire et déficit en adénine phosphoribosyltransférase).
La survenue d’une colique néphrétique fébrile nécessite un drainage des voies urinaires en urgence, l’antibiothérapie probabiliste seule ne peut suffire.
Les calculs d’acide urique, radiotransparents, révèlent souvent un syndrome métabolique ou un diabète devant être pris en charge. Le traitement des calculs repose sur une diurèse alcaline (objectif : pH = 6,5-7,0).
Une diurèse supérieure à 2 L/j, une diminution des apports sodés et protéiques afin de diminuer la calciurie, le maintien d’apports calciques normaux et la diminution des aliments riches en oxalate sont les bases du traitement de la lithiase oxalocalcique.
Dans cet article
- Épidémiologie de la lithiase urinaire
- Mécanismes de la lithogenèse
- Composition et structure des calculs
- Manifestations lithiasiques
- Traitement urologique des calculs
- Explorations étiologiques de la lithiase
- Grandes causes de la maladie lithiasique
- Traitement médical préventif de la maladie lithiasique
- Conclusion

 Encadrés
Encadrés