Maladie systémique auto-immune rare, le lupus systémique de l’enfant est plus sévère que chez l’adulte, avec des atteintes rénales fréquentes et graves. Au début de la maladie, les signes cutanés, articulaires et hématologiques sont les plus courants. Le traitement des poussées comprend des corticoïdes, le plus souvent par voie générale. Un traitement de fond est indispensable pour éviter les rechutes.
Le lupus systémique (LS) de l’enfant est une maladie systémique auto-immune rare appartenant aux connectivites.
La prévalence du LS, en France, est estimée à 40 pour 100 000 personnes, avec une incidence d’environ 3 ou 4 cas par an pour 100 000. Chez l’enfant, l’incidence varie de 0,3 à 0,9 pour 100 000 par an, avec une prévalence de 3,3 à 8,8 pour 100 000 ;1 la prédominance féminine est moins marquée que chez l’adulte, notamment pour les diagnostics avant l’âge de 10 ans. Les LS pédiatriques sont plus sévères, avec des atteintes rénales fréquentes et graves. De rares formes monogéniques existent, notamment chez les jeunes enfants, tels que les déficits constitutionnels de fractions du complément, les interféronopathies monogéniques ou encore le déficit en protéine kinase C de type delta (PKCδ).2
La prévalence du LS, en France, est estimée à 40 pour 100 000 personnes, avec une incidence d’environ 3 ou 4 cas par an pour 100 000. Chez l’enfant, l’incidence varie de 0,3 à 0,9 pour 100 000 par an, avec une prévalence de 3,3 à 8,8 pour 100 000 ;1 la prédominance féminine est moins marquée que chez l’adulte, notamment pour les diagnostics avant l’âge de 10 ans. Les LS pédiatriques sont plus sévères, avec des atteintes rénales fréquentes et graves. De rares formes monogéniques existent, notamment chez les jeunes enfants, tels que les déficits constitutionnels de fractions du complément, les interféronopathies monogéniques ou encore le déficit en protéine kinase C de type delta (PKCδ).2
Physiopathologie partiellement élucidée
Les mécanismes physiopathologiques du LS sont complexes et non entièrement élucidés. L’implication de nombreux facteurs, notamment immunologiques, environnementaux, hormonaux, génétiques et épigénétiques a été décrite.
La physiopathologie du LS est caractérisée par une réponse immunitaire aberrante impliquant les mécanismes de l’immunité innée et adaptative, qui se traduit par la production de cytokines inflammatoires, l’activation aberrante des lymphocytes T effecteurs, la production d’auto-anticorps dirigés contre les composants des corps apoptotiques (nucléosomes, chromatine, histone, certains ribonucléoprotéides et phospholipides), ainsi que la formation et le dépôt de complexes immuns responsables de l’inflammation des tissus et des atteintes dans différents organes. Le LS est également caractérisé par la production excessive d’une cytokine clé de l’immunité : l’interféron α.
Par ailleurs, les facteurs génétiques jouent un rôle central dans la physiopathologie du lupus à début pédiatrique. En effet, 10 % des patients ont un apparenté de premier degré atteint. Parfois, des mutations sur un seul gène peuvent être responsables d’un tableau de type lupique, on parle alors de lupus monogénique ; il représenterait 7 % des patients atteints de LS pédiatrique.3
Cependant, le déclenchement de la maladie dépend également d’autres facteurs environnementaux, comme l’exposition à la lumière ultraviolette (UV), à certains médicaments, ou encore la suite d’un épisode infectieux.
La physiopathologie du LS est caractérisée par une réponse immunitaire aberrante impliquant les mécanismes de l’immunité innée et adaptative, qui se traduit par la production de cytokines inflammatoires, l’activation aberrante des lymphocytes T effecteurs, la production d’auto-anticorps dirigés contre les composants des corps apoptotiques (nucléosomes, chromatine, histone, certains ribonucléoprotéides et phospholipides), ainsi que la formation et le dépôt de complexes immuns responsables de l’inflammation des tissus et des atteintes dans différents organes. Le LS est également caractérisé par la production excessive d’une cytokine clé de l’immunité : l’interféron α.
Par ailleurs, les facteurs génétiques jouent un rôle central dans la physiopathologie du lupus à début pédiatrique. En effet, 10 % des patients ont un apparenté de premier degré atteint. Parfois, des mutations sur un seul gène peuvent être responsables d’un tableau de type lupique, on parle alors de lupus monogénique ; il représenterait 7 % des patients atteints de LS pédiatrique.3
Cependant, le déclenchement de la maladie dépend également d’autres facteurs environnementaux, comme l’exposition à la lumière ultraviolette (UV), à certains médicaments, ou encore la suite d’un épisode infectieux.
Critères de classification empruntés aux adultes
Les critères de classification de la maladie lupique sont issus de la classification EULAR-ACR 2019 (European League Against Rheumatism-American College of Rheumatology) adaptée à une population adulte. Elle est établie à partir de 21 critères clinico-biologiques et de la positivité obligatoire des anticorps antinucléaires (ACAN) supérieurs à 1/80e sur les cellules HEp2 (human epithelial cell line type 2) ou équivalents.
Il existe également une classification selon les Systemic Lupus International Collaborating Clinics (SLICC) comprenant 17 critères clinico-biologiques. La présence d’au moins quatre critères, dont au moins un critère clinique et un critère biologique ou une histologie de glomérulonéphrite lupique avec des ACAN et/ou des anticorps anti-ADN natif permet d’affirmer l’existence d’un LS avec une sensibilité de 94 % et une spécificité de 92 % (tableau 1 ).4
Il existe également une classification selon les Systemic Lupus International Collaborating Clinics (SLICC) comprenant 17 critères clinico-biologiques. La présence d’au moins quatre critères, dont au moins un critère clinique et un critère biologique ou une histologie de glomérulonéphrite lupique avec des ACAN et/ou des anticorps anti-ADN natif permet d’affirmer l’existence d’un LS avec une sensibilité de 94 % et une spécificité de 92 % (
Tableaux cliniques polymorphes
Au début de la maladie, les signes cutanés, articulaires et hématologiques sont les plus fréquents. L’atteinte rénale, qui est souvent d’emblée sévère, est plus fréquente chez l’enfant que chez l’adulte. Parmi les formes sévères du LS, on retrouve les atteintes du système nerveux central, cardiaques sévères ou pulmonaires à type d’hémorragie intra-alvéolaire, plus rares.
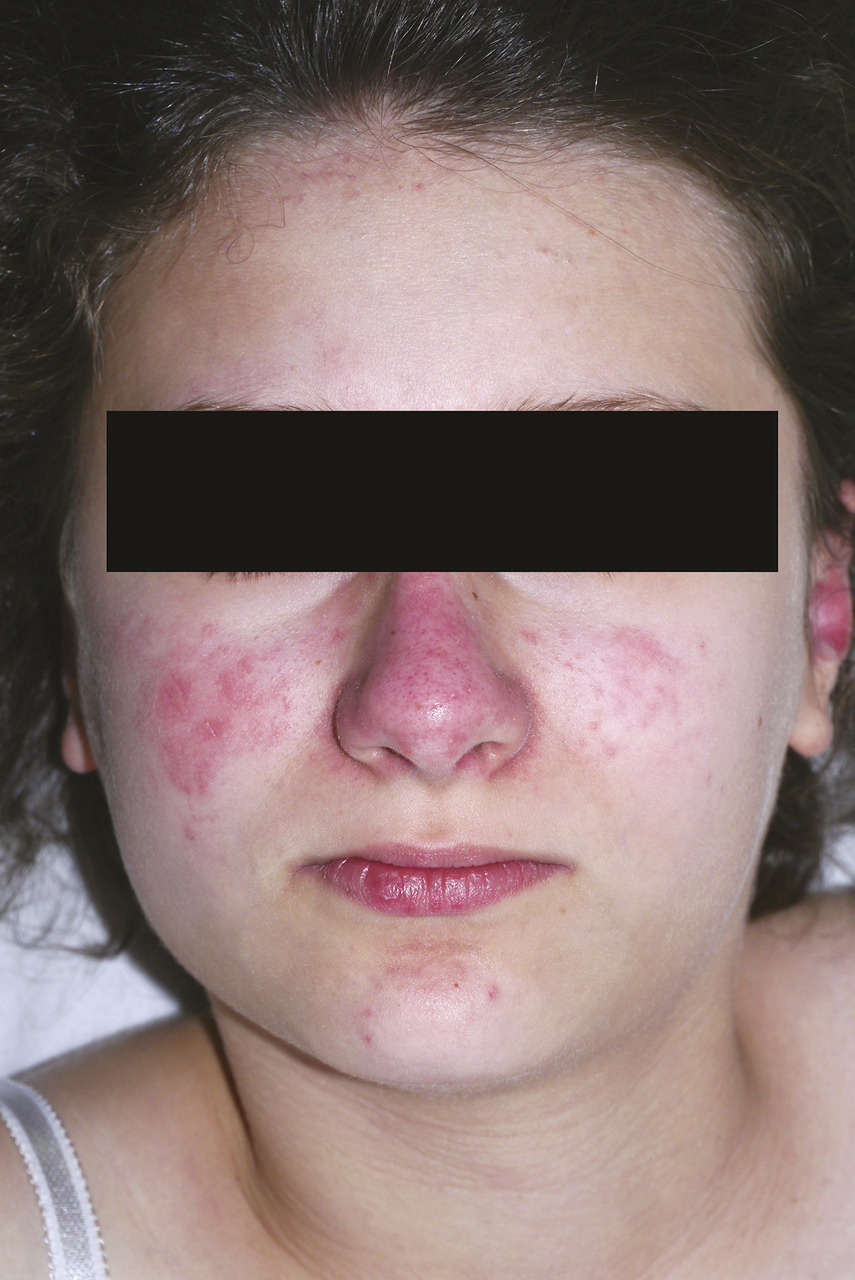
Sur le plan cutané, les signes sont fréquents et variés et se répartissent en atteintes spécifiques lupiques (aigu, subaigu, discoïde) et lésions non spécifiques (photosensibilité, syndrome de Raynaud, atteinte évocatrice de vasculopathie thrombosante, lupus neutrophilique).5 Parmi les lésions les plus typiques, on retrouve le lupus aigu localisé constitué de placards érythémateux, plus ou moins œdémateux ou squameux, voire papuleux, situés majoritairement sur les joues et le nez (figure ), en vespertilio ou en loup, et respectant les sillons nasogéniens, s’étendant souvent sur le front, les orbites, le décolleté. La forme diffuse prédomine généralement sur les zones photo-exposées, réalisant une éruption morbiliforme, papuleuse, eczématiforme ou bulleuse.
Les manifestations articulaires sous forme d’arthrites (typiquement polyarticulaires non érosives et non destructrices) ou d’arthralgies sont fréquentes au cours du lupus et souvent inaugurales. Elles sont présentes dans 65 % des cas au diagnostic et dans 85 % durant l’évolution de la maladie.
L’atteinte hématologique est fréquente.6 Des cytopénies peuvent toucher toutes les lignées ; les mécanismes sont variables mais résultent le plus souvent de la présence d’auto-anticorps. L’anémie est en général d’origine mixte inflammatoire et/ou auto-immune. La thrombopénie est fréquemment modérée et parfois satellite d’un syndrome des antiphospholipides (SAPL). Associée à des ACAN, elle peut précéder parfois de plusieurs années le LS. Le syndrome d’Evans est caractérisé par l’association simultanée ou séquentielle d’une anémie hémolytique auto-immune, d’un purpura thrombocytopénique immunologique, et parfois d’une neutropénie auto-immune. Une leucopénie est notée dans 27 à 52 % des cas, en lien avec une lymphopénie, isolée ou associée à une neutropénie. Quarante pour cent des patients avec un LS ont également des anticorps antiphospholipides, mais le risque de thrombose reste rare. Le diagnostic de SAPL est défini par l’association d’un événement clinique (morbidité obstétricale ou thrombose vasculaire) avec l’existence d’un anticorps anti-phospholipides (tableau 2 ).7
L’atteinte rénale étant fréquente et sévère chez l’enfant, une protéinurie doit être systématiquement recherchée. Le premier symptôme est, le plus souvent, une hématurie microscopique, éventuellement associée à une protéinurie. La présence d’une hypertension artérielle (HTA), d’une protéinurie élevée ou d’une insuffisance rénale est évocatrice d’une atteinte proliférative, mais la corrélation anatomoclinique n’est pas parfaite et une forme agressive peut également être présente avec une protéinurie peu importante. La ponction-biopsie rénale est indiquée devant toute protéinurie significative supérieure ou égale à 0,5 g/24 h ; elle nécessite souvent d’être répétée pour évaluer les lésions histologiques et les séquelles.8 La classification histologique 2003 de l’International Society of Nephrology-Renal Pathology Society (ISR-RPS) est actuellement utilisée9, mais une version, en cours de validation, a été proposée en 2017 de manière à améliorer la reproductibilité entre observateurs (tableau 3 ). Elle propose l’utilisation d’un indice d’activité et de chronicité du National Institute of Health pour évaluer l’activité de la maladie. Elle évalue le secteur tubulo-interstitiel, la fibrose interstitielle et l’atrophie tubulaire, qui seraient des facteurs indépendants de mauvais pronostic rénal, et elle tient compte des lésions vasculaires (lésions de microangiopathie thrombotique) et des lésions de vascularite souvent associées cliniquement à l’hypertension artérielle.10 Le passage d’une classe à l’autre est possible soit sous forme d’amélioration, soit sous forme d’aggravation. Les classes III et IV sont les plus sévères et nécessitent un traitement rapide. Les classes V peuvent coexister avec une classe III ou IV et correspondent à une glomérulonéphrite extramembraneuse. La protéinurie peut mettre un certain temps à se normaliser dans les glomérulonéphrites de classe V sans préjuger de l’évolutivité de la maladie lupique sous-jacente. Ces situations ne doivent pas forcément faire réaliser une nouvelle biopsie, qui est parfois délicate chez le jeune enfant. La classe VI correspond à la glomérulosclérose avec plus de 90 % de glomérules sclérosés sans activité résiduelle.
L’atteinte neurologique est de diagnostic difficile du fait de sa grande hétérogénéité. Elle inclut des manifestations d’origine centrale et périphérique avec un spectre clinique d’atteintes très large allant des céphalées isolées aux crises convulsives (souvent associées à la présence d’anticorps antiphospholipides),11 des troubles psychotiques à une modification de la personnalité, des troubles des performances scolaires ou de la mémoire à court terme aux accidents vasculaires cérébraux, à une chorée ou une myélite transverse. Devant un accident vasculaire cérébral, la recherche d’anticorps antiphospholipides est primordiale. Une imagerie par résonance magnétique (IRM) cérébrale et une ponction lombaire (PL) sont classiquement réalisées, mais ces examens sont peu spécifiques et leur normalité n’exclut pas une possible atteinte neurologique du LS.
L’atteinte pleuropulmonaire peut se manifester par la présence d’un épanchement pleural, d’une pneumopathie interstitielle, d’une hémorragie pulmonaire, de lésions de bronchiolite oblitérante, d’hypertension artérielle pulmonaire et d’embolie pulmonaire.12 Sa fréquence varie entre 5 et 77 % et elle peut être infraclinique. De ce fait, la réalisation d’une radiographie thoracique et d’une exploration fonctionnelle respiratoire avec mesure de la capacité de diffusion libre du monoxyde de carbone (DLCO) est essentielle au diagnostic montrant un syndrome restrictif et/ou une diminution de la diffusion du monoxyde de carbone (observée chez 40 % d’enfants sans anomalie clinique ou radiologique).
Sur le plan cardiaque, l’ensemble des tuniques peuvent être atteintes lors d’une poussée de LS.
Sur le plan cutané, les signes sont fréquents et variés et se répartissent en atteintes spécifiques lupiques (aigu, subaigu, discoïde) et lésions non spécifiques (photosensibilité, syndrome de Raynaud, atteinte évocatrice de vasculopathie thrombosante, lupus neutrophilique).5 Parmi les lésions les plus typiques, on retrouve le lupus aigu localisé constitué de placards érythémateux, plus ou moins œdémateux ou squameux, voire papuleux, situés majoritairement sur les joues et le nez (
Les manifestations articulaires sous forme d’arthrites (typiquement polyarticulaires non érosives et non destructrices) ou d’arthralgies sont fréquentes au cours du lupus et souvent inaugurales. Elles sont présentes dans 65 % des cas au diagnostic et dans 85 % durant l’évolution de la maladie.
L’atteinte hématologique est fréquente.6 Des cytopénies peuvent toucher toutes les lignées ; les mécanismes sont variables mais résultent le plus souvent de la présence d’auto-anticorps. L’anémie est en général d’origine mixte inflammatoire et/ou auto-immune. La thrombopénie est fréquemment modérée et parfois satellite d’un syndrome des antiphospholipides (SAPL). Associée à des ACAN, elle peut précéder parfois de plusieurs années le LS. Le syndrome d’Evans est caractérisé par l’association simultanée ou séquentielle d’une anémie hémolytique auto-immune, d’un purpura thrombocytopénique immunologique, et parfois d’une neutropénie auto-immune. Une leucopénie est notée dans 27 à 52 % des cas, en lien avec une lymphopénie, isolée ou associée à une neutropénie. Quarante pour cent des patients avec un LS ont également des anticorps antiphospholipides, mais le risque de thrombose reste rare. Le diagnostic de SAPL est défini par l’association d’un événement clinique (morbidité obstétricale ou thrombose vasculaire) avec l’existence d’un anticorps anti-phospholipides (
L’atteinte rénale étant fréquente et sévère chez l’enfant, une protéinurie doit être systématiquement recherchée. Le premier symptôme est, le plus souvent, une hématurie microscopique, éventuellement associée à une protéinurie. La présence d’une hypertension artérielle (HTA), d’une protéinurie élevée ou d’une insuffisance rénale est évocatrice d’une atteinte proliférative, mais la corrélation anatomoclinique n’est pas parfaite et une forme agressive peut également être présente avec une protéinurie peu importante. La ponction-biopsie rénale est indiquée devant toute protéinurie significative supérieure ou égale à 0,5 g/24 h ; elle nécessite souvent d’être répétée pour évaluer les lésions histologiques et les séquelles.8 La classification histologique 2003 de l’International Society of Nephrology-Renal Pathology Society (ISR-RPS) est actuellement utilisée9, mais une version, en cours de validation, a été proposée en 2017 de manière à améliorer la reproductibilité entre observateurs (
L’atteinte neurologique est de diagnostic difficile du fait de sa grande hétérogénéité. Elle inclut des manifestations d’origine centrale et périphérique avec un spectre clinique d’atteintes très large allant des céphalées isolées aux crises convulsives (souvent associées à la présence d’anticorps antiphospholipides),11 des troubles psychotiques à une modification de la personnalité, des troubles des performances scolaires ou de la mémoire à court terme aux accidents vasculaires cérébraux, à une chorée ou une myélite transverse. Devant un accident vasculaire cérébral, la recherche d’anticorps antiphospholipides est primordiale. Une imagerie par résonance magnétique (IRM) cérébrale et une ponction lombaire (PL) sont classiquement réalisées, mais ces examens sont peu spécifiques et leur normalité n’exclut pas une possible atteinte neurologique du LS.
L’atteinte pleuropulmonaire peut se manifester par la présence d’un épanchement pleural, d’une pneumopathie interstitielle, d’une hémorragie pulmonaire, de lésions de bronchiolite oblitérante, d’hypertension artérielle pulmonaire et d’embolie pulmonaire.12 Sa fréquence varie entre 5 et 77 % et elle peut être infraclinique. De ce fait, la réalisation d’une radiographie thoracique et d’une exploration fonctionnelle respiratoire avec mesure de la capacité de diffusion libre du monoxyde de carbone (DLCO) est essentielle au diagnostic montrant un syndrome restrictif et/ou une diminution de la diffusion du monoxyde de carbone (observée chez 40 % d’enfants sans anomalie clinique ou radiologique).
Sur le plan cardiaque, l’ensemble des tuniques peuvent être atteintes lors d’une poussée de LS.
Critères biologiques utiles au diagnostic
Il existe classiquement un syndrome inflammatoire biologique modéré avec une augmentation de la vitesse de sédimentation alors que la protéine C-réactive (CRP) est peu ou pas élevée en dehors d’une infection concomitante, d’une atteinte des séreuses, d’un syndrome d’activation macrophagique ou d’une thrombose.
Sur le plan immunologique, les ACAN sont présents dans 94 à 100 % des LS pédiatriques. Un taux inférieur à 1/160 rend ainsi le diagnostic de lupus peu probable. Cependant, ils restent peu spécifiques, car ils sont retrouvés chez 0,8 % des enfants. En revanche, la présence d’anticorps anti-ADN est plus spécifique. Les anticorps anti-antigènes nucléaires solubles (anti-ENA) doivent également être recherchés : il s’agit des anti-Sm très spécifiques du lupus ; des anti-SSA et SSB dirigés contre des antigènes nucléaires et cytoplasmiques retrouvés également dans le syndrome de Gougerot-Sjögren, le lupus subaigu et le lupus néonatal ; des anti-RNP présents dans les connectivites mixtes.
L’étude du complément est primordiale. Lors d’une poussée, la voie classique est activée, il en résulte une hypocomplémentémie avec diminution de la fraction C3 et/ou de la fraction C4 chez 65 à 91 % des enfants. L’absence de normalisation du C4 en période de rémission doit faire rechercher une cryoglobulinémie et une analyse du nombre de copies des gènes C4A et C4B.13 Une diminution de la fraction CH50 persistante doit faire rechercher un déficit des fractions du complément (même si les fractions C4 et C3 sont normales). L’association d’une hypocomplémentémie et d’un titre élevé d’anticorps anti-ADN natif a une valeur prédictive positive de 100 % pour le diagnostic de LS.
Sur le plan immunologique, les ACAN sont présents dans 94 à 100 % des LS pédiatriques. Un taux inférieur à 1/160 rend ainsi le diagnostic de lupus peu probable. Cependant, ils restent peu spécifiques, car ils sont retrouvés chez 0,8 % des enfants. En revanche, la présence d’anticorps anti-ADN est plus spécifique. Les anticorps anti-antigènes nucléaires solubles (anti-ENA) doivent également être recherchés : il s’agit des anti-Sm très spécifiques du lupus ; des anti-SSA et SSB dirigés contre des antigènes nucléaires et cytoplasmiques retrouvés également dans le syndrome de Gougerot-Sjögren, le lupus subaigu et le lupus néonatal ; des anti-RNP présents dans les connectivites mixtes.
L’étude du complément est primordiale. Lors d’une poussée, la voie classique est activée, il en résulte une hypocomplémentémie avec diminution de la fraction C3 et/ou de la fraction C4 chez 65 à 91 % des enfants. L’absence de normalisation du C4 en période de rémission doit faire rechercher une cryoglobulinémie et une analyse du nombre de copies des gènes C4A et C4B.13 Une diminution de la fraction CH50 persistante doit faire rechercher un déficit des fractions du complément (même si les fractions C4 et C3 sont normales). L’association d’une hypocomplémentémie et d’un titre élevé d’anticorps anti-ADN natif a une valeur prédictive positive de 100 % pour le diagnostic de LS.
Début précoce ou forme familiale : penser au lupus monogénique
Les LS par défaut d’efferocytose représentent 1 % des cas et sans doute plus de 5 % des formes juvéniles. On retrouve, par ordre de fréquence, les déficits en C1q (90 % de LS en cas de déficit complet), puis les déficits en C4, C2 et C3. La susceptibilité aux infections, notamment aux germes encapsulés, le profil immunologique avec présence d’ACAN sans anti-ADN natif et une fraction CH50 abaissée même en dehors des poussées sont des éléments d’alerte devant faire évoquer un LS par déficit en complément.14 Les déficits en C1q d’origine autosomique récessif sont responsables de LS à début précoce avec atteinte du système nerveux central et néphrite lupique. La vascularite hypocomplémentémique urticarienne (ou syndrome de McDuffie) doit faire évoquer un déficit en DNASE1L3 (deoxyribonuclease 1 like 3). Les ACAN sont alors souvent positifs. Les LS observés dans le cadre des interféronopathies se caractérisent par un début précoce avec auto-immunité familiale, engelures, calcifications cérébrales, microcéphalie, atteinte neurologique et signature interféron fortement positive (tableau 4 ).15
Les lymphocytes B (LB) jouent un rôle central dans la pathogenèse du lupus, et le déficit en protéine kinase C-δ (PKCδ) [molécule proapoptotique essentielle dans la survie et la tolérance des LB]16,17 a été identifié comme la première forme de lupus monogénique liée aux LB, qui est caractérisée par une perturbation de l’homéostasie de ces derniers. Le déficit en PKCδ, autosomique récessif, donne des tableaux de LS avec un large spectre phénotypique clinique : syndromes lymphoprolifératifs, susceptibilité aux infections, défaut de maturation des lymphocytes B.
D’autres anomalies génétiques définissant le champ des RASopathies (PTPN11, SOS1, KRAS, NRAS, RAF1, BRAF, SHOC2, CBL) s’accompagnent d’une petite taille, d’une dysmorphie crâniofaciale, de malformation cardiaque, d’une lymphoprolifération et d’auto-immunité lupique. Concernant les malformations cardiaques, les plus caractéristiques sont une dysplasie de la valve pulmonaire et/ou une sténose pulmonaire supravalvulaire, mais de nombreuses autres peuvent être présentes, en particulier une communication interventriculaire (CIV) ou interauriculaire (CIA). Une cardiomyopathie hypertrophique est observée dans 20 % des cas.
Les lymphocytes B (LB) jouent un rôle central dans la pathogenèse du lupus, et le déficit en protéine kinase C-δ (PKCδ) [molécule proapoptotique essentielle dans la survie et la tolérance des LB]16,17 a été identifié comme la première forme de lupus monogénique liée aux LB, qui est caractérisée par une perturbation de l’homéostasie de ces derniers. Le déficit en PKCδ, autosomique récessif, donne des tableaux de LS avec un large spectre phénotypique clinique : syndromes lymphoprolifératifs, susceptibilité aux infections, défaut de maturation des lymphocytes B.
D’autres anomalies génétiques définissant le champ des RASopathies (PTPN11, SOS1, KRAS, NRAS, RAF1, BRAF, SHOC2, CBL) s’accompagnent d’une petite taille, d’une dysmorphie crâniofaciale, de malformation cardiaque, d’une lymphoprolifération et d’auto-immunité lupique. Concernant les malformations cardiaques, les plus caractéristiques sont une dysplasie de la valve pulmonaire et/ou une sténose pulmonaire supravalvulaire, mais de nombreuses autres peuvent être présentes, en particulier une communication interventriculaire (CIV) ou interauriculaire (CIA). Une cardiomyopathie hypertrophique est observée dans 20 % des cas.
Lupus néonatal : un lupus passif transmis et transitoire avec risque de séquelles cardiaques
Le lupus néonatal concerne les nouveau-nés de mère lupique, avec un passage transplacentaire des anticorps maternels anti-SSA. Dans 25 à 80 % des cas, le LS néonatal permet de faire le diagnostic chez la mère qui est asymptomatique.18 Les nouveau-nés peuvent présenter des lésions cutanées transitoires souvent érythémato-squameuses, touchant de manière préférentielle le visage (région périorbitaire) puis, par ordre de fréquence, le scalp, le tronc, les membres et les plis. Une atteinte hématologique transitoire, bien que plus rare, est également possible. La maladie débute six semaines après la naissance et peut durer jusqu’à 17 semaines de vie environ. La gravité du tableau dépend de l’atteinte cardiaque irréversible entraînant un bloc auriculoventriculaire complet congénital responsable de 15 à 35 % de décès. Le diagnostic est réalisé en période anténatale le plus souvent, devant un ralentissement du rythme cardiaque fœtal. La pose d’un pacemaker est nécessaire dans la moitié des cas.
Modalités de traitement et de suivi
Le traitement des poussées comprend une corticothérapie, parfois locale dans les atteintes cutanées, et la plupart du temps par voie générale. Aux corticoïdes sont souvent associés des immunosuppresseurs (mycophénolate mofétil, azathioprine, cyclophosphamide, méthotrexate). Les biothérapies (rituximab, bélimumab) ont également leur place dans les formes sévères ou articulaires.
De nombreux traitements sont à l’étude. Parmi les pistes thérapeutiques futures, on retrouve les inhibiteurs des JAK, les inhibiteurs de l’IL-12 et 23 (ustékinumab), les inhibiteurs du récepteur de l’interféron α (IFNAR1, anifrolumab).
Un traitement de fond du lupus est indispensable pour éviter les rechutes. Il comprend de l’hydroxychloroquine, avec nécessaire surveillance ophtalmologique régulière.
Par ailleurs, un ensemble de mesures non médicamenteuses doivent être également prises. La photoprotection est ainsi essentielle. En effet, l’exposition solaire peut être à l’origine d’une poussée, notamment cutanée, de la maladie. Sur le plan infectieux, une vaccination rigoureuse des enfants est nécessaire :19 la vaccination antipneumococcique doit être renforcée par un vaccin polysaccharidique à partir de l’âge de 2 ans et doit faire suite à une vaccination par Prevenar 13 avec un délai d’au moins deux mois entre les deux injections. Enfin, comme dans toutes les maladies chroniques, l’éducation thérapeutique a une place de choix dans la prise en charge du LS.
Un suivi clinico-biologique est nécessaire au moins tous les trois mois du fait du risque élevé de néphropathie lupique, mais également pour évaluer la croissance de ces enfants souvent soumis à une corticothérapie prolongée.
De nombreux traitements sont à l’étude. Parmi les pistes thérapeutiques futures, on retrouve les inhibiteurs des JAK, les inhibiteurs de l’IL-12 et 23 (ustékinumab), les inhibiteurs du récepteur de l’interféron α (IFNAR1, anifrolumab).
Un traitement de fond du lupus est indispensable pour éviter les rechutes. Il comprend de l’hydroxychloroquine, avec nécessaire surveillance ophtalmologique régulière.
Par ailleurs, un ensemble de mesures non médicamenteuses doivent être également prises. La photoprotection est ainsi essentielle. En effet, l’exposition solaire peut être à l’origine d’une poussée, notamment cutanée, de la maladie. Sur le plan infectieux, une vaccination rigoureuse des enfants est nécessaire :19 la vaccination antipneumococcique doit être renforcée par un vaccin polysaccharidique à partir de l’âge de 2 ans et doit faire suite à une vaccination par Prevenar 13 avec un délai d’au moins deux mois entre les deux injections. Enfin, comme dans toutes les maladies chroniques, l’éducation thérapeutique a une place de choix dans la prise en charge du LS.
Un suivi clinico-biologique est nécessaire au moins tous les trois mois du fait du risque élevé de néphropathie lupique, mais également pour évaluer la croissance de ces enfants souvent soumis à une corticothérapie prolongée.
Références
1. Harry O, Yasin S, Brunner H. Childhood-onset systemic lupus erythematosus: A review and update. J Pediatr 2018;196:22-30.e2.
2. Omarjee O, Picard C, Frachette C, Moreews M, Rieux-Laucat F, Soulas-Sprauel P, et al. Monogenic lupus: Dissecting heterogeneity. Autoimmun Rev 2019;18(10):102361.
3. Farivar S, Shaabanpour Aghamaleki F. Effects of major epigenetic factors on systemic lupus erythematosus. Iran Biomed J 2018;22(5):294‑302.
4. Petri M, Orbai AM, Alarcón GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012;64(8):2677‑86.
5. Arkin LM, Nguyen C, Klein-Gitelman M. Cutaneous manifestations of pediatric lupus. Curr Opin Rheumatol 2019;31(5):411‑20.
6. Levy DM, Kamphuis S. Systemic lupus erythematosus in children and adolescents. Pediatr Clin North Am 2012;59(2):345‑64.
7. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost JTH 2006;4(2):295‑306.
8. Wilhelmus S, Bajema IM, Bertsias GK, Boumpas DT, Gordon C, Lighstone L, et al. Lupus nephritis management guidelines compared. Nephrol Dial Tranplant 2016;31(6):904-13.
9. Hachiya A, Karasawa M, Imaizumi T, Kato N, Katsuno T, Ishimoto T, et al. The ISN/RPS 2016 classification predicts renal prognosis in patients with first-onset class III/IV lupus nephritis. Sci Rep 2021;11(1):1525.
10. Bajema IM, Wilhelmus S, Alpers CE, Bruijn JA, Colvin RB, Cook HT, et al. Revision of the International Society of Nephrology/Renal Pathology Society classification for lupus nephritis: Clarification of definitions, and modified National Institutes of Health activity and chronicity indices. Kidney Int 2018;93(4):789‑96.
11. Shaban A, Leira EC. Neurological complications in patients with systemic lupus erythematosus. Curr Neurol Neurosci Rep 2019;19(12):97.
12. Hannah JR, D’Cruz DP. Pulmonary complications of systemic lupus erythematosus. Semin Respir Crit Care Med 2019;40(2):227-34.
13. Wu Z, Zhang S, Li P, Zhang F, Li Y. Association between complement 4 copy number variation and systemic lupus erythematosus: A meta-analysis. Clin Exp Med 2020;20(4):627‑34.
14. Mitchell DA, Pickering MC, Warren J, Fossati-Jimack L, Cortes-Hernandez J, Cook HT, et al. C1q deficiency and autoimmunity: The effects of genetic background on disease expression. J Immunol Baltim Md 1950 2002;168(5):2538‑43.
15. Rice G, Newman WG, Dean J, Patrick T, Parmar R, Flintoff K, et al. Heterozygous mutations in TREX1 cause familial chilblain lupus and dominant Aicardi-Goutieres syndrome. Am J Hum Genet 2007;80(4):811‑5.
16. Belot A, Kasher PR, Trotter EW, Foray AP, Debaud AL, Rice GI, et al. Protein kinase cδ deficiency causes mendelian systemic lupus erythematosus with B cell-defective apoptosis and hyperproliferation. Arthritis Rheum 2013;65(8):2161‑71.
17. Richardson B, Strickland FM, Sawalha AH, Gorelik G. Protein kinase Cδ mutations may contribute to lupus through effects on T cells: Comment on the article by Belot et al. Arthritis Rheumatol Hoboken NJ 2014;66(1):228‑9.
18. Morel N, Georgin-Lavialle S, Levesque K, Guettrot-Imbert G, Le Guern V, Le Bidois J, et al. Neonatal lupus syndrome: Literature review. Rev Med Interne 2015;36(3):159‑66.
19. Amoura Z, FAIIR. Protocole national de diagnostic et de soins Lupus systémique. Février 2020. https://vu.fr/dPb
2. Omarjee O, Picard C, Frachette C, Moreews M, Rieux-Laucat F, Soulas-Sprauel P, et al. Monogenic lupus: Dissecting heterogeneity. Autoimmun Rev 2019;18(10):102361.
3. Farivar S, Shaabanpour Aghamaleki F. Effects of major epigenetic factors on systemic lupus erythematosus. Iran Biomed J 2018;22(5):294‑302.
4. Petri M, Orbai AM, Alarcón GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012;64(8):2677‑86.
5. Arkin LM, Nguyen C, Klein-Gitelman M. Cutaneous manifestations of pediatric lupus. Curr Opin Rheumatol 2019;31(5):411‑20.
6. Levy DM, Kamphuis S. Systemic lupus erythematosus in children and adolescents. Pediatr Clin North Am 2012;59(2):345‑64.
7. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost JTH 2006;4(2):295‑306.
8. Wilhelmus S, Bajema IM, Bertsias GK, Boumpas DT, Gordon C, Lighstone L, et al. Lupus nephritis management guidelines compared. Nephrol Dial Tranplant 2016;31(6):904-13.
9. Hachiya A, Karasawa M, Imaizumi T, Kato N, Katsuno T, Ishimoto T, et al. The ISN/RPS 2016 classification predicts renal prognosis in patients with first-onset class III/IV lupus nephritis. Sci Rep 2021;11(1):1525.
10. Bajema IM, Wilhelmus S, Alpers CE, Bruijn JA, Colvin RB, Cook HT, et al. Revision of the International Society of Nephrology/Renal Pathology Society classification for lupus nephritis: Clarification of definitions, and modified National Institutes of Health activity and chronicity indices. Kidney Int 2018;93(4):789‑96.
11. Shaban A, Leira EC. Neurological complications in patients with systemic lupus erythematosus. Curr Neurol Neurosci Rep 2019;19(12):97.
12. Hannah JR, D’Cruz DP. Pulmonary complications of systemic lupus erythematosus. Semin Respir Crit Care Med 2019;40(2):227-34.
13. Wu Z, Zhang S, Li P, Zhang F, Li Y. Association between complement 4 copy number variation and systemic lupus erythematosus: A meta-analysis. Clin Exp Med 2020;20(4):627‑34.
14. Mitchell DA, Pickering MC, Warren J, Fossati-Jimack L, Cortes-Hernandez J, Cook HT, et al. C1q deficiency and autoimmunity: The effects of genetic background on disease expression. J Immunol Baltim Md 1950 2002;168(5):2538‑43.
15. Rice G, Newman WG, Dean J, Patrick T, Parmar R, Flintoff K, et al. Heterozygous mutations in TREX1 cause familial chilblain lupus and dominant Aicardi-Goutieres syndrome. Am J Hum Genet 2007;80(4):811‑5.
16. Belot A, Kasher PR, Trotter EW, Foray AP, Debaud AL, Rice GI, et al. Protein kinase cδ deficiency causes mendelian systemic lupus erythematosus with B cell-defective apoptosis and hyperproliferation. Arthritis Rheum 2013;65(8):2161‑71.
17. Richardson B, Strickland FM, Sawalha AH, Gorelik G. Protein kinase Cδ mutations may contribute to lupus through effects on T cells: Comment on the article by Belot et al. Arthritis Rheumatol Hoboken NJ 2014;66(1):228‑9.
18. Morel N, Georgin-Lavialle S, Levesque K, Guettrot-Imbert G, Le Guern V, Le Bidois J, et al. Neonatal lupus syndrome: Literature review. Rev Med Interne 2015;36(3):159‑66.
19. Amoura Z, FAIIR. Protocole national de diagnostic et de soins Lupus systémique. Février 2020. https://vu.fr/dPb
Dans cet article
- Physiopathologie partiellement élucidée
- Critères de classification empruntés aux adultes
- Tableaux cliniques polymorphes
- Critères biologiques utiles au diagnostic
- Début précoce ou forme familiale : penser au lupus monogénique
- Lupus néonatal : un lupus passif transmis et transitoire avec risque de séquelles cardiaques
- Modalités de traitement et de suivi