Pour rappel, selon l’étude de pharmacoépidémiologie conduite par Épi-Phare entre 2007 et 2018, les femmes traitées avec ces molécules voient leur risque de méningiome multiplié par 3 (par rapport à celles non exposées), lorsque la durée de traitement dépasse 6 mois. Ce risque augmente avec la dose utilisée et la durée du traitement : il est multiplié par 12 après 5 ans de traitement par acétate de nomégestrol (5 mg/jour pendant 20 jours/mois) et par 7 après 3,5 ans de traitement par acétate de chlormadinone (10 mg/jour pendant 20 jours/mois).
L’EMA et l’ANSM ont ainsi rappelé que :
- Les médicaments contenant de l’acétate de chlormadinone (5 à 10 mg/comprimé) ou de l’acétate de nomégestrol (5 mg/comprimé) sont indiqués uniquement lorsque les autres traitements sont inadaptés. Avec ces médicaments, le risque de développer un méningiome augmente avec la dose et la durée d’utilisation du traitement. Celui-ci doit, par conséquent, être limité à la dose minimale efficace et à la durée la plus courte possible.
- Les médicaments contenant de l’acétate de chlormadinone ou de l’acétate de nomégestrol, y compris en association à un estrogène et à faibles doses, sont contre-indiqués chez les patientes ayant un méningiome ou un antécédent de méningiome.
- Les patientes doivent faire l’objet d’une surveillance pour le suivi et la détection de méningiomes conformément à la pratique clinique, notamment une surveillance par imagerie cérébrale.
- Si un méningiome est diagnostiqué chez une patiente traitée par l’un de ces médicaments, le traitement doit être arrêté définitivement et ne plus jamais être prescrit à la patiente (contre-indication).
Les conditions de prescription et les recommandations sur le suivi de ces patientes, émises par l’ANSM dès janvier 2021, restent inchangées (v. ci-dessous).
Deux documents à remettre obligatoirement aux patientes
La prescription et le renouvellement de ces deux spécialités, ainsi que leur délivrance en pharmacie, sont conditionnées à :
– la cosignature par le prescripteur et la patiente d’une attestation annuelle d’information dès que la durée du traitement est supérieure à 1 an ; cette attestation est donc à renouveler chaque année, après la première année de traitement ;
– la remise à la patiente, par le prescripteur, d’un document d’information lors de toute première prescription ou renouvellement. Il s’agit d’un récapitulatif des éléments que celle-ci doit connaître afin de garantir son consentement éclairé : risque de méningiome associé à un traitement par acétate de nomégestrol et acétate de chlormadinone, modalités de suivi médical (v. ci-dessous), symptômes évoquant un méningiome et conduite à tenir…
Ces deux documents sont disponibles sur le site de l’ANSM.
En outre, la durée du traitement (inférieure ou supérieure à 1 an) doit être inscrite sur l’ordonnance.
Ces mesures, obligatoires depuis le 1er juillet 2021 pour les initiations de traitement, le sont aussi pour les renouvellements depuis le 1er janvier 2022.
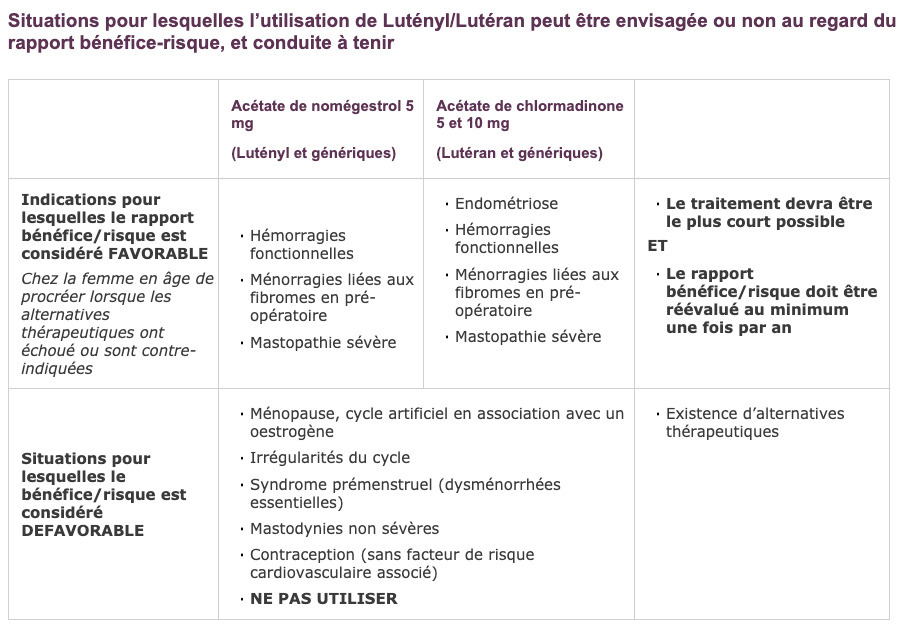
Rappel des recommandations pour la prescription
Voir tableau.
Conduite à tenir en cas de prescription
- Informer la patiente du risque de méningiome et des modalités de surveillance par imagerie cérébrale (v. ci-dessous).
- Remettre le document d’information à la patiente et une copie de l’attestation annuelle d’information cosignée.
- Limiter la durée d’utilisation de ces médicaments ainsi que leurs posologies aux doses minimales efficaces (effet dose cumulée).
- Réévaluer au minimum une fois par an la pertinence du traitement en tenant compte du bénéfice-risque individuel.
- En cas de découverte d’un méningiome au cours du traitement, celui-ci devra définitivement être arrêté et un avis neurochirurgical sera requis.
- Ne pas substituer entre eux l’acétate de nomégestrol, l’acétate de chlormadinone et l’acétate de cyprotérone (Androcur et génériques) en cas de méningiome ou d’antécédent de méningiome.
Modalités de surveillance par imagerie cérébrale (IRM)
Les recommandations de réalisation d’un examen par IRM, quel que soit l’âge de la patiente, sont répertoriées dans la figure.
ANSM. Nouvelles conditions de prescription et de délivrance des spécialités à base d’acétate de nomégestrol (Lutényl et génériques) et d’acétate de chlomadinone (Lutéran et génériques), liées au risque de méningiome. Mis à jour le 7 octobre 2021.
ANSM. Lutényl/Lutéran : des documents pour garantir l’information des femmes sur l’augmentation du risque de méningiome. 2 juillet 2021.