Le lymphome de Hodgkin (2 000 nouveaux cas par an) est l’un des cancers les plus curables. L’adaptation des traitements – chimio- et radiothérapie – aux facteurs pronostiques initiaux a une bonne efficacité et vise à éviter les séquelles à long terme.
C’est un lymphome de bon pronostic, dont la prise en charge reste spécialisée. En témoignent de nombreuses nouveautés apparues durant la dernière décennie concernant les thérapeutiques et l’évaluation de la réponse au traitement. Sur le plan épidémiologique, ce groupe représente 10 % des lymphomes et rassemble 2 entités : le lymphome de Hodgkin (LH) classique, touchant environ 2 000 nouveaux patients en France par an,1 dont 80 à 90 % guérissent, et le LH nodulaire, à prédominance lymphocytaire (ou paragranulome de Poppema-Lennert), beaucoup plus rare, qui évolue vers une guérison dans plus de 95 % des cas. Plusieurs problématiques restent d’actualité et concernent le médecin généraliste, notamment la gestion de la toxicité immédiate de la chimiothérapie et de la radiothérapie ainsi que le suivi des effets à long terme des traitements de première ligne. Enfin, il faut connaître les nouveaux agents utilisés en cas de progression ou de rechute tels que l’anticorps conjugué anti-CD30 (brentuximab védotine), les inhibiteurs de PD-1, ainsi que leurs effets secondaires.
Une classification complexe
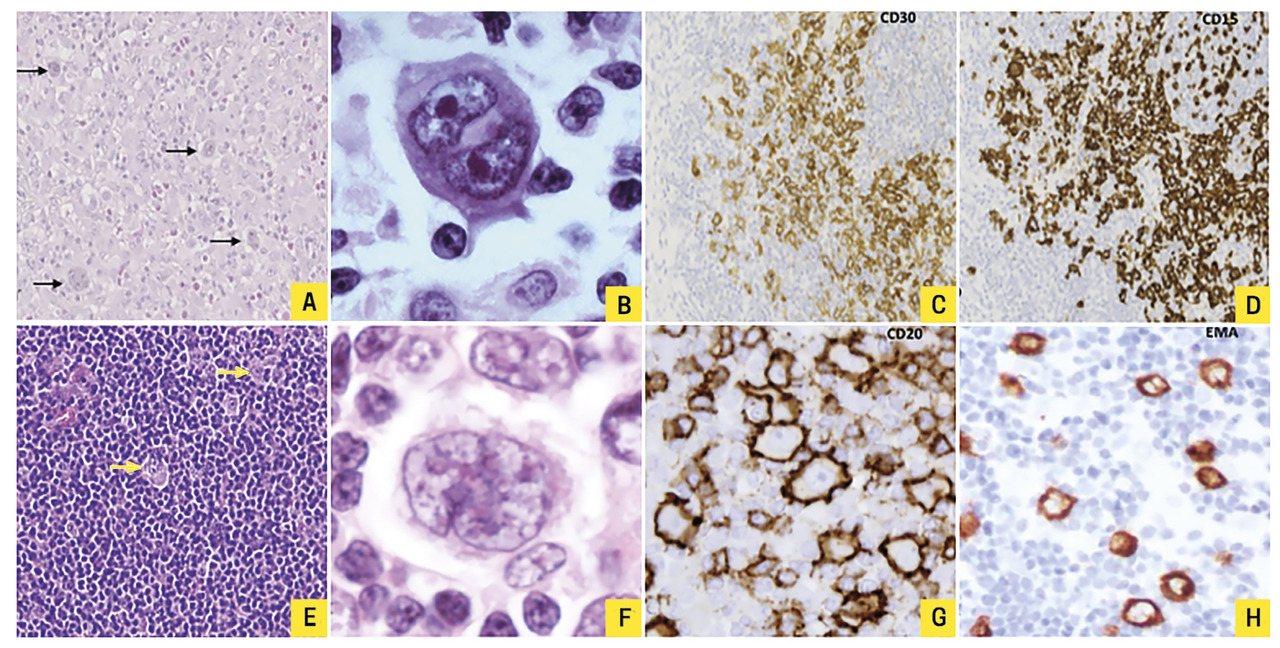
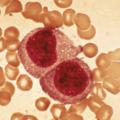
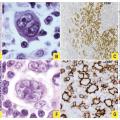
Leur définition est assez technique et spécialisée. La classification internationale2 distingue deux sous-types principaux ayant des critères histopathologiques caractéristiques (fig. 1 ) : le LH classique (plus de 95 % des cas) et le lymphome nodulaire à prédominance lymphocytaire (LHNPL) ou paragranulome de Poppema-Lennert.
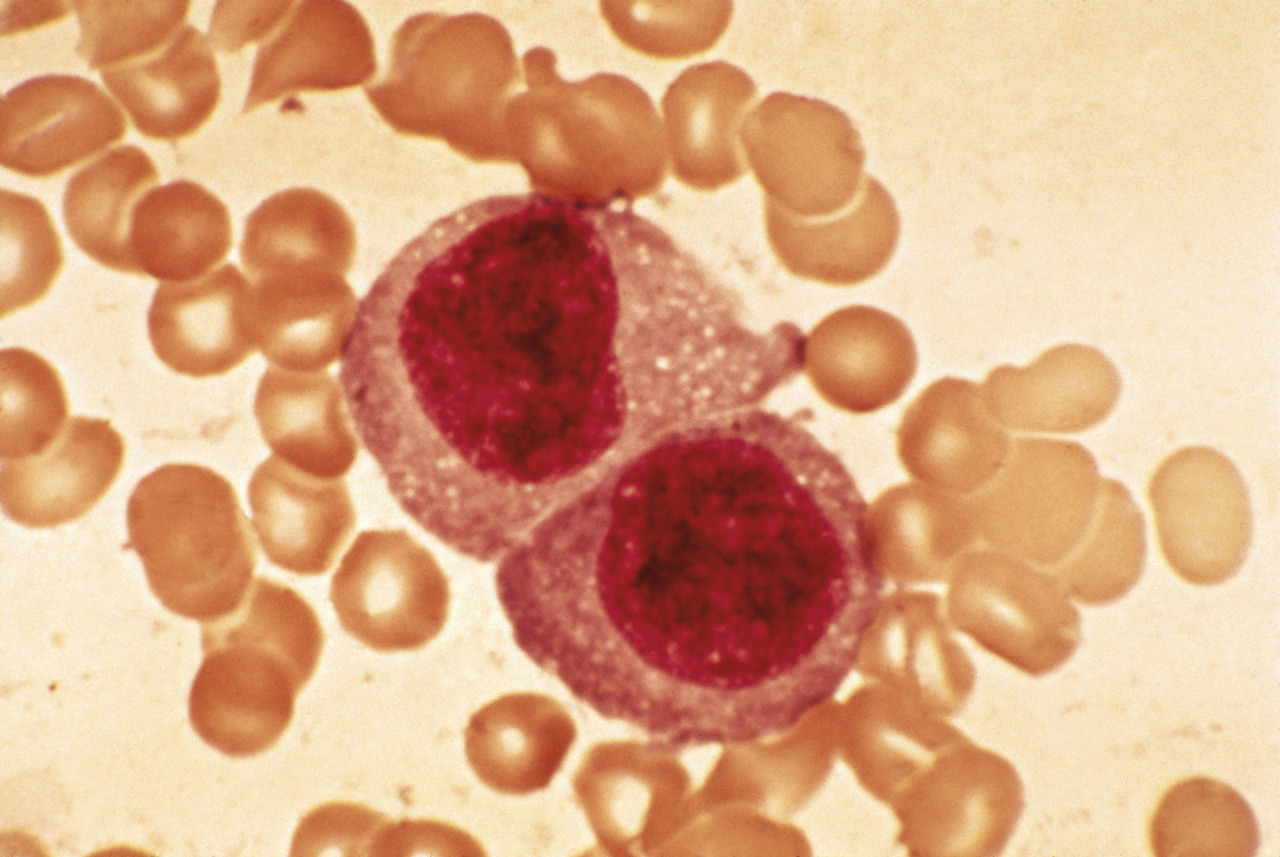
Dans le LH classique, la tumeur est constituée de seulement 1 % de cellules (de Hodgkin et de Reed-Sternberg ; HRS) et 99 % de cellules du micro- environnement (histiocytes, éosinophiles, lymphomes T…). La HRS a une morphologie spécifique : l’immunohistochimie révèle la positivité du CD30 et du CD15 et la négativité du CD20. On distingue différents sous-types histologiques selon la composition du micro-environnement : scléronodulaire (le plus fréquent : 70 % des cas), à cellularité mixte, riche en lymphocytes et à déplétion lymphocytaire.
Dans le LHNPL, le nombre de cellules tumorales est également minoritaire, mais la LP (Lymphocyte Predominant) cell, ou cellule « pop-corn », est différente de la HRS tant par ses aspects cytologiques que phénotypiques (expression de CD45, CD20 et EMA ; absence de CD30 et de CD15).
Dans le LH classique, la tumeur est constituée de seulement 1 % de cellules (de Hodgkin et de Reed-Sternberg ; HRS) et 99 % de cellules du micro- environnement (histiocytes, éosinophiles, lymphomes T…). La HRS a une morphologie spécifique : l’immunohistochimie révèle la positivité du CD30 et du CD15 et la négativité du CD20. On distingue différents sous-types histologiques selon la composition du micro-environnement : scléronodulaire (le plus fréquent : 70 % des cas), à cellularité mixte, riche en lymphocytes et à déplétion lymphocytaire.
Dans le LHNPL, le nombre de cellules tumorales est également minoritaire, mais la LP (Lymphocyte Predominant) cell, ou cellule « pop-corn », est différente de la HRS tant par ses aspects cytologiques que phénotypiques (expression de CD45, CD20 et EMA ; absence de CD30 et de CD15).
Comment faire le diagnostic ?
Tout d’abord, le pic d’incidence, entre 20 et 30 ans, fait de cette maladie le lymphome le plus fréquent avant 40 ans. Par ailleurs, il existe une forme spécifique au sujet plus âgé, autour de 60 ans.
Les patients consultent pour 2 principaux motifs : la découverte d’adénomégalies à l’autopalpation et/ou des signes généraux (amaigrissement, asthénie, fièvre > 38 °C persistante, sueurs nocturnes profuses, prurit). Dans 10 % des cas, les adénomégalies sont douloureuses à l’ingestion d’alcool (mécanisme inconnu).
Dans des formes dites « bulky » (forte masse tumorale), des signes de compression des structures de proximité sont possibles ; par exemple, une localisation média- stinale peut se manifester par une dyspnée, voire une blockpnée ou un syndrome cave supérieur (œdème en pèlerine, turgescences jugulaires, circulation veineuse collatérale, phosphènes, céphalées, acouphènes). Ces symptômes évoluent en général pendant quelques semaines en s’aggravant progressivement, ce qui motive la consultation.
À l’examen, les masses tumorales ganglionnaires superficielles sus-diaphragmatiques peuvent être palpées. Malgré l’absence de caractéristique pathognomonique, elles mesurent souvent plus de 1 cm, sont de consistance ferme, voire dure, mobiles par rapport au plan profond (ce qui les distingue des métastases ganglionnaires des cancers solides) et indolores.
En cas de forte suspicion, il faut demander un avis dans le service d’hématologie de proximité. Une biopsie (à l’aiguille sous échographie ou scanner, ou exérèse chirurgicale) vise à faire le diagnostic de certitude. L’analyse anatomopathologique doit être réalisée par un pathologiste expert en hématologie, compte tenu du risque de confusion avec certains sous-types de lymphomes non hodgkiniens.
Le bilan d’extension (cf. infra) est organisé au mieux en amont pour juger, en accord avec le spécialiste, du site à privilégier pour la biopsie (le plus hypermétabolique à la TEP et dont la localisation est la plus accessible). Enfin, il est impératif de demander une sérologie VIH. Cette infection accroît le risque de LH.
Les patients consultent pour 2 principaux motifs : la découverte d’adénomégalies à l’autopalpation et/ou des signes généraux (amaigrissement, asthénie, fièvre > 38 °C persistante, sueurs nocturnes profuses, prurit). Dans 10 % des cas, les adénomégalies sont douloureuses à l’ingestion d’alcool (mécanisme inconnu).
Dans des formes dites « bulky » (forte masse tumorale), des signes de compression des structures de proximité sont possibles ; par exemple, une localisation média- stinale peut se manifester par une dyspnée, voire une blockpnée ou un syndrome cave supérieur (œdème en pèlerine, turgescences jugulaires, circulation veineuse collatérale, phosphènes, céphalées, acouphènes). Ces symptômes évoluent en général pendant quelques semaines en s’aggravant progressivement, ce qui motive la consultation.
À l’examen, les masses tumorales ganglionnaires superficielles sus-diaphragmatiques peuvent être palpées. Malgré l’absence de caractéristique pathognomonique, elles mesurent souvent plus de 1 cm, sont de consistance ferme, voire dure, mobiles par rapport au plan profond (ce qui les distingue des métastases ganglionnaires des cancers solides) et indolores.
En cas de forte suspicion, il faut demander un avis dans le service d’hématologie de proximité. Une biopsie (à l’aiguille sous échographie ou scanner, ou exérèse chirurgicale) vise à faire le diagnostic de certitude. L’analyse anatomopathologique doit être réalisée par un pathologiste expert en hématologie, compte tenu du risque de confusion avec certains sous-types de lymphomes non hodgkiniens.
Le bilan d’extension (cf. infra) est organisé au mieux en amont pour juger, en accord avec le spécialiste, du site à privilégier pour la biopsie (le plus hypermétabolique à la TEP et dont la localisation est la plus accessible). Enfin, il est impératif de demander une sérologie VIH. Cette infection accroît le risque de LH.
Bilan d’extension
Examen clé, la TEP au 18-fluorodésoxyglucose (FDG) est plus sensible que le scanner pour détecter des localisations ganglionnaires ou extraganglionnaires grâce à l’avidité des cellules tumorales et du micro-environnement pour ce marqueur. Sa sensibilité est aussi supérieure à celle de la ponction-biopsie osseuse, qui n’est plus recommandée (cf. consensus).3
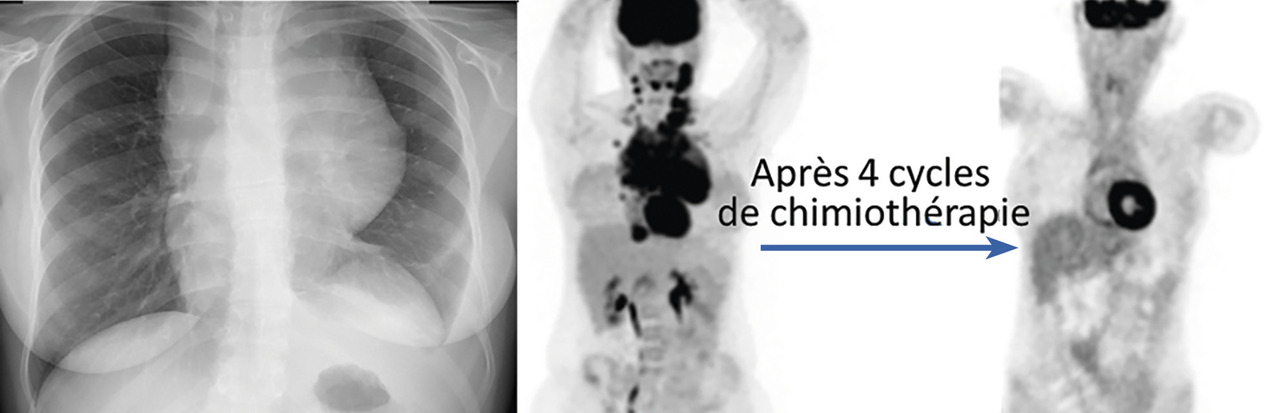
Le scanner cervico-thoraco-abdomino-pelvien en 1re intention authentifie un syndrome tumoral ganglionnaire ou viscéral profond avant la TEP et la biopsie. La radiographie pulmonaire de face est utile pour repérer un éventuel élargissement du médiastin qui traduit un envahissement ganglionnaire (fig. 2 ).
Ces examens permettent d’établir le stade du LH (tableau ) selon la classification d’Ann Arbor : localisé (60 % des cas) pour les stades I-II ou disséminé (40 % des cas) pour les III-IV.
Le scanner cervico-thoraco-abdomino-pelvien en 1re intention authentifie un syndrome tumoral ganglionnaire ou viscéral profond avant la TEP et la biopsie. La radiographie pulmonaire de face est utile pour repérer un éventuel élargissement du médiastin qui traduit un envahissement ganglionnaire (
Ces examens permettent d’établir le stade du LH (
Bilan préthérapeutique
Afin de décider de la meilleure stratégie médicamenteuse, la recherche de comorbidités est cruciale. Ainsi, le bilan biologique standard élimine une insuffisance rénale ou hépatique, l’échographie cardiaque transthoracique apprécie la fraction d’éjection ventriculaire gauche avant l’utilisation d’anthracyclines, pourvoyeuses de cardiomyopathie dilatée.
Les épreuves fonctionnelles respiratoires avec évaluation de la diffusion de l’oxygène sont également nécessaires pour minimiser le risque de fibrose pulmonaire induite par la bléomycine (contre-indiquée en cas de DLCO abaissée, ce qui est souvent associé à un tabagisme sévère).
Enfin, la préservation de la fertilité est essentielle dans cette population le plus souvent en âge de procréer. Elle est proposée de façon systématique en l’absence d’urgence thérapeutique (chez l’homme et la femme), avant l’utilisation de la polychimiothérapie BEACOPP (bléomycine, étoposide, doxorubicine, cyclophosphamide, vincristine, procarbazine, prednisone), connue pour être gonadotoxique.
Les épreuves fonctionnelles respiratoires avec évaluation de la diffusion de l’oxygène sont également nécessaires pour minimiser le risque de fibrose pulmonaire induite par la bléomycine (contre-indiquée en cas de DLCO abaissée, ce qui est souvent associé à un tabagisme sévère).
Enfin, la préservation de la fertilité est essentielle dans cette population le plus souvent en âge de procréer. Elle est proposée de façon systématique en l’absence d’urgence thérapeutique (chez l’homme et la femme), avant l’utilisation de la polychimiothérapie BEACOPP (bléomycine, étoposide, doxorubicine, cyclophosphamide, vincristine, procarbazine, prednisone), connue pour être gonadotoxique.
Traitement de première ligne
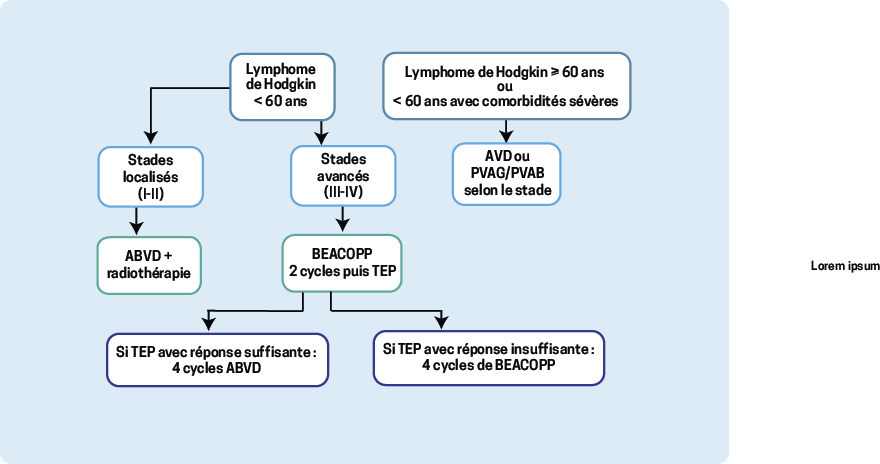
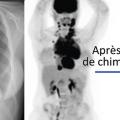
Il dépend de l’âge et du stade de la maladie (localisé ou disséminé). Outre son apport indispensable au diagnostic, la TEP, en particulier après 2 cycles de chimiothérapie, a le plus puissant impact pronostique4 (fig. 3 ) et guide le choix du traitement. L’interprétation de la réponse repose sur des critères internationaux consensuels.3
Stades localisés
Avant 60 ans, on débute par 2 à 4 cycles d’ABVD (doxorubicine, bléomycine, vinblastine, dacarbazine), suivis d’une radiothérapie. Le nombre de cures dépend des facteurs pronostiques initiaux : VS, nombre d’aires ganglionnaires atteintes et rapport médiastino-thoracique (diamètre transverse maximal de la masse sur la radio de thorax de face rapporté au diamètre thoracique au niveau de T5-T6).
En cas de positivité de la TEP après 2 cycles, l’escalade consiste à ajouter 2 cycles de BEACOPP suivis de la radiothérapie. La dose de cette dernière est de 20 ou 30 grays selon le pronostic initial ; les champs utilisés sont limités à l’aire ganglionnaire (involved-field radiotherapy : IFRT) ou aux ganglions atteints initialement (involved-node radiotherapy : INRT).
Afin de diminuer la toxicité, plusieurs essais ont tenté de surseoir à la radiothérapie en cas de TEP négative après 2 cycles d’ABVD, mais cela serait associé à une augmentation significative du risque de rechutes.6 Finalement, la combinaison chimio-radiothérapie permet un meilleur contrôle de la maladie et reste la stratégie standard chez ces patients.
En cas de positivité de la TEP après 2 cycles, l’escalade consiste à ajouter 2 cycles de BEACOPP suivis de la radiothérapie. La dose de cette dernière est de 20 ou 30 grays selon le pronostic initial ; les champs utilisés sont limités à l’aire ganglionnaire (involved-field radiotherapy : IFRT) ou aux ganglions atteints initialement (involved-node radiotherapy : INRT).
Afin de diminuer la toxicité, plusieurs essais ont tenté de surseoir à la radiothérapie en cas de TEP négative après 2 cycles d’ABVD, mais cela serait associé à une augmentation significative du risque de rechutes.6 Finalement, la combinaison chimio-radiothérapie permet un meilleur contrôle de la maladie et reste la stratégie standard chez ces patients.
Stades avancés
L’ABVD a été le traitement standard de ces formes pendant plusieurs décennies. Toutefois, elle est associée à un risque d’échec de près de 25 %. De multiples schémas alternatifs ont été proposés et expérimentés.
Seule la BEACOPP serait une alternative crédible. Cependant, elle génère un excès de toxicité aiguë, notamment hématologique mais aussi à plus long terme sur la fertilité ; le risque accru de leucémie secondaire est également important à connaître.
Selon l’essai AHL 20117 publié en 2019, la TEP guide le traitement : si, après 2 cycles initiaux de BEACOPP, elle est négative (84 % des patients), on peut proposer une « désescalade » avec 4 cycles d’ABVD, alors que les patients TEP positifs poursuivent 4 cycles additionnels de BEACOPP. Cette stratégie fait aussi bien en termes de contrôle de la maladie et de survie que 6 cycles de BEACOPP délivrés sans contrôle de l’imagerie. Sans surprise, son profil de toxicité est plus favorable.
L’impact sur la fertilité est en cours d’étude, mais des données de la littérature suggèrent d’ores et déjà une réduction significative de la gonadotoxicité lorsque le nombre de cures de BEACOPP est réduit à 2 chez les répondeurs précoces, qui sont la grande majorité. Ce traitement guidé par la TEP est la référence dans les formes avancées.
Seule la BEACOPP serait une alternative crédible. Cependant, elle génère un excès de toxicité aiguë, notamment hématologique mais aussi à plus long terme sur la fertilité ; le risque accru de leucémie secondaire est également important à connaître.
Selon l’essai AHL 20117 publié en 2019, la TEP guide le traitement : si, après 2 cycles initiaux de BEACOPP, elle est négative (84 % des patients), on peut proposer une « désescalade » avec 4 cycles d’ABVD, alors que les patients TEP positifs poursuivent 4 cycles additionnels de BEACOPP. Cette stratégie fait aussi bien en termes de contrôle de la maladie et de survie que 6 cycles de BEACOPP délivrés sans contrôle de l’imagerie. Sans surprise, son profil de toxicité est plus favorable.
L’impact sur la fertilité est en cours d’étude, mais des données de la littérature suggèrent d’ores et déjà une réduction significative de la gonadotoxicité lorsque le nombre de cures de BEACOPP est réduit à 2 chez les répondeurs précoces, qui sont la grande majorité. Ce traitement guidé par la TEP est la référence dans les formes avancées.
Patients de plus de 60 ans
En cas de forme localisée, ils reçoivent un traitement semblable à celui des sujets plus jeunes, par chimiothérapie AVD (ABVD sans bléomycine, trop pourvoyeuse de fibrose pulmonaire dans cette classe d’âge). Au stade disséminé, la polychimiothérapie PVAG (prednisone, vinblastine, doxorubicine, gemcitabine) ou PVAB (prednisone, vinblastine, doxorubicine, bendamustine) est privilégiée.8
Cas particulier du LHNPL
La très grande majorité de ces patients ont une forme limitée et requièrent une simple surveillance clinique et scanographique. Une immunothérapie anti-CD20 (rituximab) ou une radiothérapie peut être discutée en cas de faible masse tumorale. Si cette dernière est plus conséquente, une immunochimiothérapie de type R-CHOP est indiquée.
Du nouveau pour les stades avancés
Le brentuximab védotine (Adcetris) est un anti- corps anti-CD30 couplé à un agent de chimiothérapie antimicrotubulaire, entraînant la mort ciblée des cellules ayant le récepteur membranaire CD30, hautement exprimé par la cellule tumorale du LH classique. Il a obtenu l’AMM en France en 2012, et il est utilisé actuellement en cas de rechute, seul ou associé à une chimiothérapie standard. Les tentatives de combinaison à l’ABVD en première ligne, en remplacement de la bléomycine, n’ont pas montré de bénéfice réellement significatif, une étude de phase III ayant suggéré une amélioration limitée de la survie sans progression.9
Les inhibiteurs de PD-1 nivolumab (Opdivo) et pembrolizumab (Keytruda) – anticorps bloquant l’axe PD-1/PD-L1 et donc restaurant la cytotoxicité des cellules immunitaires effectrices – ont obtenu l’AMM en monothérapie. En effet, le PD-L1 étant très exprimé par le LH, ces anticorps monoclonaux ont montré une efficacité spectaculaire10, 11 en rechute après de nombreuses lignes, avec un excellent profil de tolérance. Des taux de réponse autour de 80 % ont été observés chez des patients qui répondaient peu aux chimiothérapies standard (30 %).
En cas de récidive, les chimiothérapies classiques ont encore une place mais de préférence combinées à une immunothérapie. Pour les patients éligibles (< 65 ans sans comorbidités significatives), le traitement de 2e ligne repose sur le brentuximab védotine associé à la chimiothérapie classique, suivie d’une consolidation par autogreffe de cellules souches périphériques dans les rechutes précoces et/ou disséminées.
Les inhibiteurs de PD-1 nivolumab (Opdivo) et pembrolizumab (Keytruda) – anticorps bloquant l’axe PD-1/PD-L1 et donc restaurant la cytotoxicité des cellules immunitaires effectrices – ont obtenu l’AMM en monothérapie. En effet, le PD-L1 étant très exprimé par le LH, ces anticorps monoclonaux ont montré une efficacité spectaculaire10, 11 en rechute après de nombreuses lignes, avec un excellent profil de tolérance. Des taux de réponse autour de 80 % ont été observés chez des patients qui répondaient peu aux chimiothérapies standard (30 %).
En cas de récidive, les chimiothérapies classiques ont encore une place mais de préférence combinées à une immunothérapie. Pour les patients éligibles (< 65 ans sans comorbidités significatives), le traitement de 2e ligne repose sur le brentuximab védotine associé à la chimiothérapie classique, suivie d’une consolidation par autogreffe de cellules souches périphériques dans les rechutes précoces et/ou disséminées.
Suivi post-thérapeutique
L’objectif du traitement est d’obtenir une réponse complète (RC : disparition des localisations ganglionnaires et/ou extraganglionnaires attestée par la TEP) et in fine la guérison. Une fois la phase active terminée et la RC obtenue, le suivi consiste en une consultation tous les 3 mois pendant 2 ans, puis tous les 6 mois durant 3 ans. Il repose quasi exclusivement sur l’examen clinique.
L’imagerie est indiquée en cas de suspicion de rechute sur points d’appel cliniques (scanner, voire TEP).12 Les récidives surviennent dans la très grande majorité des cas dans les 2 ans suivant la 1re ligne. Au-delà de 5 ans, elles sont rares. Le plus souvent, les sujets jeunes reprennent leur travail (mi-temps thérapeutique entre 1 et 3 mois selon les patients, puis à temps complet) dans l’année qui suit le traitement.
L’imagerie est indiquée en cas de suspicion de rechute sur points d’appel cliniques (scanner, voire TEP).12 Les récidives surviennent dans la très grande majorité des cas dans les 2 ans suivant la 1re ligne. Au-delà de 5 ans, elles sont rares. Le plus souvent, les sujets jeunes reprennent leur travail (mi-temps thérapeutique entre 1 et 3 mois selon les patients, puis à temps complet) dans l’année qui suit le traitement.
Rôle du médecin traitant
Outre l’orientation diagnostique initiale, le généraliste a un rôle capital dans le suivi de ces patients, en lien avec le service d’hématologie. Au cours de la phase active, les inter-cures sont souvent émaillées d’une hématoxicité sévère inhérente aux polychimiothérapies (ABVD ou BEACOPP). Ainsi, il doit dépister et intervenir dans des situations variées : support transfusionnel en urgence et/ou par érythropoïétine en cas d’anémie toxique et/ou injections de stimulants de la granulopoïèse pour une neutropénie ; si cette dernière est fébrile : antibiothérapie large spectre en urgence. évidemment, il travaille en collaboration avec le service d’hématologie en charge du patient.
En phase post-thérapeutique, les effets indésirables sont importants à connaître. Il faut savoir dépister une cardiotoxicité parfois à long terme car les patients sont traités par anthracyclines mais reçoivent également une radiothérapie souvent médiastinale dont les champs d’irradiation peuvent intégrer l’aire cardiaque. Par ailleurs, la question de la fertilité est cruciale dans cette population jeune. Un bilan pour évaluer la réserve ovarienne peut être organisé en lien avec le service d’hématologie et celui de procréation médicalement assistée, 6 à 12 mois après la fin du traitement et après confirmation de la RC.
En phase post-thérapeutique, les effets indésirables sont importants à connaître. Il faut savoir dépister une cardiotoxicité parfois à long terme car les patients sont traités par anthracyclines mais reçoivent également une radiothérapie souvent médiastinale dont les champs d’irradiation peuvent intégrer l’aire cardiaque. Par ailleurs, la question de la fertilité est cruciale dans cette population jeune. Un bilan pour évaluer la réserve ovarienne peut être organisé en lien avec le service d’hématologie et celui de procréation médicalement assistée, 6 à 12 mois après la fin du traitement et après confirmation de la RC.
Encadre
Que dire à vos patients ?
En dehors des 20 % associés au virus d’Epsein-Barr (EBV) ou plus rarement au VIH, ces cancers ne sont pas héréditaires, et n’ont pas de cause identifiée. Ainsi, il n’y a pas de mesure de prévention particulière à mettre en place.
Trois sites internet sont utiles pour s’informer sur ces pathologies :
• LYSA (The LYmphoma Study Association, groupe coopérateur franco-belge) : www.lysa-lymphoma.org ;
• Lymphomacare, site à destination des patients et des soignants non hématologistes : www.lymphoma-care.fr ;
• France Lymphome Espoir, association nationale de patients : www.francelymphomeespoir.fr.
Références
1. Le Guyader-Peyrou, Delossez G, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 2 – Hémopathies malignes. Étude à partir des registres des cancers du réseau Francim. Santé Publique France 2019. https://bit.ly/2Nr1WR8
2. Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the Word Health Organization classification of lymphoid neoplasms. Blood 2016;127:2375‑90.
3. Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32:3048‑58.
4. Gallamini A, Hutchings M, Rigacci L, et al. Early Interim 2-[18 F]fluoro- 2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin’s lymphoma: a report from a joint Italian-Danish study. J Clin Oncol 2007;25:3746‑52.
5. Lister TA, Crowther D, Sutcliffe SB, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J Clin Oncol 1989;7:1630‑6.
6. Johnson P, Federico M, Kirkwood A, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med 2016;374:2419‑29.
7. Casasnovas RO, Bouabdallah R, Brice P, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20:202‑15.
8. Ghesquieres H, Casasnovas O, Nicolas-Virelizier E, et al. Prednisone, Vinblastine, Doxorubicin and Bendamustine (PVAB) Regimen in First Line Therapy for Older Patients with Advanced-Stage Classical Hodgkin Lymphoma: Results of a Prospective Multicenter Phase II Trial of the Lymphoma Study Association (LYSA). Blood 2019;134(Suppl 1):2832.
9. Connors JM, Jurczak W, Straus DJ, et al. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med 2018;378:331‑44.
10. Armand P, Engert A, Younes A, et al. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol 2018;36:1428‑39.
11. Chen R, Zinzani PL, Fanale MA, et al. Phase II Study of the Efficacy and Safety of Pembrolizumab for Relapsed/Refractory Classic Hodgkin Lymphoma. J Clin Oncol 2017;35:2125‑32.
12. Rossi C, Casasnovas O. Imagerie médicale avant, pendant et après le traitement du lymphome de Hodgkin. Horizons Hémato 2018;8(1)-mars.
2. Swerdlow SH, Campo E, Pileri SA, et al. The 2016 revision of the Word Health Organization classification of lymphoid neoplasms. Blood 2016;127:2375‑90.
3. Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32:3048‑58.
4. Gallamini A, Hutchings M, Rigacci L, et al. Early Interim 2-[18 F]fluoro- 2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin’s lymphoma: a report from a joint Italian-Danish study. J Clin Oncol 2007;25:3746‑52.
5. Lister TA, Crowther D, Sutcliffe SB, et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J Clin Oncol 1989;7:1630‑6.
6. Johnson P, Federico M, Kirkwood A, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med 2016;374:2419‑29.
7. Casasnovas RO, Bouabdallah R, Brice P, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma (AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol 2019;20:202‑15.
8. Ghesquieres H, Casasnovas O, Nicolas-Virelizier E, et al. Prednisone, Vinblastine, Doxorubicin and Bendamustine (PVAB) Regimen in First Line Therapy for Older Patients with Advanced-Stage Classical Hodgkin Lymphoma: Results of a Prospective Multicenter Phase II Trial of the Lymphoma Study Association (LYSA). Blood 2019;134(Suppl 1):2832.
9. Connors JM, Jurczak W, Straus DJ, et al. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med 2018;378:331‑44.
10. Armand P, Engert A, Younes A, et al. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol 2018;36:1428‑39.
11. Chen R, Zinzani PL, Fanale MA, et al. Phase II Study of the Efficacy and Safety of Pembrolizumab for Relapsed/Refractory Classic Hodgkin Lymphoma. J Clin Oncol 2017;35:2125‑32.
12. Rossi C, Casasnovas O. Imagerie médicale avant, pendant et après le traitement du lymphome de Hodgkin. Horizons Hémato 2018;8(1)-mars.

 Encadrés
Encadrés