Les lymphomes non hodgkiniens (LNH) sont les cancers les plus fréquents en hématologie et chez les immunodéprimés. Les formes sont multiples, avec des prises en charge et des pronostics très différents. De nouvelles pistes thérapeutiques laissent présager des progrès remarquables dans les années à venir.
Hémopathies malignes les plus fréquentes, les LNH comprennent un ensemble disparate de multiples cancers ayant pour point commun une prolifération clonale de lymphocytes (
Enfin, la leucémie lymphoïde chronique (LLC) est une prolifération de lymphocytes matures dont les caractéristiques sont bien particulières avec, par définition, plus de 5 000 cellules circulantes anormales par mm3 ; lorsqu’il y a des adénopathies mais que ce seuil n’est pas atteint, on parle de lymphome lymphocytique (LL). Là encore, les traitements et le pronostic sont identiques à ceux de la LLC. Lymphomes lymphoblastiques et LL ne sont pas abordés dans ce dossier. Le terme « non hodgkinien » est historique : il exclut, comme son nom l’indique, les lymphomes de Hodgkin, anciennement appelés maladie de Hodgkin.
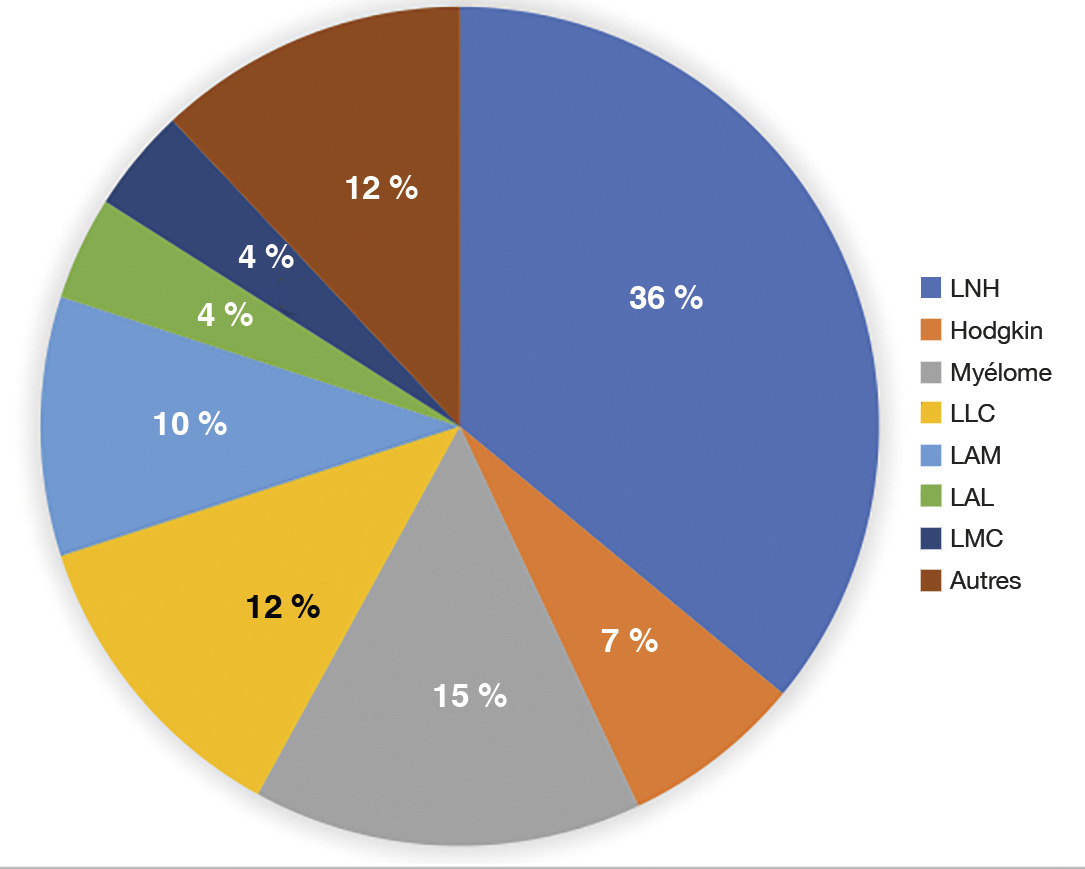
Les LNH, 7e type de cancer en France, ont une incidence de 15/100 000 habitants. Sex ratio à peu près équilibré. âge au diagnostic autour de 60 ans. Hors immunodépression et cas familiaux, pas de facteurs de risque.
Comment faire le diagnostic ?
Manifestations cliniques
Les adénopathies palpables sont un signe évocateur classique. Les ganglions sont habituellement mobiles, indolores et non inflammatoires ; ils peuvent être unilatéraux. Une croissance rapide fait suspecter un lymphome agressif. Selon la localisation, les symptômes sont variables : douleurs, occlusion, troubles neurologiques…
Les signes généraux sont le plus souvent associés aux formes agressives ; ceux appelés « B », selon la classification d’Ann Arbor (
Bilan biologique
Le passage sanguin des lymphocytes du LNH est rare et limité le plus souvent aux lymphomes de bas grade comme la maladie de Waldenström (MW), le LNH de la zone marginale (LZM), folliculaire mais aussi à cellules du manteau (LCM). Lorsque des cellules circulent, l’orientation diagnostique est rapide, à l’aide de la cytologie et de l’immunophénotypage sanguin. Le reste de la numération n’est en général pas affecté.
Les autres anomalies biologiques sont assez limitées : un taux élevé de LDH est un marqueur de LNH agressif ; l’électrophorèse des protides sériques peut montrer un pic monoclonal dans les formes indolentes (il fait partie du diagnostic de la MW).
Dans certains cas, les LNH sont révélés par un syndrome d’activation macrophagique (
Le bilan de débrouillage doit comporter : NFS, électrophorèse des protides sériques, LDH, bilan hépatique, fonction rénale, sérologies VIH et VHC.
Imagerie
Que ce soit l’échographie ou le scanner, elle est reine dans ce domaine, les lymphomes étant le plus souvent non palpables. L’IRM est plus sensible pour les localisations intracérébrales. Le TEP-scanner est à réserver au bilan d’extension, mais il peut être utile lorsque le scanner ne trouve pas de tumeur, ou lorsque l’on suspecte la transformation d’une LLC en lymphome agressif. C’est le syndrome de Richter, complication redoutée (10 % des LLC), évoqué sur des signes B (encadré 1), une altération de l’état général, une augmentation rapide du volume d’une adénopathie...
Les lymphomes prennent les produits de contraste comme l’iode ou le gadolinium, mais la prise du FDG lors des TEP-scanner est variable.
Diagnostic formel
Il repose sur la biopsie. Obligatoire, Elle est réalisée classiquement par un chirurgien ou un radiologue (guidée par l’imagerie). La seconde méthode est en général préférée par les cliniciens et les patients : rapide, sans cicatrice, elle ne requiert pas une hospitalisation mais juste une courte surveillance. La biopsie chirurgicale, privilégiée par les anatomopathologistes car elle fournit plus de matériel, est parfois nécessaire lorsque l’analyse histologique ne peut conclure après biopsie radioguidée ou si la localisation est trop risquée pour le radiologue.
Une classification complexe
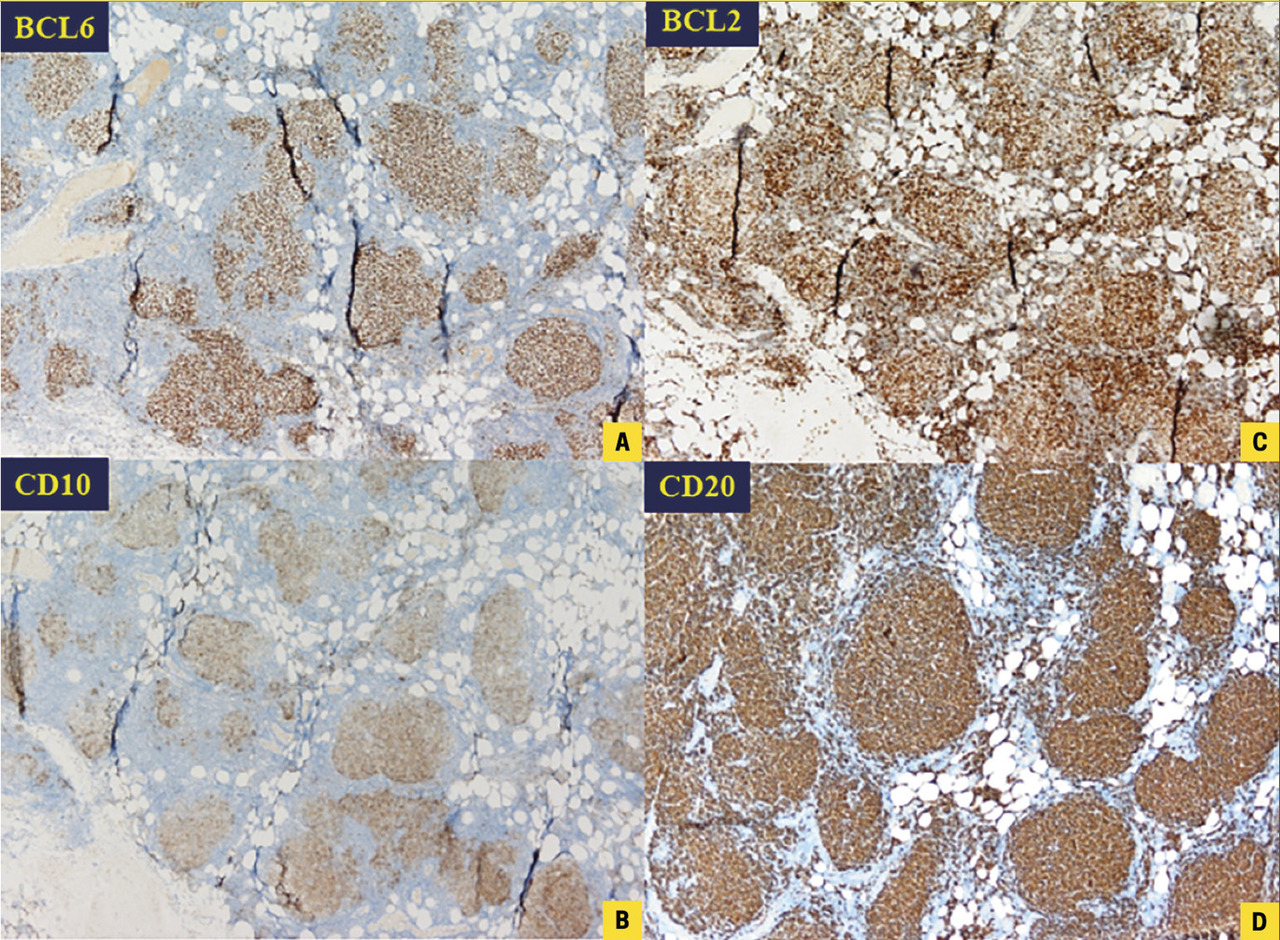
Pour que toutes les études puissent être effectuées, la biopsie est analysée par 3 spécialistes : un échantillon « frais » est adressé au cytogénéticien, une partie fixée est lue et traitée par l’anatomopathologiste et une portion congelée sert au biologiste moléculaire. Utilisant des anticorps fluorescents, l’anatomopathologiste effectue un immunomarquage, qui oriente le travail des cytogénéticiens et biologistes (
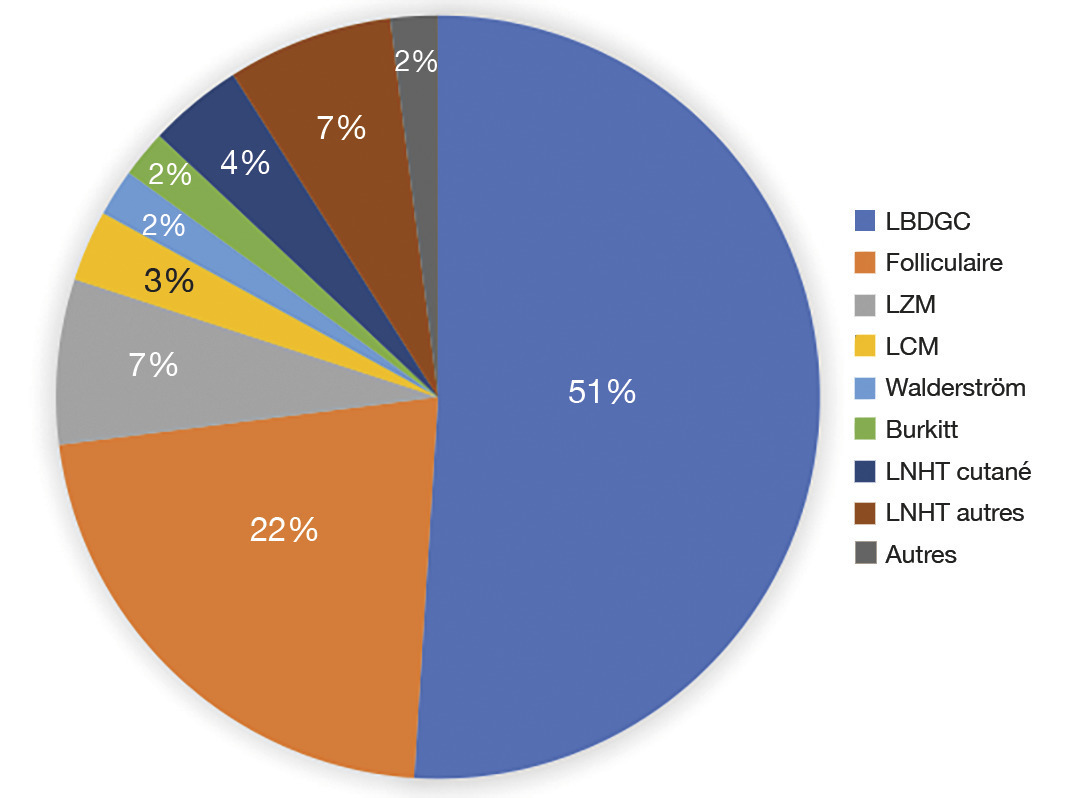
L’OMS publie régulièrement une classification des lymphomes, la dernière date de 2016. Ces entités sont multiples et de fréquence très variable (
Les LNH agressifs comprennent les LNH B diffus à grandes cellules (LBDGC), le LNH de Burkitt, les lymphomes à cellules du manteau (LCM) et les LNH T.
Font partie des formes indolentes : les LNH folliculaires, les LZM (zone marginale), les LNH lymphoplasmocytaires dont le plus fréquent est la maladie de Waldenström, les LNH T cutanés et le LNH lymphocytique. L’OMS distingue également des entités particulières : le LNH du système nerveux central ou du patient vivant avec le VIH et les lymphoproliférations post-transplantation.
Que faire avant de traiter ?
Le bilan d’extension doit comporter au minimum une imagerie, qui varie selon le type de LNH : TEP-scanner pour les agressifs et les folliculaires, scanner thoraco-abdomino-pelvien pour les autres. La biopsie ostéomédullaire est recommandée dans les formes agressives, mais de moins en moins pratiquée dans les LBDGC si le TEP-scanner est effectué (
Les divers stades d’extension anatomique des LNH sont décrits par la classification d’Ann Arbor (
Chez l’homme, après la puberté, un prélèvement de sperme doit être proposé et adressé au CECOS. La préservation de la fertilité féminine (prélèvement d’une partie ou d’un ovaire entier pour congélation) est envisagée avant des traitements lourds comme les greffes.
Afin de rechercher des contre-indications éventuelles ou évaluer la nécessité d’adaptations de dose, bilan hépatique et estimation de la fonction rénale sont nécessaires.
Si les anthracyclines sont indiquées, l’échographie cardiaque est obligatoire au préalable.
Avant d’initier le rituximab (MabThera), une sérologie VHB est prescrite, en raison du risque de réactivation virale.
Un dépistage du VIH est également réalisé, l’infection augmentant le risque de LNH agressif.
La sérologie VHC est obligatoire en cas de LNH de la zone marginale car ce virus en est parfois la cause.
Traiter ou non ?
Tous les LNH n’ont pas besoin d’être traités, notamment ceux de bas grade, en revanche les agressifs le sont tous, même en cas de localisation limitée, comme les stades 1.
Dans la majorité des cas, on prescrit en première ligne le CHOP, associant le cyclophosphamide, une moutarde azotée (créant des liaisons covalentes au sein de l’ADN, entre les guanines), l’hydroxyadriamycine (une anthracycline s’intercalant entre les bases de l’ADN), la vincristine (Oncovin), un poison du fuseau, et la prednisone. Dans certains lymphomes de bas grade, cette combinaison peut être remplacée par la bendamustine, molécule associant une moutarde azotée et un analogue de base de l’ADN. Certains lymphomes ont toutefois des traitements spécifiques.
Le rituximab, un anti-CD20, a révolutionné la prise en charge des LNH B. Il est associé à quasiment toutes les chimiothérapies indiquées en première ligne (R-CHOP, R-bendamustine…). Il n’y a pas encore d’anticorps monoclonal disponible pour les LNH T en première intention.
Ces traitements induisent des aplasies de courte durée, entre le 7e et le 12e jour, pouvant favoriser des infections. Une aplasie fébrile – définie par une température > 38,3 °C ou 2 épisodes > 38 °C à plus de 1 heure d’intervalle – impose une antibiothérapie rapide, et l’avis de l’hématologue en charge du patient, qui décide si une hospitalisation est nécessaire ou si les antibiotiques peuvent être pris à domicile. En général, le G-CSF (facteur stimulant les granulocytes) est utilisé systématiquement après les traitements de LNH (quels que soient le type de lymphome et de chimiothérapie).
En dehors des infections, les toxicités hématologiques peuvent nécessiter des transfusions, avec des seuils le plus souvent à 8 g/dL d’hémoglobine pour les globules rouges et 20 000/mm3 pour les plaquettes. L’érythropoïétine, souvent utilisée en cas d’anémie, doit toutefois être arrêtée au-dessus de 12 g/dL.
La vincristine a des effets secondaires neurologiques périphériques bien connus : paresthésies distales, constipation. La bendamustine, étant très lymphopéniante, augmente le risque infectieux opportuniste : il faut prévenir la pneumocystose et le zona (Bactrim + valaciclovir).
Enfin, le rituximab a une très bonne tolérance, malgré de possibles réactions d’allure allergique lors de la première cure mais très rarement lors des suivantes.
Traitements de deuxième ligne
En cas de récidive ou de tumeur réfractaire (LNH R/R), les options sont nombreuses : autogreffe ou allo-greffe de cellules souches hématopoïétiques, anticorps et dérivés (obinutuzumab, Gazyvaro), thérapies ciblées (ibrutinib, inhibiteur de la tyrosine kinase de Bruton, pour les LCM et les MW ; idélalisib, Zydelig, inhibiteur de la PI3K, pour les LNH folliculaires) ; immunomodulateurs (lénalidomide, Revlimid, pour les LCM et les LNH folliculaires ; les inhibiteurs de PD-1 étant pour l’instant réservés au lymphome de Hodgkin).
Les lymphocytes T avec récepteur à l’antigène chimérique (CAR-T cells)sont actuellement disponibles pour le traitement des LBDGC à partir de la troisième ligne.
Lymphomes particuliers
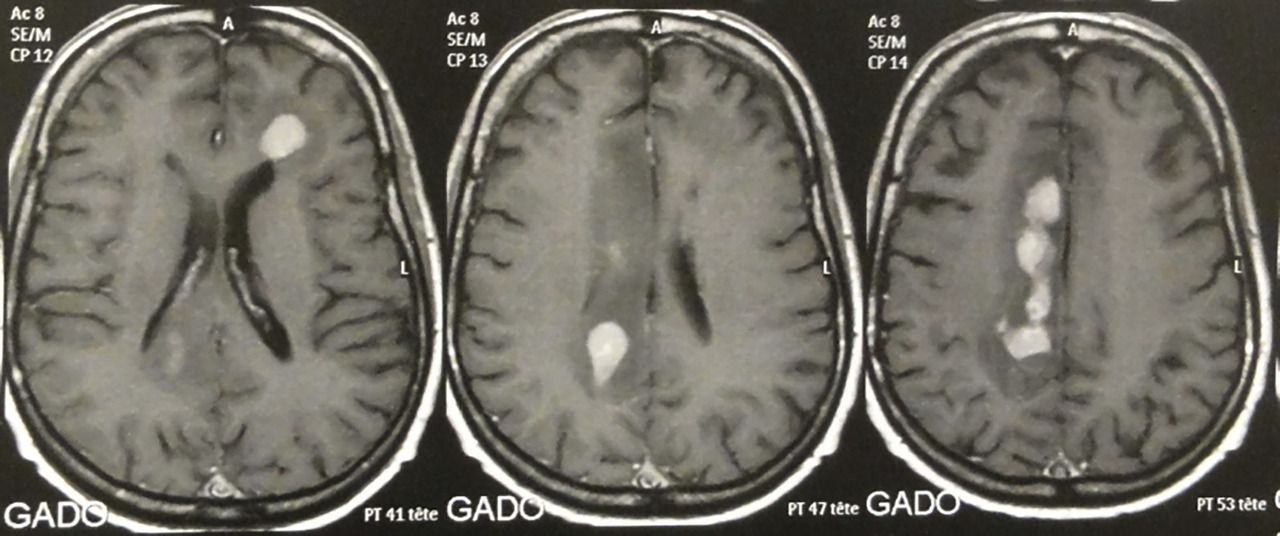
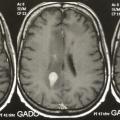
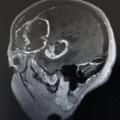
Les LNH du système nerveux central (SNC) représentent environ 1 % des LNH chez les patients immunocompétents. Ils touchent le parenchyme cérébral, le liquide céphalorachidien (méningite lymphomateuse) et l’œil. Ainsi, le bilan doit systématiquement comporter, en plus du TEP-scanner, une IRM cérébrale, une ponction lombaire (PL) en l’absence de contre-indication, et un examen ophtalmologique. Ils ont rarement une localisation systémique (hors SNC) associée.
Sur l’IRM, les lésions lymphomateuses prennent le gadolinium et se situent le plus souvent près des ventricules (
Le traitement, spécifique, doit franchir la barrière hémato-encéphalique : il est à base de méthotrexate à forte dose associé à des chimiothérapies (variables selon les protocoles).
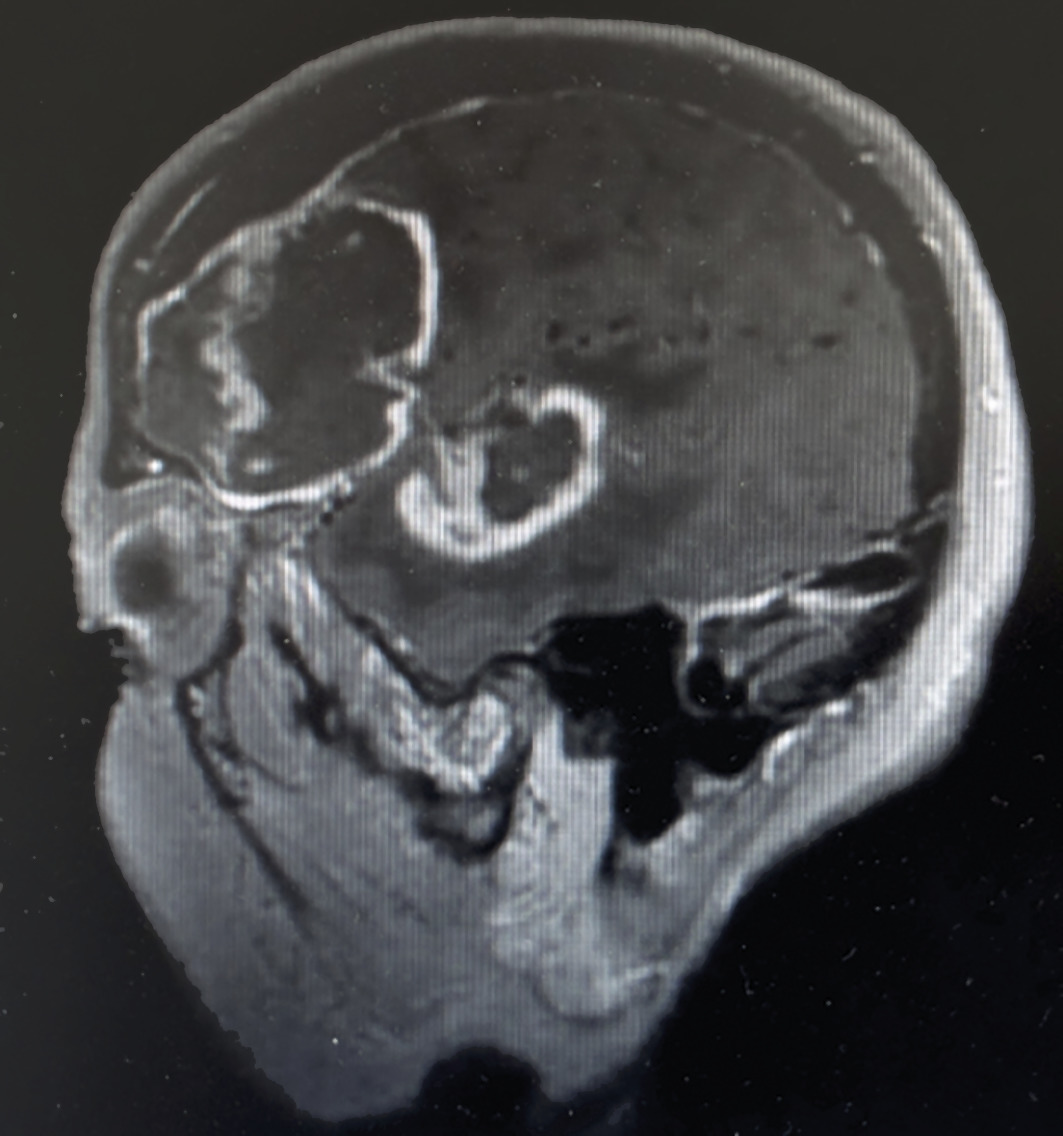
Chez les immunodéprimés (transplantés ou infectés par le VIH), les LNH sont l’un des cancers les plus fréquents. Il s’agit volontiers de formes agressives. On observe jusqu’à 10 % de LNH du SNC, avec des aspects spécifiques en cocarde, similaires à ceux retrouvés lors des toxoplasmoses (
Le traitement des LNH du sujet vivant avec le VIH doit être, si possible, similaire à celui des patients immunocompétents.
Pour les lymphoproliférations post-transplantation, l’attitude est totalement différente : baisse de l’immunosuppression (à discuter avec l’équipe de greffe), puis rituximab en monothérapie, ce qui permet d’obtenir une rémission complète dans 25 à 30 % des cas ; dans les autres situations, on poursuit le protocole R-CHOP classique.
Quel pronostic ?
En raison de la grande diversité des lymphomes, les évolutions sont très variables.
Les LBDGC sont de bon pronostic, avec un taux de guérison aux alentours de 70 % ; la fréquence de rechute après 2 ans est très faible.
Les LCM ont un taux élevé de réponse, mais les récidives tardives sont fréquentes.
Les LNH T sont de mauvais pronostic, avec 30 % de guérisons. Les LNH de Burkitt, très agressifs, guérissent dans 90 % des cas.
Enfin, les LNH indolents, qui n’ont pas toujours besoin d’être traités, ont un taux de rémission complète élevé mais rechutent presque toujours au bout de quelques années ; leur pronostic à long terme reste très bon.
1. Classification d’Ann Arbor
Stade I : atteinte d’une seule aire ganglionnaire
Stade II : plusieurs aires ganglionnaires du même côté du diaphragme
Stade III : aires ganglionnaires des deux côtés du diaphragme
Stade IV : au moins une localisation extraganglionnaire
A : aucun signe B
B : au moins un signe B (fièvre, sueurs profuses, perte de plus de 10 % du poids)
La rate et les amygdales sont considérées comme des aires ganglionnaires
Le sigle E peut être accolé aux stades I à III dans 2 situations :
a) E comme « extension » : localisations extraganglionnaires mais dues à l’extension de ganglions dans des tissus contigus (p. ex. : ganglion du hile hépatique envahissant le foie)
b) E comme « extraganglionnaire ». Cela ne peut être dans ce cas qu’un stade IE : une seule localisation tumorale extraganglionnaire et limitée (p. ex. : une tumeur pulmonaire). L’atteinte de la moelle osseuse, même comme seule localisation, est considérée comme un stade IV car diffuse
Par ex : atteinte de la rate, de ganglions inguinaux et du hile hépatique avec envahissement du foie, présence de sueurs profuses : stade IIEB
2. Syndrome d’activation macrophagique : un signe d’alerte
Le syndrome d’activation macrophagique (SAM), encore appelé hémophagocytose, est la conséquence d’une activation anormale et excessive des macrophages. Il survient dans les sepsis sévères, certaines infections virales, de rares déficits immunitaires congénitaux et surtout à l’occasion de lymphomes hodgkiniens ou non hodgkiniens. Selon The Histiocyte Society, le diagnostic repose sur 5 critères parmi les 8 suivants :
1. fièvre
2. splénomégalie
3. cytopénies sur au moins 2 lignées (hémoglobine, plaquettes, neutrophiles)
4. triglycérides ≥ 26 mg/mL ou fibrinogénémie ≤ 1,5 g/L
5. ferritine ≥ 500 ng/mL
6. hémophagocytose sur biopsie
7. activité NK cytotoxique faible ou nulle
8. rIL-2 (récepteur de l’IL-2 = CD25) ≥ 2400 U/mL dans le sang
Une autre façon d’établir la probabilité d’un SAM est de calculer le score H en ligne à partir de 12 paramètres (https://bit.ly/2YHA7cH ; Fardet L, Galicier L, Lambotte O, et al. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol 2014;66:2613-20)
3. Le TEP-scanner dans tous ses états
La tomographie par émission de positrons, ou positons, associée au scanner, ou TEP-scanner, est le terme français pour PET-scanner. Le positon est une particule positive émise après la désintégration d’un neutron (en un positon et un électron).
Principe de la technique
Les positrons expulsés entrent en collision avec les électrons en rotation autour de l’atome, provoquant l’émission d’un photon qui sera détecté par le tomographe. L’intensité des photons émis – fonction du nombre d’atomes émettant des positrons – est quantifiée, et la source localisée par le tomographe en rotation autour du corps.
Choix du marqueur
Pour être utile dans l’évaluation des LNH, la molécule cible doit être consommée par les cellules en division, d’où le choix du glucose. Le radionucléide doit avoir une instabilité bêta et une demi-vie suffisamment longue (pour pouvoir effectuer l’examen) et assez courte pour ne pas irradier l’entourage. Le marqueur le plus utilisé est le FDG (18F-fluorodésoxyglucose), dont la demi-vie est de près de 2 heures.
Indications
Les LNH bénéficiant du TEP-scanner sont les LNH agressifs et le folliculaire. Cet examen est particulièrement utile en cas de suspicion de transformation d’un LNH de bas grade ou d’une LLC. En hématologie, le myélome multiple est également une excellente indication (suivre les lésions osseuses et localiser les plasmocytomes).
– Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: WHO; 2017: 585 pp.

 Encadrés
Encadrés