Maladie de Parkinson : quoi de neuf au niveau diagnostique ?
Le diagnostic est purement clinique, évoqué devant une symptomatologie associant bradykinésie + rigidité + tremblement de repos (inconstant), ou troubles de la marche. Si le tremblement est un signe bien connu en médecine générale (même s’il est inconstant), un des modes de révélation les plus fréquents est la douleur à l’épaule, confondue souvent avec une anomalie mécanique.
Les examens complémentaires n’ont pas de place en MG. L’imagerie fonctionnelle comme le DaTscan (marquage des terminaisons dopaminergiques par imagerie nucléaire), de plus en plus prescrite, n’est pas justifiée, car inutile et très coûteuse : elle est réservée aux neurologues en cas de doute diagnostique.
Y a-t-il des nouveautés dans la prise en charge de la MP ?
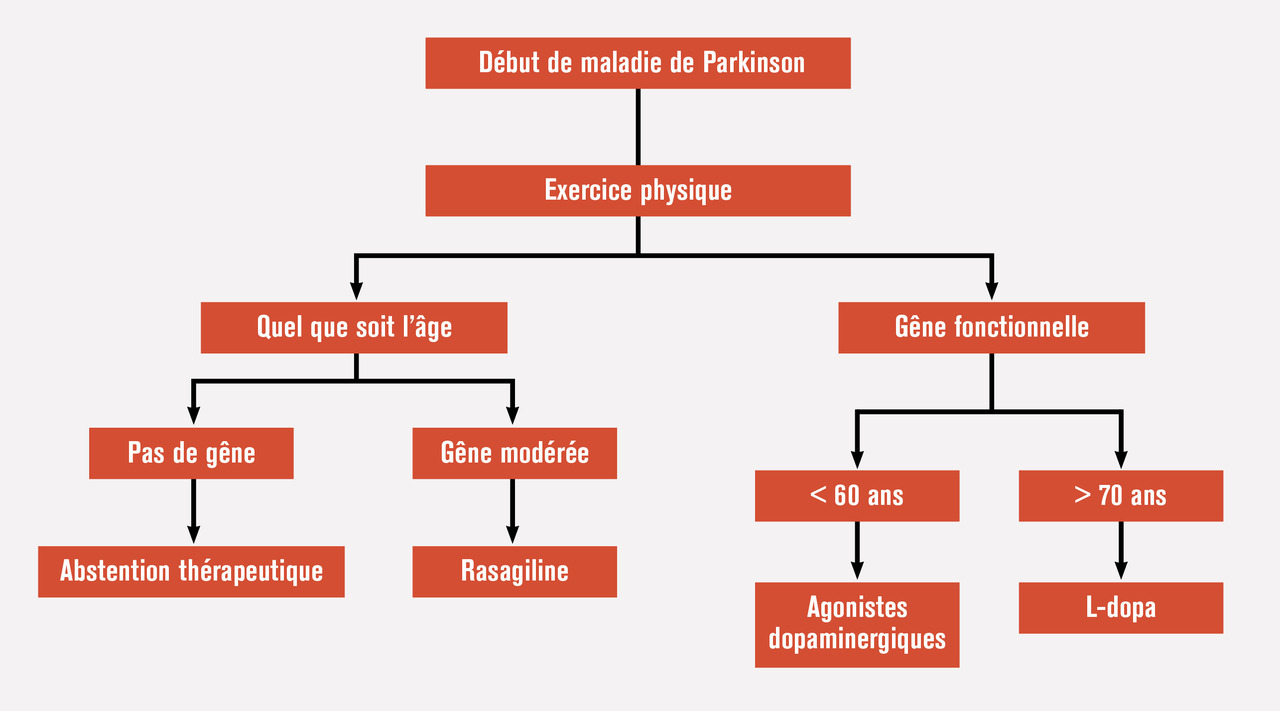
La prise en charge est complexe en raison de la grande variété des signes de la maladie, à la fois moteurs et non moteurs. Le traitement doit prendre en compte ces manifestations hétérogènes mais aussi les risques d’effets secondaires et doit s’adapter à l’évolution de la maladie. Le traitement initial, décidé lorsqu’une gêne apparaît, repose toujours sur les agonistes dopaminergiques et/ou la L-dopa (figure 1).
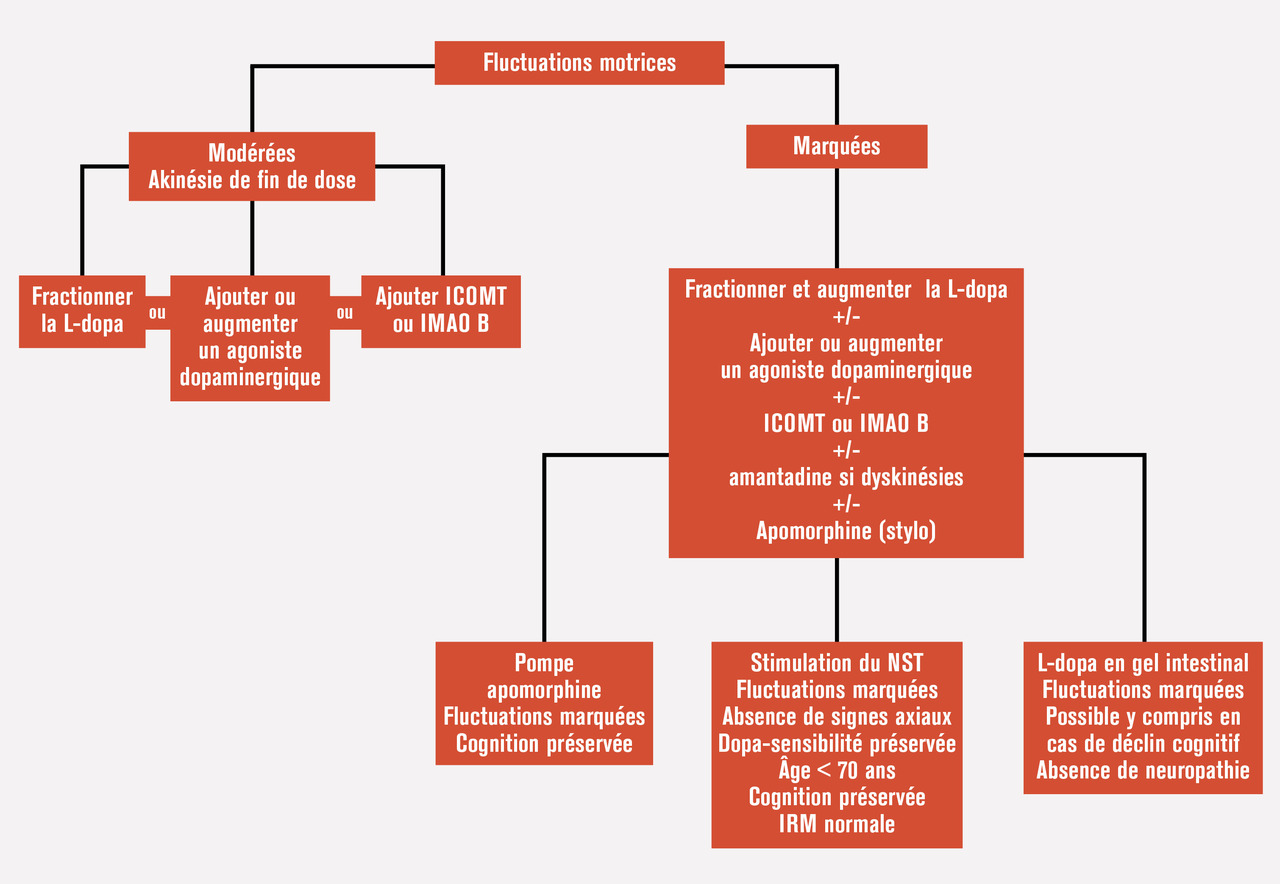
Ensuite, au stade des fluctuations motrices (figure 2), la première stratégie est l’optimisation de la dopathérapie (fractionner les prises de L-dopa sur la journée, ajouter une prise de L-dopa à libération prolongée pour la nuit ; ajouter un inhibiteur de la cathécol-O-méthyltransférase ou de la monoamine oxydase B).
En cas de dyskinésies invalidantes, l’amantadine a aujourd’hui bien prouvé son efficacité malgré certains effets indésirables (hypotension, hallucinations, livedo). Les périodes « off » de survenue brutale ou les dystonies douloureuses peuvent bénéficier d’injections sous-cutanées discontinues d’apomorphine (stylo). Enfin, lorsque les fluctuations motrices deviennent difficiles à gérer, les thérapies « de recours » ont une place : les pompes sous-cutanées à apomorphine (à passer sur 12 à 24 heures) ou, mise à disposition plus récemment, la dopamine en gel administrée au moyen d’une pompe jéjunale (gel intestinal de L-dopa). Chez les sujets remplissant des critères bien définis, la stimulation cérébrale profonde peut être proposée.
Le traitement est prescrit par les neurologues mais les généralistes ne doivent pas hésiter à renouveler l’ordonnance dans l’attente du rendez-vous suivant, voire à l’adapter selon les indications du neurologue.
Les signes non moteurs sont particulièrement difficiles à gérer : quelles sont les erreurs à ne pas commettre en MG ?
Les symptômes non moteurs forment des tableaux polymorphes, altérant fortement la qualité de vie des malades : dépression, hypersialorrhée, troubles vésico-sphinctériens (nycturie, urgences mictionnelles…), douleurs…
En MG, il faut savoir que la constipation touche 60 % des patients parkinsoniens (alors qu’on la rencontre dans 20 à 30 % de la population générale) : il est important de la traiter avec des mesures hygiéno-diététiques et si besoin d’un laxatif oral qui doit alors être pris tous les jours.
Quant aux douleurs, présentes chez 30 à 80 % des patients, elles peuvent être de différentes natures, même chez un patient donné : elles doivent être bien caractérisées pour optimiser leur prise en charge. Il faut notamment distinguer les douleurs musculosquelettiques (douleurs articulaires – scapulaires, lombaires ou cervicales – arthrosiques, par exemple), qui répondent aux traitements antalgiques, de celles liées aux contractures douloureuses dues à l’hypertonie liée à la maladie ou aux dystonies apparaissant au cours des phases « off », qui requièrent, quant à elles, une adaptation du traitement antiparkinsonien.
Attention à la prescription d’hypertenseurs (ou la suppression d’antihypotenseurs) : de nombreux parkinsoniens et en particulier ceux ayant des formes atypiques souffrent d’hypotension orthostatique sévère, qui peut être responsable des lipothymies et des chutes traumatiques. La prise en charge de l’HTA passe au 2e plan chez ces patients dont l’espérance de vie est limitée surtout en cas de syndromes parkinsoniens atypiques.
Autre point important : éviter, chez les malades âgés, les médicaments anticholinergiques (antidépresseurs tricycliques par exemple), qui sont à risque de déclencher des effets indésirables notamment cognitifs (confusion +++) et de la rétention urinaire.
Quel est le rôle de l’activité physique ?
L’activité physique est un traitement à part entière de la MP, dès le diagnostic de la maladie. Elle a pour objectif d’améliorer les manifestations cliniques motrices et non motrices mais aussi, à plus long terme, de modifier la neuroplasticité et l’évolution au long cours ; elle améliore également les fonctions cardiorespiratoires. Au stade initial, on préconise des activités physiques/sportives en dehors des circuits médicalisés (« coaching », APA…), alors qu’à un stade plus évolué la kinésithérapie devient indispensable. Une activité régulière, d’environ 30 minutes par jour, a fait ses preuves. Quant à l’activité intense (> 2 h par jour), les résultats sont bons sur le plan physique mais les effets sur l’évolution de la maladie encore controversés.
De nouvelles approches émergent actuellement : l’utilisation de la réalité virtuelle pour rééduquer de façon ciblée la locomotion (en produisant par exemple des obstacles pour rééduquer le freezing), ou des techniques dites d’exergaming (jeux commerciaux Nintendo Wii fit platform) pour travailler la vitesse des mouvements, l’adaptation à l’environnement…
Quelles perspectives thérapeutiques ?
Dans les formes évoluées de la MP, de nouveaux traitements sont en développement : formes sublinguales d’apomorphine ou inhalées de L-dopa, nouvelles pompes. Une pompe délivrant la dopa en sous-cutané devrait remplacer bientôt celle par voie jéjunale, en améliorant sa tolérance (la pompe jéjunale est associée à des effets indésirables non négligeables : douleur, problème de matériels, infection locale, changements de sondes fréquents).
Une modulation pharmacologique d’autres systèmes de neurotransmetteurs non dopaminergiques est étudiée pour viser les symptômes moteurs (antagonistes des récepteurs A2A de l’adénosine par exemple).
Les travaux qui suscitent le plus d’espoir concernent les traitements « disease-modifier » ou neuroprotecteurs, avec de nombreux candidats potentiels (anticorps alpha-synucléine, modulateur de l’insuline, régulateur des gènes impliqués dans la MP, chélateurs du fer…). L’objectif serait de les prescrire précocement, dès le diagnostic voire avant l’apparition des symptômes moteurs, pour freiner l’évolution de la maladie.
En parallèle, la recherche est très active dans l’identification de marqueurs précoces. Certains troubles comme l’anosmie et les troubles du comportement en sommeil paradoxal – mouvements pendant le sommeil (les patients « vivent » leurs rêves) – apparaissent bien avant la manifestation motrice de la maladie (en particulier, les patients ayant des troubles du sommeil paradoxal ont un fort taux de conversion vers une maladie de Parkinson) ; la combinaison de ces symptômes avec des données génétiques ou d’imagerie pourrait permettre de dépister des populations à très haut risque de développer la maladie. C’est un domaine qui va bouger dans les prochaines années !
Santé publique France.
Maladie de Parkinson : quelle évolution entre 2016 et 2020 ?
[IL1]Prendre la figure 1 d'ici : https://www.larevuedupraticien.fr/article/prise-en-charge-de-la-maladie-de-parkinson-de-la-lune-de-miel-aux-fluctuations
[IL2]Prendre la figure 2 d'ici : https://www.larevuedupraticien.fr/article/prise-en-charge-de-la-maladie-de-parkinson-de-la-lune-de-miel-aux-fluctuations