La maladie de Parkinson est une des plus fréquentes affections neurodégénératives et représente la deuxième cause de handicap moteur du sujet âgé. Elle est connue pour sa triade clinique motrice : tremblements, rigidité et akinésie. Au cours de l’évolution de la maladie, on observe également l’apparition de symptômes non moteurs parfois invalidants (dysautonomie, troubles cognitivo-comportementaux, dépression, anxiété, douleurs, etc.).
Dans les premières années de la maladie, les traitements médicamenteux utilisés en première ligne sont les agonistes dopaminergiques et/ou la lévodopa, avec un bon résultat : c’est la période de « lune de miel ». Puis des complications liées à la lévodopa apparaissent chez plus de 50 % des patients à dix ans : fluctuations motrices et non motrices (résurgence intermittente de symptômes parkinsoniens et de troubles non moteurs, périodes « off ») et dyskinésies (mouvements involontaires induits par la lévodopa).
Stade des fluctuations et dyskinésies
Les fluctuations et les dyskinésies sont responsables d’une perte d’autonomie et d’une altération de la qualité de vie. Afin de diminuer ces complications, on peut être amené à fractionner le traitement, à ajouter des inhibiteurs enzymatiques (de la catéchol-O-méthyltransférase et/ou de la monoamine oxydase de type B) qui permettent parfois de prolonger un peu l’action des prises de lévodopa. On peut aussi ajouter de l’amantadine à visée antidyskinétique. Des injections ponctuelles d’apomorphine, à l’aide d’un stylo injecteur, peuvent permettre de contrôler des fluctuations brèves et peu nombreuses.
L’amélioration produite par ces mesures est habituellement transitoire, justifiant le recours à des traitements de seconde ligne (
Selon les centres, le premier traitement de deuxième ligne à proposer est soit la stimulation cérébrale profonde, soit la pompe à apomorphine. La pompe à gel de lévodopa/carbidopa reste, pour la majorité des experts, un recours en cas de contre-indication, d’échec ou d’intolérance aux traitements précédents. Le recours à une pompe peut aussi être envisagé en cas de persistances de fluctuations et/ou de dyskinésies gênantes malgré une stimulation cérébrale profonde.
Pompe à apomorphine : à privilégier
L’apomorphine est un agoniste dopaminergique à brève durée d’action, inactivé lorsqu’il est donné per os, et disponible sous deux présentations : le chlorhydrate (Apokinon) ou le chlorhydrate hémihydraté (Dopaceptin). La pompe à apomorphine (
L’efficacité de la méthode a été prouvée dans différentes études. L’une d’elles, réalisée en double insu contre placebo, a montré une réduction du temps passé en « off », une augmentation du temps passé en « on » sans dyskinésies et une amélioration de la qualité de vie.4 Ces effets permettent de diminuer les traitements antiparkinsoniens pris par voie orale, et en priorité l’agoniste dopaminergique.
Les effets indésirables les plus fréquents sont communs à la classe des agonistes dopaminergiques : nausées, vomissements, hypotension orthostatique, somnolence diurne, hallucinations, confusion et troubles du contrôle des impulsions. Le développement de nodules sous-cutanés au site d’injection est une complication spécifique de la pompe à apomorphine. Très rarement survient une anémie hémolytique ou une hyperéosinophilie (un hémogramme doit être réalisé avant traitement et quelques semaines après son instauration).
Les troubles cognitivo-comportementaux sévères avec troubles « psychotiques » sont la principale contre-indication de ce dispositif. En cas de troubles cognitifs légers, elle peut être en revanche proposée, mais en informant le patient et son entourage du risque de majoration de ces troubles et d’apparition d’hallucinations.
Pompe à gel de lévodopa/carbidopa : plus contraignante
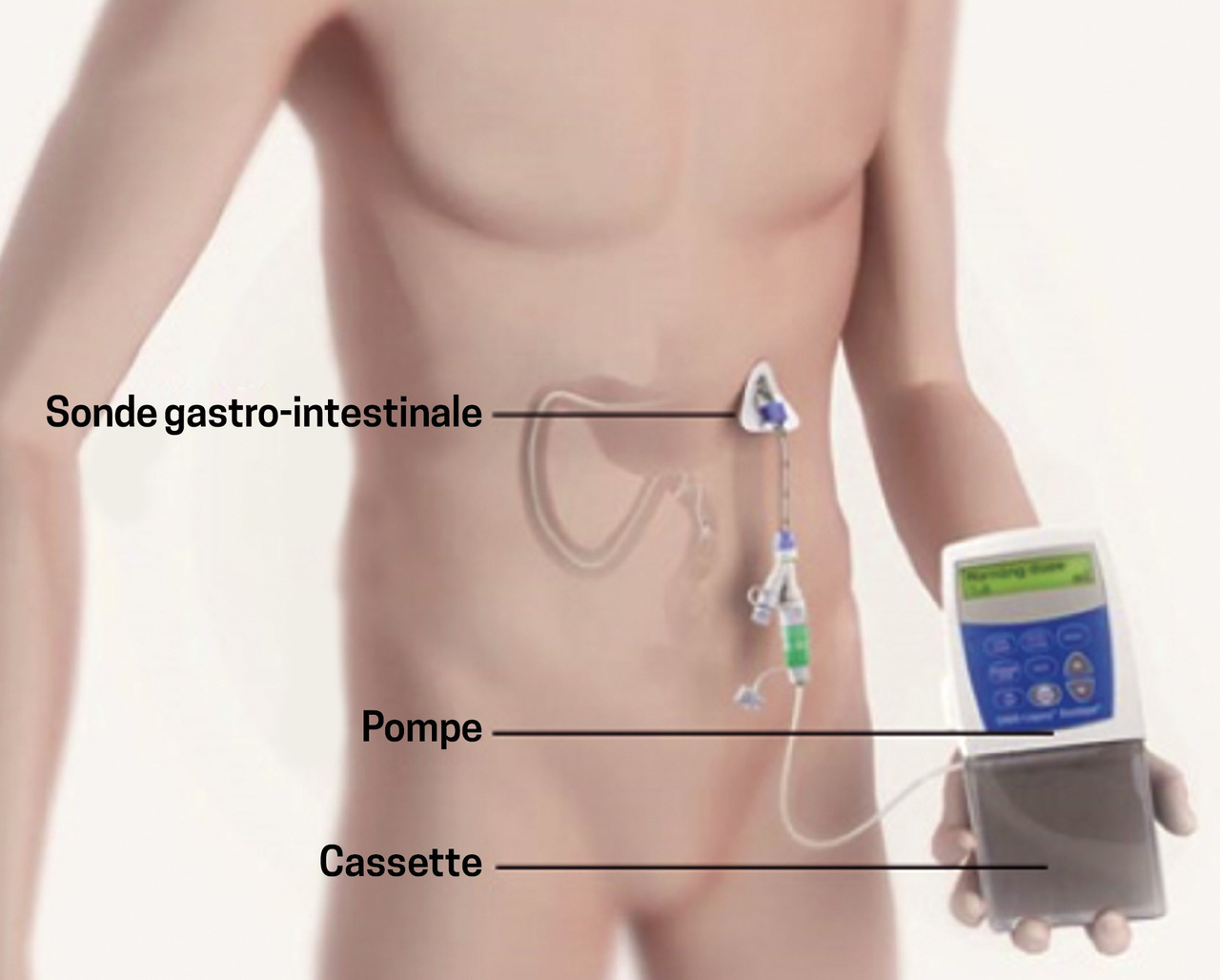
Selon les recommandations de la Haute Autorité de santé5 et la pratique de la majorité des experts, cette technique est réservée aux patients non éligibles à la stimulation cérébrale profonde et en cas de contre-indication, d’intolérance ou d’échec à l’apomorphine en perfusion sous-cutanée continue. Ce traitement nécessite la pose d’une gastrostomie sous anesthésie générale, reliée ensuite à une jéjunostomie (
L’efficacité de cette méthode a été confirmée par une étude randomisée contrôlée en double insu, contre un traitement par lévodopa par voie orale : comme avec l’apomorphine, on observe une réduction du temps « off », une augmentation du temps « on » sans dyskinésies et une amélioration de la qualité de vie.6 Ce traitement permet de réduire et parfois d’arrêter les traitements antiparkinsoniens per os.
Les effets indésirables sont surtout liés au matériel : déplacement, désadaptation et infection de sonde. Il faut aussi noter la survenue possible de neuropathies subaiguës ou chroniques (environ 10 % des patients) par interaction de la dopa avec les vitamines du groupe B. Il est donc nécessaire de réaliser un bilan préthérapeutique comportant des dosages des vitamines B9 et B12 et un électroneuromyogramme de référence.
Les contre-indications principales sont les pathologies cardiovasculaires et les arythmies sévères.
Conditions de passage à un traitement de seconde ligne
Lorsque le traitement comprend au moins 5 prises par jour.
Ou lorsque les phases de blocages durent au moins 2 heures par jour.
Ou lorsque les dyskinésies durent au moins 1 heure par jour.
1. Antonini A, Stoessl J, Kleinman S, et al. Developing consensus among movement disorder specialists on clinical indicators for identification and management of advanced Parkinson’s disease: a multi-country Delphi-panel approach. Curr Med Res Opin 2018;34(12):2063-73.
2. Palfi S. Neurostimulation dans la maladie de Parkinson. Rev Prat Med Gen 2018;32:20-1.
3. Trenkwalder C, Chaudhuri KR, Garcia Ruiz PJ, et al. Expert consensus report on the use of apomorphine in the treatment of Parkinson’s disease. Clinical practice recommendations. Parkinsonism Relat Disord 2015;21:1023-30.
4. Katzenschlager R, Poewe W, Rascol O, et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol 2018;17: 749-59.
5. HAS. Guide du parcours de soins. Maladie de Parkinson, 2016 ; HAS – commission de la Transparence. Avis du 23 octobre 2019.
6. Olanow W, Kieburtz K, Odin P, et al. Continuous intrajejunal infusion of levodopa-carbidopa intestinal gel for patients with advanced Parkinson’s disease: a randomised, controlled, double-blind, double-dummy study. Lancet Neurol 2014;13:141-9.

 Encadrés
Encadrés