L’hidradénite suppurée (HS) est une dermatose inflammatoire chronique, définie par les critères suivants (2009) :
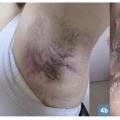
– lésions typiques : nodules profonds douloureux ou abcédés, trajets fistuleux, cicatrices fibreuses en pont et comédons ouverts ;
– dans les régions axillaires, mammaires, inguinales, périnéo-fessière ;
– atteintes chroniques et récurrentes.
Aucun examen complémentaire n’est utile. Malgré ces caractéristiques bien établies, le délai diagnostique moyen est long, de l’ordre de 8 ans. Cette discordance peut être expliquée par une fréquence élevée des formes peu sévères et par une mauvaise connaissance de l’HS par la communauté médicale.
La prévalence serait de 1 % en population générale. Le sex-ratio est de 1 homme pour 3,3 femmes. L’âge moyen de début est 22,1 ans et la durée moyenne d’activité de la maladie est de 18,8 ans. Elle tend à être moins agressive après la ménopause. Dans 2 études cas-témoins françaises, le tabagisme et le surpoids étaient significativement associés à l’HS. Un lien avec le syndrome métabolique est rapporté. De plus, la prévalence des consommateurs de cannabis serait de 34 % dans la population HS versus 11,6 % dans le groupe contrôle (patients atteints de psoriasis).1
– lésions typiques : nodules profonds douloureux ou abcédés, trajets fistuleux, cicatrices fibreuses en pont et comédons ouverts ;
– dans les régions axillaires, mammaires, inguinales, périnéo-fessière ;
– atteintes chroniques et récurrentes.
Aucun examen complémentaire n’est utile. Malgré ces caractéristiques bien établies, le délai diagnostique moyen est long, de l’ordre de 8 ans. Cette discordance peut être expliquée par une fréquence élevée des formes peu sévères et par une mauvaise connaissance de l’HS par la communauté médicale.
La prévalence serait de 1 % en population générale. Le sex-ratio est de 1 homme pour 3,3 femmes. L’âge moyen de début est 22,1 ans et la durée moyenne d’activité de la maladie est de 18,8 ans. Elle tend à être moins agressive après la ménopause. Dans 2 études cas-témoins françaises, le tabagisme et le surpoids étaient significativement associés à l’HS. Un lien avec le syndrome métabolique est rapporté. De plus, la prévalence des consommateurs de cannabis serait de 34 % dans la population HS versus 11,6 % dans le groupe contrôle (patients atteints de psoriasis).1
Une hétérogénéité clinique
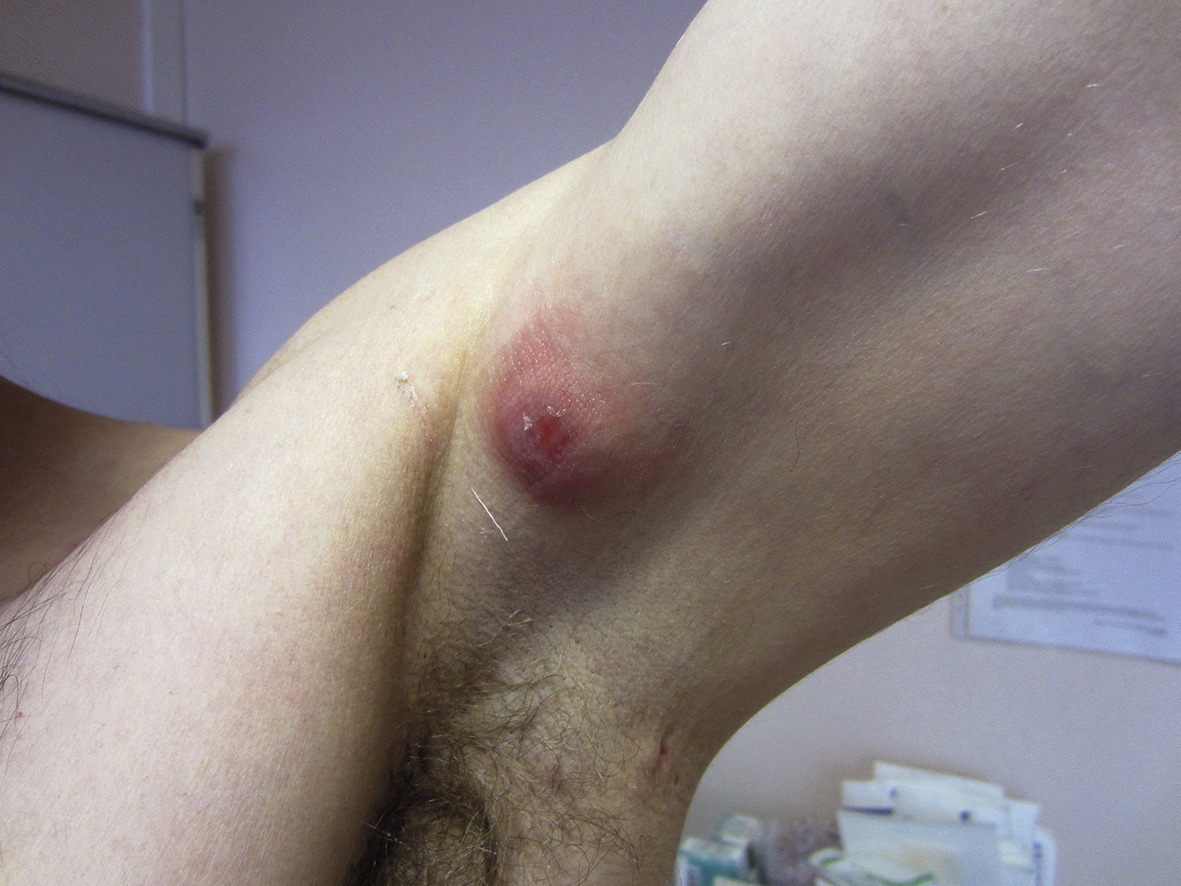
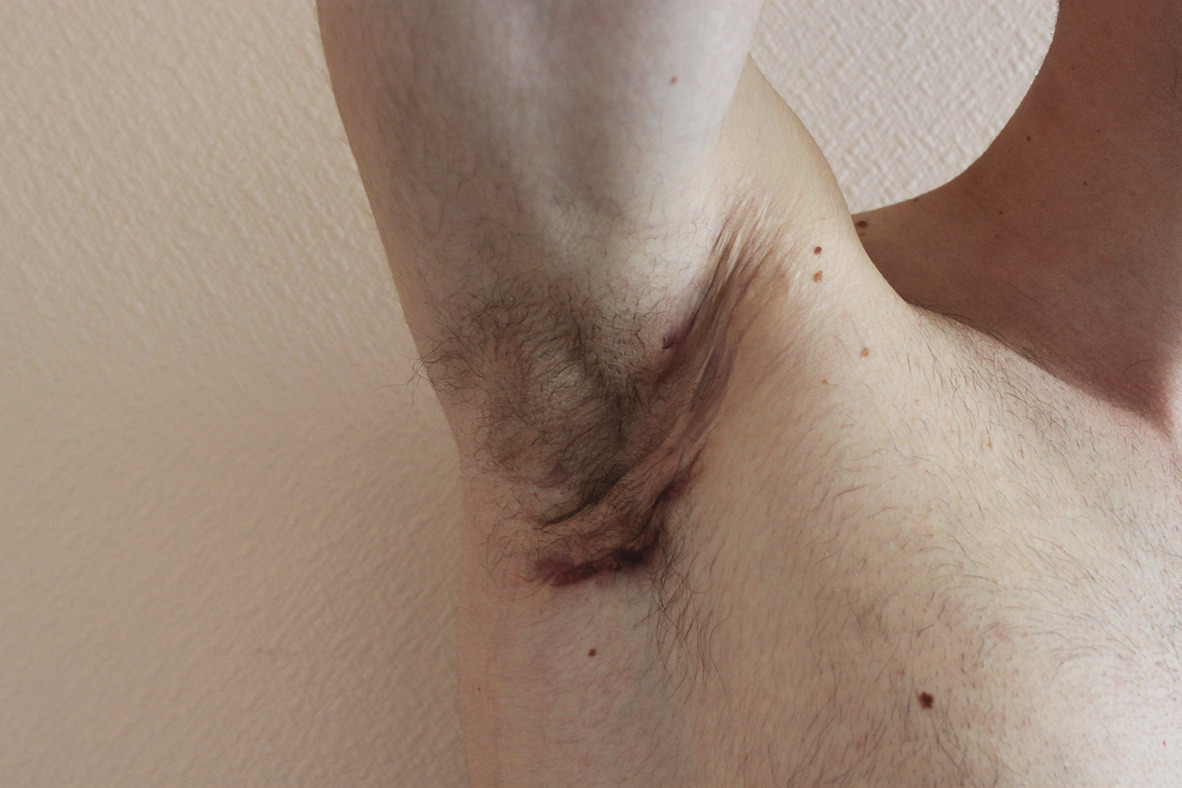
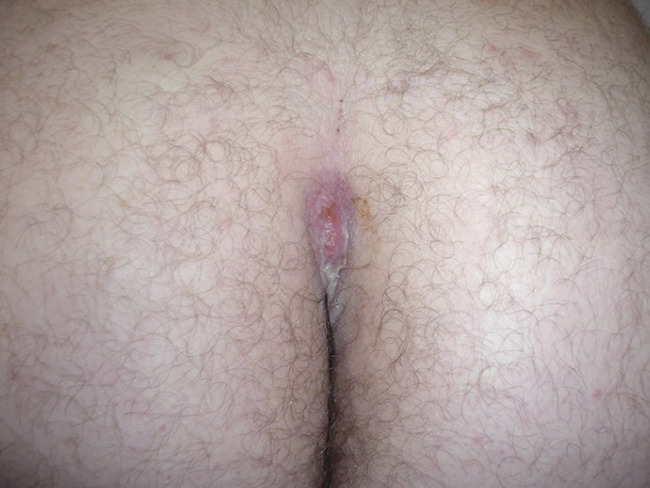
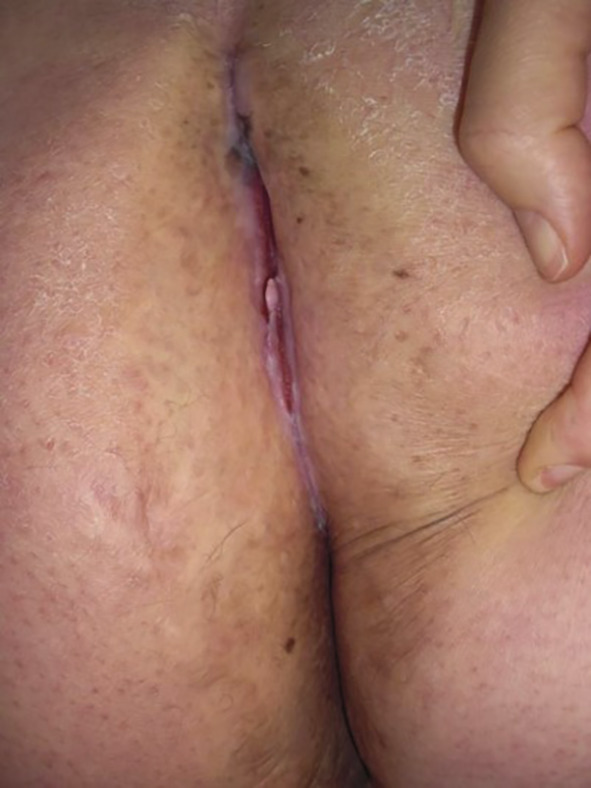
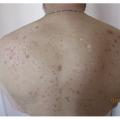
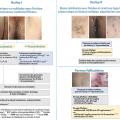
Les lésions précoces sont des nodules douloureux isolés pouvant s’abcéder (fig. 1 ). La répétition de poussées inflammatoires est responsable de cicatrices hypertrophiques et fibreuses en pont, de trajets fistuleux et de comédons ouverts (fig. 2 ). Lésions non typiques : folliculite, bourgeons charnus, cicatrices vermoulues ou à l’emporte-pièce, kystes épidermiques. Pas d’adénopathie ni de fièvre associée.
Outre les localisations citées ci-dessus, d’autres régions peuvent être touchées : visage, nuque, dos.
La clinique est en réalité très hétérogène en termes de types de lésion, évolution et sévérité.
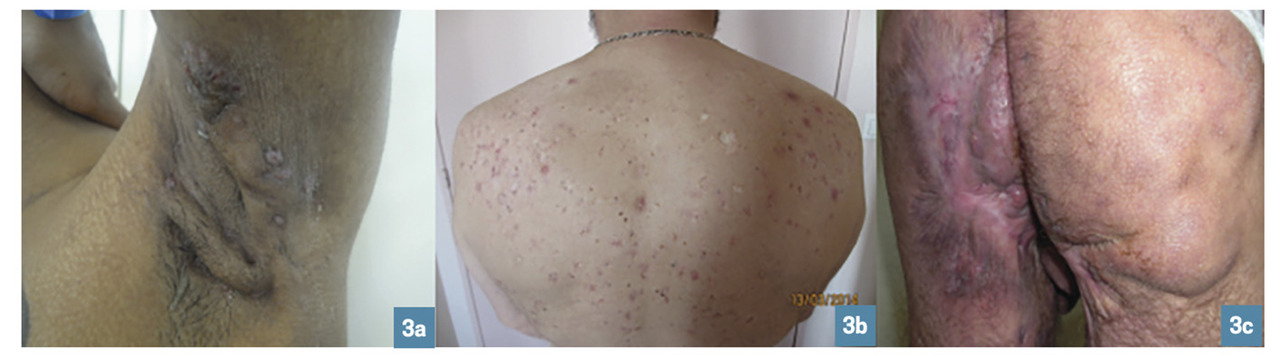
Selon une étude transversale chez 618 patients, 3 phénotypes2 pourraient être le reflet de divers processus physiopathologiques (fig. 3 ) :
– « axillo-mammaire » ou LC1 (48 % de la population étudiée) : caractérisé par des atteintes mammaires, axillaires et des lésions de type nodule et cicatrices en pont. Cet aspect « typique » est retrouvé principalement chez des femmes avec un IMC élevé ;
– « folliculaire » ou LC2 (26 %) : touchant les régions axillaires, mammaires, rétro-auriculaires, thoracique, dorsale ; les probabilités de manifestations folliculaires (kystes épidermiques, comédons, sinus pilonidal) sont élevées. Cette forme sévère est plus fréquente chez les fumeurs. Une atteinte pré- et rétro-auriculaire avec des lésions à type de poche et des cicatrices vermoulues du visage doivent faire suspecter le diagnostic ;
– « fessier » ou LC3 (26 %) : localisation fessière avec papules et folliculites.
Outre les localisations citées ci-dessus, d’autres régions peuvent être touchées : visage, nuque, dos.
La clinique est en réalité très hétérogène en termes de types de lésion, évolution et sévérité.
Selon une étude transversale chez 618 patients, 3 phénotypes2 pourraient être le reflet de divers processus physiopathologiques (
– « axillo-mammaire » ou LC1 (48 % de la population étudiée) : caractérisé par des atteintes mammaires, axillaires et des lésions de type nodule et cicatrices en pont. Cet aspect « typique » est retrouvé principalement chez des femmes avec un IMC élevé ;
– « folliculaire » ou LC2 (26 %) : touchant les régions axillaires, mammaires, rétro-auriculaires, thoracique, dorsale ; les probabilités de manifestations folliculaires (kystes épidermiques, comédons, sinus pilonidal) sont élevées. Cette forme sévère est plus fréquente chez les fumeurs. Une atteinte pré- et rétro-auriculaire avec des lésions à type de poche et des cicatrices vermoulues du visage doivent faire suspecter le diagnostic ;
– « fessier » ou LC3 (26 %) : localisation fessière avec papules et folliculites.
Quelle gravité ?
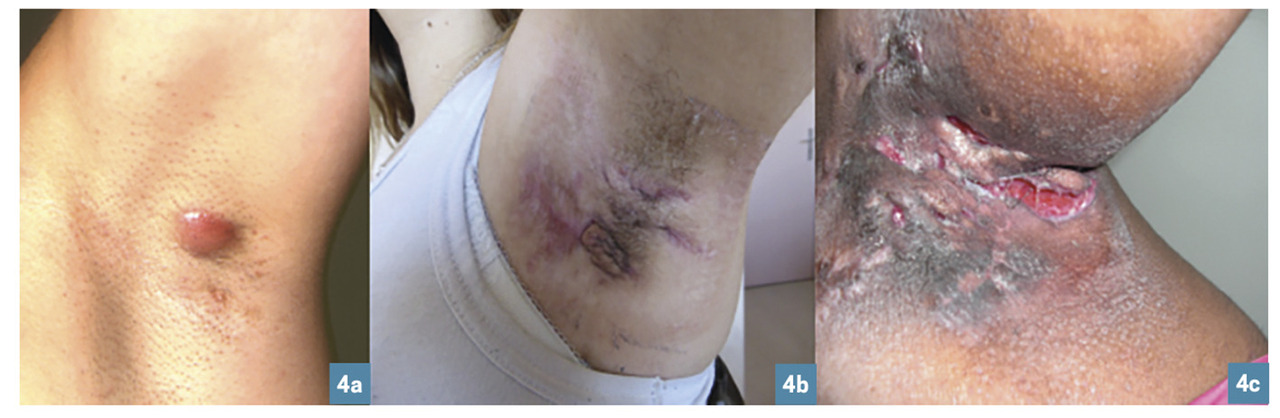
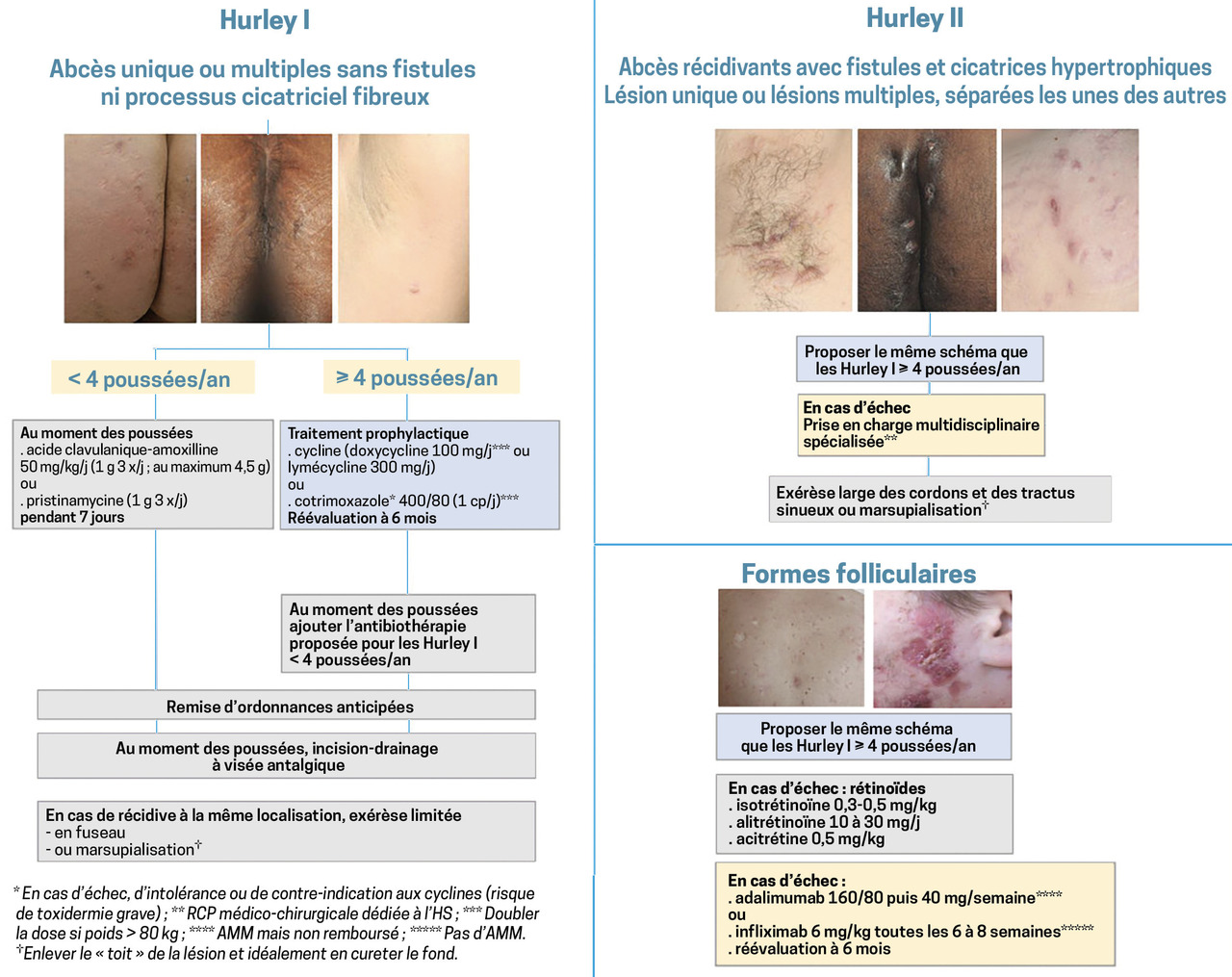
La classification de Hurley cote la sévérité en 3 degrés (fig. 4 et tableau ).
Dans une étude française, chez 302 malades, 68,2 % étaient classés grade I ; 27,6 % grade II et 3,9 % étaient sévèrement atteints (III). D’autres scores permettent de juger de l’évolutivité (Sartorius modifié, Physicians Global Assessment, IHS4). Le Dermatology life quality index aide à quantifier l’impact de la dermatose. L’évaluation de l’importance de l’écoulement et de la douleur lors des poussées, via une échelle visuelle analogique (EVA), est utile au suivi.
Dans une étude française, chez 302 malades, 68,2 % étaient classés grade I ; 27,6 % grade II et 3,9 % étaient sévèrement atteints (III). D’autres scores permettent de juger de l’évolutivité (Sartorius modifié, Physicians Global Assessment, IHS4). Le Dermatology life quality index aide à quantifier l’impact de la dermatose. L’évaluation de l’importance de l’écoulement et de la douleur lors des poussées, via une échelle visuelle analogique (EVA), est utile au suivi.
Complications et comorbidités
Le retentissement socio-professionnel et psychologique est majeur. C’est une des affections dermatologiques altérant le plus la qualité de vie. L’inflammation chronique et récurrente peut induire un lymphœdème.
Des cancers épidermoïdes ont été décrits après une évolution prolongée des lésions périnéales chez l’homme. La prévalence a été estimée à 4,6 % dans une étude rétrospective française.3 Le diagnostic est souvent tardif et le pronostic mauvais, avec une mortalité supérieure à 70 %. Le rôle du papillomavirus (HPV) a été suggéré. Les infections à pyogènes sont rares.
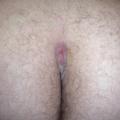
Comorbidités : folliculites, sinus pilonidal (fig. 5 ),4 folliculite disséquante du cuir chevelu et, selon certains, acné.
On peut confondre l’HS folliculaire avec certaines formes d’acné sévère. Ainsi, des lésions en pic à glace (dépression triangulaire), à type de poche, des cicatrices en corde, une atteinte pré- ou rétro-auriculaire doivent faire évoquer une HS et conduire à un examen complet.5
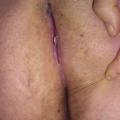
La maladie de Crohn (MC) est à la fois un diagnostic différentiel et une comorbidité (fig. 6 ).
La prévalence de l’HS dans une étude de cohorte rétrospective chez 1 093 patients MICI (par autoquestionnaire) était évaluée à 23 %.
Une augmentation du risque de MC et de rectocolite hémorragique a été rapportée dans cette population selon une grande étude danoise.
Une méta-analyse récente confirme le lien entre HS et maladies digestives inflammatoires.6
Ainsi, en cas de signes digestifs évocateurs d’une MICI à l’interrogatoire, il faut demander un avis gastro-entérologique ; des investigations supplémentaires (dosage de calprotectine fécale, endoscopies digestives) peuvent être nécessaires.
Des manifestations rhumatologiques sont possibles (atteinte axiale et périphérique). Prévalence des spondyloarthrites estimée à 3,7 % (vs 0,3 % en population générale).7 Des examens complémentaires et une consultation spécialisée sont préconisés en cas de suspicion clinique.
Enfin, des maladies auto-inflammatoires peuvent être associées. Des syndromes PASH, PAPASH, PASS combinant Pyoderma gangrenosum, acné, HS ± arthrite ont récemment été décrits, extension du PAPA syndrome (Pyogenic Arthritis, Pyoderma gangrenosum and Acne). La prévalence de la maladie périodique (ou fièvre méditerranéenne familiale) a été évaluée à 0,7 %. Une étude a retrouvé une association entre mutations du gène MEFV codant pour la pyrine et des phénotypes complexes d’HS.
Des cancers épidermoïdes ont été décrits après une évolution prolongée des lésions périnéales chez l’homme. La prévalence a été estimée à 4,6 % dans une étude rétrospective française.3 Le diagnostic est souvent tardif et le pronostic mauvais, avec une mortalité supérieure à 70 %. Le rôle du papillomavirus (HPV) a été suggéré. Les infections à pyogènes sont rares.
Comorbidités : folliculites, sinus pilonidal (
On peut confondre l’HS folliculaire avec certaines formes d’acné sévère. Ainsi, des lésions en pic à glace (dépression triangulaire), à type de poche, des cicatrices en corde, une atteinte pré- ou rétro-auriculaire doivent faire évoquer une HS et conduire à un examen complet.5
La maladie de Crohn (MC) est à la fois un diagnostic différentiel et une comorbidité (
La prévalence de l’HS dans une étude de cohorte rétrospective chez 1 093 patients MICI (par autoquestionnaire) était évaluée à 23 %.
Une augmentation du risque de MC et de rectocolite hémorragique a été rapportée dans cette population selon une grande étude danoise.
Une méta-analyse récente confirme le lien entre HS et maladies digestives inflammatoires.6
Ainsi, en cas de signes digestifs évocateurs d’une MICI à l’interrogatoire, il faut demander un avis gastro-entérologique ; des investigations supplémentaires (dosage de calprotectine fécale, endoscopies digestives) peuvent être nécessaires.
Des manifestations rhumatologiques sont possibles (atteinte axiale et périphérique). Prévalence des spondyloarthrites estimée à 3,7 % (vs 0,3 % en population générale).7 Des examens complémentaires et une consultation spécialisée sont préconisés en cas de suspicion clinique.
Enfin, des maladies auto-inflammatoires peuvent être associées. Des syndromes PASH, PAPASH, PASS combinant Pyoderma gangrenosum, acné, HS ± arthrite ont récemment été décrits, extension du PAPA syndrome (Pyogenic Arthritis, Pyoderma gangrenosum and Acne). La prévalence de la maladie périodique (ou fièvre méditerranéenne familiale) a été évaluée à 0,7 %. Une étude a retrouvé une association entre mutations du gène MEFV codant pour la pyrine et des phénotypes complexes d’HS.
Prise en charge
Fin 2019, le centre de preuves de la Société francaise de dermatologie a émis des recommandations ; fig. 7 ). Pour tous les patients : prise en charge de la douleur et psychologique, perte de poids, arrêt du tabac.
Références
1. Lesort C, Villani AP, Giai J, et al. High prevalence of cannabis use among patients with hidradenitis suppurativa: results from the VERADDICT survey. Br J Dermatol 2019;181:839-41.
2. Canoui-Poitrine F, Le Thuaut A, Revuz JE, et al. Identification of three hidradenitis suppurativa phenotypes: latent class analysis of a cross-sectional study. J Invest Dermatol 2013;133:1506-11.
3. Lavogiez C, Delaporte E, Darras-Vercambre S, et al. Clinicopathological study of 13 cases of squamous cell carcinoma complicating hidradenitis suppurativa. Dermatology 2010;220:147-53.
4. Benhadou F, Van der Zee HH, Pascual JC, et al. Pilonidal sinus disease: an intergluteal localization of hidradenitis suppurativa/acne inversa: a cross-sectional study among 2465 patients. Br J Dermatol 2019;181:1198-206.
5. Poli F, Revuz J. [Acne flare on isotretinoin: A pointer to diagnosis of hidradenitis suppurativa]. Ann Dermatol Venereol 2019 Jan;146:4-8.
6. Chen WT, Chi CC. Association of Hidradenitis Suppurativa With Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. JAMA Dermatol 2019;155:1022-7.
7. Richette P, Molto A, Viguier M, et al. Hidradenitis suppurativa associated with spondyloarthritis -- results from a multicenter national prospective study. J Rheumatol 2014;41:490-4.
2. Canoui-Poitrine F, Le Thuaut A, Revuz JE, et al. Identification of three hidradenitis suppurativa phenotypes: latent class analysis of a cross-sectional study. J Invest Dermatol 2013;133:1506-11.
3. Lavogiez C, Delaporte E, Darras-Vercambre S, et al. Clinicopathological study of 13 cases of squamous cell carcinoma complicating hidradenitis suppurativa. Dermatology 2010;220:147-53.
4. Benhadou F, Van der Zee HH, Pascual JC, et al. Pilonidal sinus disease: an intergluteal localization of hidradenitis suppurativa/acne inversa: a cross-sectional study among 2465 patients. Br J Dermatol 2019;181:1198-206.
5. Poli F, Revuz J. [Acne flare on isotretinoin: A pointer to diagnosis of hidradenitis suppurativa]. Ann Dermatol Venereol 2019 Jan;146:4-8.
6. Chen WT, Chi CC. Association of Hidradenitis Suppurativa With Inflammatory Bowel Disease: A Systematic Review and Meta-analysis. JAMA Dermatol 2019;155:1022-7.
7. Richette P, Molto A, Viguier M, et al. Hidradenitis suppurativa associated with spondyloarthritis -- results from a multicenter national prospective study. J Rheumatol 2014;41:490-4.