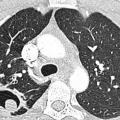
Ces 10 dernières années, Aspergillus sp. est devenu le premier pathogène fongique à transmission aérienne dans les pays développés, avec une nette croissance de son incidence.1 La pathologie pulmonaire diffère selon l’état du poumon sous-jacent et les défenses immunes. Chez les patients peu ou non immunodéprimés, on distingue les infections bronchopulmonaires : aspergillome simple et diverses formes d’aspergilloses pulmonaires chroniques (APC) des manifestations d’hypersensibilité telles que l’aspergillose bronchopulmonaire allergique (ABPA).
ABPA en pratique
Elle fait partie des affections secondaires à une réaction d’hypersensibilité envers la moisissure Aspergillus fumigatus impliquant une réponse immunitaire via les cellules Th2 et les IgE, IgG et IgA.2 Elle survient essentiellement chez l’asthmatique (3 à 13 %) et les patients atteints de mucoviscidose (2 à 15 %) mais également sur des terrains de BPCO.3 Les exacerbations émaillant l’évolution peuvent menacer le pronostic vital et générer des lésions de fibrose pulmonaire irréversibles ainsi que des bronchectasies.2 Leur traitement précoce vise à éviter ces séquelles et une hypertension artérielle pulmonaire.2
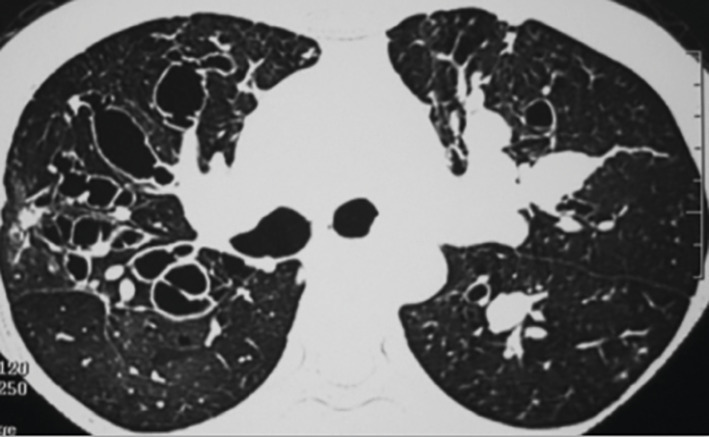
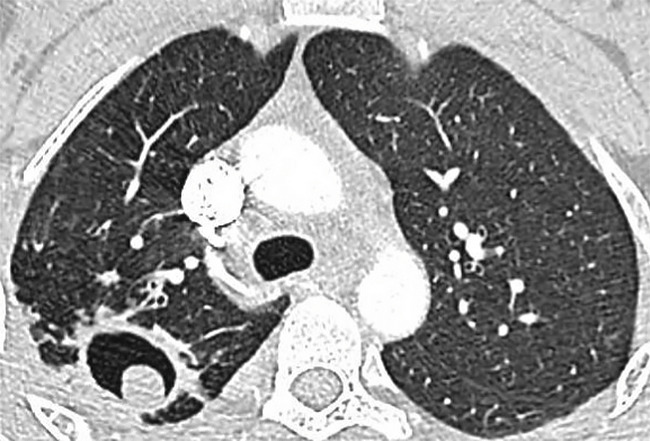
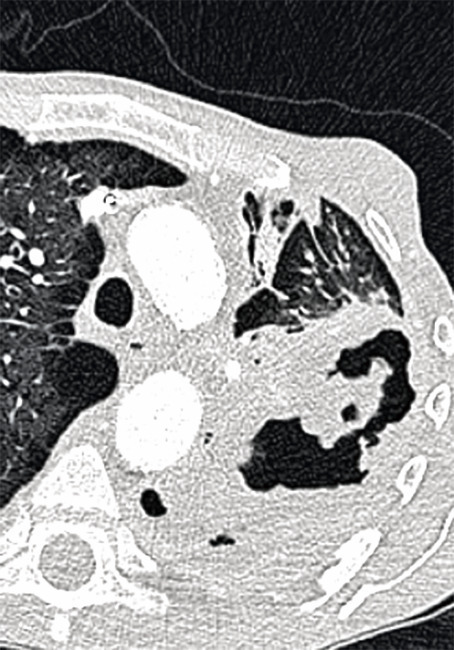
L’ABPA est dite ABPA-S pour sérologique si le scanner est normal, ABPA-B si dilatations bronchiques avec ou sans impactions mucoïdes, ABPA-HAM en présence d’impactions mucoïdes hyperdenses, facteur de mauvais pronostic et d’échec du traitement, et ABPA-CPF devant des signes de fibrose (
Deux grands axes thérapeutiques selon l’IDSA (Infectious Diseases Society of America) en 2008 : corticothérapie générale contre la composante inflammatoire, antifongiques azolés pour limiter la prolifération mycélienne.
La corticothérapie systémique est le traitement de référence des exacerbations en cas d’échec d’un azolé.2 D’après l’ISHAM (International Society for Human and Animal Mycology) en 2016, on débute à 0,5 mg/kg/j pendant 15 jours, puis on baisse progressive par paliers sur 2 à 3 mois au maximum avec maintien du traitement par bronchodilatateur et corticoïdes inhalés. La corticothérapie à court terme réduit la fréquence des exacerbations, améliore la fonction pulmonaire et la qualité de vie ; à long terme, elle peut induire diabète, dyslipidémie, ostéoporose, insuffisance surrénalienne.
Les antifongiques par voie systémique (itraconazole, voriconazole) sont recommandés en première intention dans l’ABPA de novo ou en exacerbation en l’absence de contre-indication et dans la mesure où une amélioration clinique, immunologique (baisse des IgE totales > 50 % par rapport à la valeur la plus haute) et radiologique est obtenue à 8 semaines (pour une durée totale de 4 mois). En cas d’inefficacité, on leur substitue un corticoïde systémique.3
Parallèlement à ces mesures, on prend en compte l’aspect environnemental (enquête d’exposition aux moisissures) ainsi que le drainage bronchique quotidien (auto-kiné ou séances par un kiné).
Pour l’ISHAM, la nébulisation d’amphotéricine B liposomale est à envisager dans des cas réfractaires ou si les traitements de référence sont contre- indiqués ou encore en entretien pour limiter le recours aux corticoïdes et le risque de résistance. De même, les anticorps monoclonaux humanisés tels que l’omalizumab sont intéressants en cas d’ABPA rebelle au traitement standard.
Aspergillose chronique
Elle se développe sur des poumons remaniés – séquelles de mycobactéries tuberculeuses ou non, BPCO, emphysème, sarcoïdose – et des terrains fragilisés : diabète, tabac, alcool, dénutrition, corticothérapie inhalée ou systémique. Elle toucherait environ 240 000 personnes en Europe, avec une incidence croissante.3 La mortalité à 5 ans sans traitement varie de 50 à 80 %.3
Selon les sociétés savantes, le diagnostic est fondé sur :4
– infection aspergillaire bronchopulmonaire évoluant depuis plus de 3 mois ;
– scanner thoracique compatible montrant une ou plusieurs cavités, avec ou sans balle fongique ou nodules ;
– associée à 1 des critères suivants : anticorps précipitants ou IgG positifs envers A. fumigatus ou examen direct positif ou culture positive à Aspergillus sur les prélèvements bronchopulmonaires ou mise en évidence d’hyphes (filaments) aspergillaires en histologie ;
– exclusion de tout autre diagnostic alternatif.
Les prélèvements, expectoration, aspiration bronchique plus que LBA, ne révèlent qu’inconstamment les filaments (examen direct), Aspergillus est difficile à cultiver. Détecter l’antigène aspergillaire dans les sécrétions respiratoires a un faible niveau de preuve.
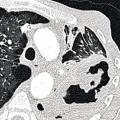
L’aspergillome simple (AS ;
Contrairement à l’AS, dont la prise en charge est avant tout chirurgicale, l’APC (
Les recommandations soulignent les limites des molécules actuelles : itraconazole (AII), voriconazole (AII) ou posaconazole (BII). L’efficacité est difficile à évaluer en raison d’un manque de standardisation de la réponse thérapeutique. Certains critères tomodensitométriques objectifs pourraient la faciliter.5 De nouvelles formulations et/ou voies d’administration (nébulisée par exemple) visent des concentrations in situ élevées, tout en réduisant interactions et effets indésirables.
Un essai prospectif de phase III, multicentrique, randomisé, comparant à 6 mois itraconazole + amphotéricine B liposomale nébulisée à l’itraconazole seul est en cours.
Le traitement chirurgical doit être évoqué en cas d’hémoptysie si possible après une artério-embolisation, du fait de la très grande mortalité de la chirurgie en urgence. Dans les autres cas, le bénéfice/risque de cette option doit être évalué individuellement et de manière pluridisciplinaire intégrant le choix du malade. Elle est à privilégier en cas d’AS lorsque la fonction respiratoire le permet. Une exérèse complète sans effraction dispense d’un antifongique adjuvant ;4 sa place en périopératoire dans les autres formes d’APC est à évaluer.
Les hémoptysies de faible et moyenne abondance (< 200 mL) répondraient bien à l’acide tranexamique 500 mg 3 x/j per os. En revanche, une grande abondance motive une artério-embolisation. Le succès varie de 50 à 90 % selon l’expérience des équipes.4
Diagnostic de l’APBA
Terrain : atopie, antécédents d’asthme ou de mucoviscidose, BPCO.
Et 2 critères majeurs :
• IgE totales > 1 000 UI/mL (ou < 1 000 UI/mL si les autres critères diagnostiques sont réunis) ;
• IgE spécifiques envers Aspergillus fumigatus positifs (> 0,35 kUA/L) ou tests cutanés positifs en lecture immédiate.
Et 2 de ces 3 critères suivants
• anticorps précipitants ou IgG positifs envers Aspergillus fumigatus ;
• infiltrats radiologiques en lien possible avec une ABPA ;
• antécédent d’hyperéosinophilie sanguine > 500 éléments/mm3.
1. The Lancet Respiratory Medicine. Chronic pulmonary aspergillosis: help is on the way. Lancet Respir Med 2016;4:83.
2. Agarwal R, Sehgal IS, Dhooria S, Aggarwal AN. Developments in the diagnosis and treatment of allergic bronchopulmonary aspergillosis. Expert Rev Respir Med 2016;10:1317-34.
3. Godet C, Alastruey-Izquierdo A, Flick H, et al. A CPAnet consensus statement on research priorities for chronic pulmonary aspergillosis: a neglected fungal infection that requires attention. J Antimicrob Chemother 2018;73:280-6.
4. Denning DW, Cadranel J, Beigelman-Aubry C, et al; European Society for Clinical Microbiology and Infectious Diseases and European Respiratory Society. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J 2016;47:45-68.
5. Godet C, Laurent F, Bergeron A, et al ACHROSCAN Study Group. CT imaging assessment of response to treatment in chronic pulmonary aspergillosis. Chest 2016;150:139-47.

 Encadrés
Encadrés