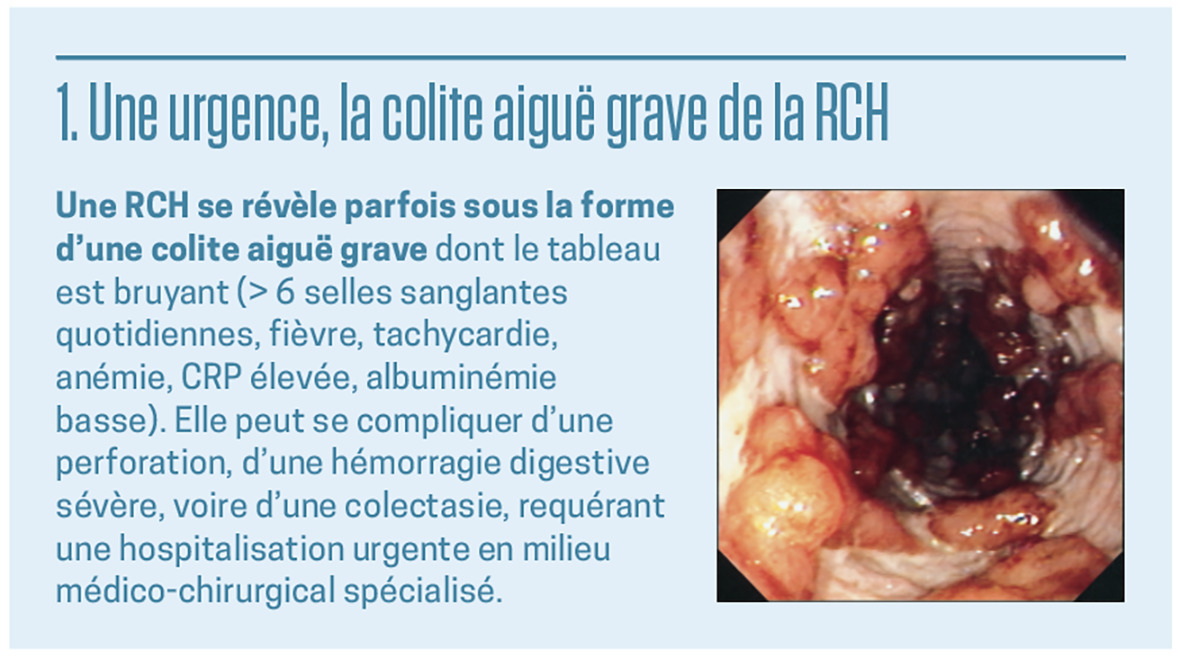
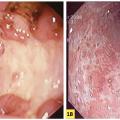
De l’identification précoce des MICI dépend leur pronostic. Des traitements appropriés, des poussées et de fond, à la hauteur de la sévérité de l’affection, permettent de modifier son histoire naturelle. Une surveillance rapprochée, clinique et endoscopique de la maladie, mais aussi des effets indésirables des traitements est cruciale.
En France, plus de 200 000 patients souffrent de maladies inflammatoires chroniques de l’intestin (MICI), maladie de Crohn (MC) ou rectocolite hémorragique (RCH). Les MICI affectent essentiellement les jeunes adultes (de 15 à 35 ans) dont les gènes les prédisposent à une réponse immunitaire intestinale inappropriée envers des facteurs d’environnement, incluant la flore intestinale. Le diagnostic inaugural, parfois difficile, incertain, repose sur l’association d’un faisceau d’arguments cliniques, biologiques, endoscopiques, histologiques et radiologiques.
Les MICI évoluent par poussées inflammatoires entrecoupées de périodes de rémission plus ou moins longues. Un certain nombre de diagnostics différentiels lors d’une première poussée, puis à l’occasion des rechutes, doivent être évoqués (entérocolite ischémique, médicamenteuse, infectieuse – incluant la tuberculose digestive –, radique, tumorale).
Un diagnostic de certitude doit être établi précocement compte tenu des stratégies thérapeutiques actuelles visant à introduire rapidement des traitements majeurs (immunosuppresseurs, biothérapies) dans les formes sévères afin de réduire le risque d’évolution vers des complications.
Quand penser à une MICI ?
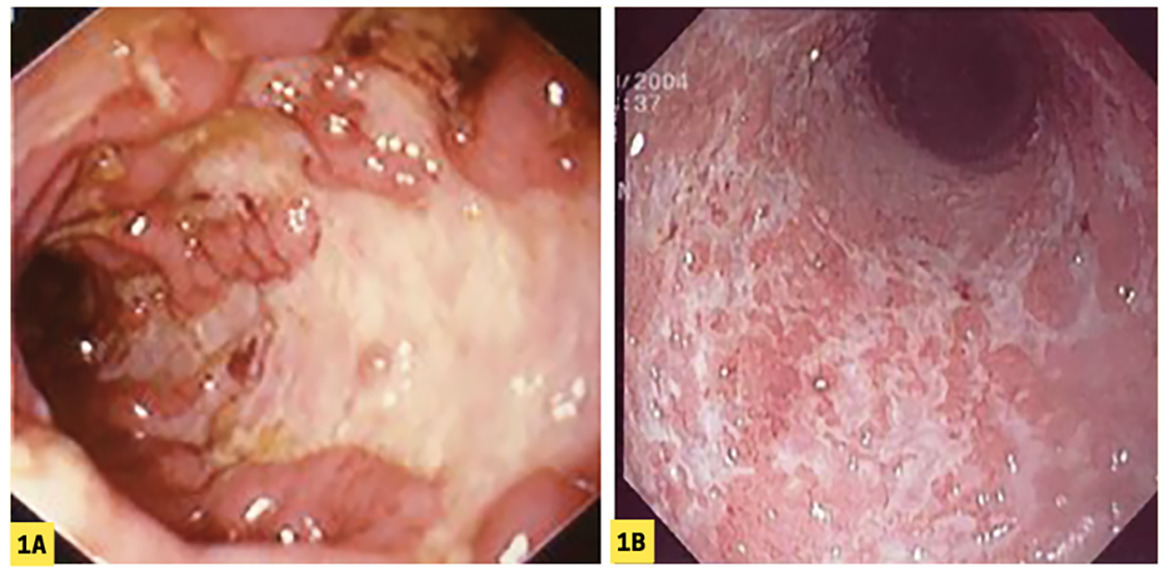
La maladie de Crohn peut toucher l’ensemble du tube digestif, « de la bouche à l’anus », souvent de façon discontinue ; elle est caractérisée par une inflammation segmentaire et transmurale. Le diagnostic initial de MC est évoqué sur des symptômes récidivants (douleurs abdominales – souvent de la fosse iliaque droite – diarrhée chronique, parfois constipation dans les atteintes iléales isolées, nausées ou vomissements, amaigrissement).
Les atteintes ano-périnéales de la MC (ulcérations, sténoses et fistules) se traduisent par des douleurs, des écoulements, voire une suppuration anale. Elles impactent fortement la qualité de vie des patients et reflètent une maladie sévère, justifiant une prise en charge spécialisée et des traitements puissants afin d’éviter une évolution irréversible des lésions (incontinence, sténose anale, avec un risque élevé de stomie provisoire ou définitive). Enfin, la MC se complique parfois de sténoses digestives, de syndromes sub- occlusifs, de fistules et d’abcès abdominal.
L’inflammation d’une RCH est superficielle, continue et limitée au rectum et au côlon. Elle touche donc systématiquement le rectum (proctite), s’étend parfois vers le côlon d’amont, jusqu’au sigmoïde (rectosigmoïdite), atteint le côlon gauche (RCH distale), dépasse l’angle colique gauche (RCH étendue), voire gagne tout le côlon (pancolite) [
Certains signes d’alarme : un âge > 50 ans, des symptômes nocturnes, des rectorragies ou des anomalies biologiques (syndrome inflammatoire, carence martiale, anémie) orientent vers une pathologie organique et requièrent des explorations systématiques.
Au-delà des signes digestifs…
En plus de ces manifestations, des symptômes extradigestifs (
La calprotectine, marqueur d’orientation
Un dosage de la calprotectine dans les selles permet de proposer à bon escient une iléocoloscopie chez un patient jeune (< 45 ans) avec des symptômes digestifs. Ainsi, l’augmentation de ce marqueur au-delà de 50 µg/g est évocateur d’une inflammation intestinale, sans toutefois préjuger de la cause de celle-ci ni de sa localisation dans le tube digestif (MICI, maladie cœliaque, infection digestive, diverticulite...).2
Une calprotectine fécale normale (< 50 µg/g) a une excellente valeur prédictive négative chez l’adulte et l’enfant, évitant la réalisation de coloscopies chez 2 patients sur 3.3 À l’heure actuelle, en dépit de son intérêt, ce dosage n’est pas remboursé par l’Assurance maladie (environ 50 €), ce qui limite son utilisation en pratique.
Poussée inaugurale ou infection bactérienne ?
Le tableau clinique d’une poussée inaugurale de MICI peut être bruyant, avec des douleurs abdominales aiguës, des diarrhées parfois glairo-sanglantes, de la fièvre, voire une altération de l’état général. L’enjeu est ici de ne pas méconnaître une origine infectieuse à ces symptômes.
Si les iléites distales aiguës sont majoritairement d’origine bactérienne (Yersinia, salmonelles, Campylobacter), la répétition dans le temps d’entérites ou d’entérocolites aiguës doit faire penser à une MICI, et ce d’autant plus que des études longitudinales suggèrent qu’une infection intestinale est un facteur de risque de développer ultérieurement une MICI… Le contexte peut orienter la démarche diagnostique, notamment en cas de retour d’un pays d’endémie (amibiase), de syndrome hémolytique et urémique associé (E. coli entérohémorragique), de prise d’antibiotiques (Clostridioides difficile, Klebsiella oxytoca). Une coproculture avec recherche de germes entéropathogènes et de toxines de C. difficile est systématique, ainsi qu’un examen parasitologique de selles à un retour de voyage. Leur sensibilité imparfaite pour la détection des germes digestifs, à l’exception de la toxine de C. difficile, doit rendre l’interprétation prudente si les examens de selles sont négatifs. Par ailleurs, la coproculture ne permet pas d’exclure une origine infectieuse.
À l’origine de rectites, on retrouve le plus souvent une RCH et, dans une moindre mesure, certaines infections sexuellement transmises (IST : Neisseria gonorrhoeae, Chlamydia trachomatis, herpès). Si les symptômes persistent, récidivent ou en cas de signes de gravité, une endoscopie avec biopsies est indiquée. Une cause iatrogène doit aussi être systématiquement cherchée (
Quel bilan initial ?
Lorsqu’on suspecte une MICI, une MC ou une RCH, on peut faire un inventaire des lésions œsogastroduodénales et iléocoliques (
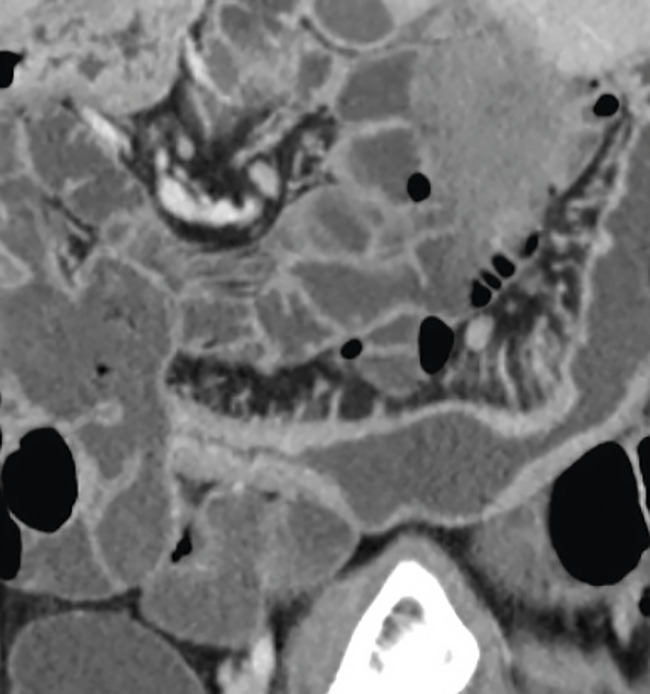
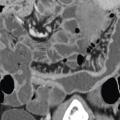
Une entéro-IRM (ou à défaut une entéro-TDM, voire une échographie) est proposée systématiquement en cas de doute diagnostique d’une MC pour compléter la cartographie des lésions (étendue, sévérité) sur l’intestin grêle et rechercher d’éventuelles complications associées (sténoses, fistules, abcès ;
Cet examen est facultatif si la présentation clinique, endoscopique, histologique est typique de RCH, notamment dans les formes distales. Selon le contexte, une IRM périnéale est prescrite devant des lésions ano-périnéales ; une vidéocapsule endoscopique en l’absence de sténose à l’IRM et de signes cliniques/biologiques évocateurs d’une atteinte étendue possiblement superficielle sur le grêle et passée inaperçue en IRM ; une cholangio-IRM si une cholestase biologique est inexpliquée et répétée, à la recherche d’une cholangite sclérosante primitive (souvent associée à une RCH). Une consultation spécialisée en rhumatologie ou ophtalmologie est proposée au cas par cas sur des signes cliniques d’appel. Les principaux éléments du bilan initial d’une MICI sont résumés dans le
Quel suivi des patients ?
La surveillance s’exerce selon 2 axes : l’activité inflammatoire des MICI d’une part, grâce à des explorations non invasives, le dépistage d’éventuelles dysplasies d’autre part.
Le contrôle de l’activité inflammatoire des MICI et la cicatrisation des lésions intestinales sont le principal enjeu du traitement afin d’éviter la rechute d’une poussée et prévenir le risque d’évolution vers une complication. La protéine C-réactive est augmentée chez 80 % des patients avec une MC en poussée, mais rarement élevée dans la RCH (à l’exception des formes en poussée sévère). Dans la MC, une surveillance régulière tous les 3 à 6 mois de la protéine C-réactive (qui doit se normaliser sous traitement) est utile pour s’assurer du bon contrôle de la maladie. Elle aide, en cas d’élévation, à l’identification des patients en rémission à risque de nouvelle poussée. Un monitoring régulier (tous les 6 mois) de la calprotectine fécale permet d’interpréter une hausse non spécifique de la protéine C-réactive (inflammation extradigestive, infections ORL, bronchopulmonaires…). Une concentration < 250 µg/g suggère l’absence d’inflammation cliniquement pertinente dans le tube digestif. Outre les marqueurs inflammatoires, étant donné la fréquence de la carence en fer associée aux MICI, un dépistage régulier du bilan martial (ferritinémie) s’avère nécessaire tous les 3-6 mois s’il persiste des poussées, et tous les ans dans les périodes de rémission.4
Les imageries non irradiantes (échographie abdominale, IRM) doivent être privilégiées pour le suivi, afin d’objectiver le bon contrôle de la maladie sous traitement. En cas de suspicion de complications (occlusion intestinale, abcès), une TDM abdominale reste l’examen de référence. La vidéocapsule endoscopique du grêle peut être répétée dans les formes de Crohn non sténosantes et localisée sur l’intestin grêle en complément de l’entéro-IRM.
Par ailleurs, lorsque la MICI colique est étendue, ancienne ou associée à une cholangite sclérosante primitive, les patients sont à haut risque de cancer colorectal (CCR) . Ils doivent être inclus dans des programmes de dépistage régulier de la dysplasie et du CCR, avec des coloscopies initialement tous les 3 à 5 ans selon le risque, et ce, à partir de 8 ans d’évolution (à l’exception des proctites dont le risque est similaire à celui de la population générale), puis tous les ans. Ces coloscopies doivent être réalisées dans des conditions optimales de préparation colique, chez les patients en rémission, et en utilisant des colorants pour magnifier la détection des lésions muqueuses dysplasiques.5
Quelle surveillance en fonction des traitements ?
Cinq grandes classes thérapeutiques sont utilisées dans les MICI, à visée symptomatique uniquement : les dérivés aminosalicylés et les corticoïdes en traitement des poussées ; les immunosuppresseurs, les biothérapies et les nouvelles petites molécules (
Les dérivés salicylés (5-ASA et 4-ASA) constituent la thérapie de première ligne la plus efficace dans la RCH légère à modérée ; ils requièrent une surveillance de la fonction rénale et la recherche d’une protéinurie 2 fois par an, et ce quelle que soit la dose ou la voie d’administration (orale ou rectale). Les corticoïdes sont indiqués en cas de poussée réfractaire aux 5-ASA ou d’intensité sévère. On les utilise également pour traiter un premier épisode aigu de MC non compliquée. Leur prescription ne doit pas excéder 3 mois en raison de leurs effets indésirables.
Avant l’introduction des traitements « majeurs » (immunosuppresseurs, biothérapies) dans les formes modérées à sévères de MICI, il est recommandé de vérifier le calendrier vaccinal, idéalement à jour ; de réaliser éventuellement un contrôle du statut sérologique pour le virus de l’hépatite B (VHB) ainsi que pour celui du virus varicelle-zona (VZV) en l’absence de varicelle documentée. La vaccination annuelle contre la grippe est recommandée, de même que celle contre les pneumocoques, mais aussi l’hépatite B (en l’absence d’immunité). Il est également conseillé de vacciner contre les papillomavirus les filles et garçons (< 19 ans) et les hommes ayant des relations sexuelles avec des hommes (< 26 ans).
Sous immunosuppresseurs (azathioprine, 6-mercaptopurine, méthotrexate), une surveillance biologique régulière de l’hémogramme et des enzymes hépatiques est requise tous les 3 mois (
En cas d’échec, un dosage des taux résiduels du biomédicament et des anticorps anti-biomédicaments guide la décision d’intensifier la dose ou de changer pour un biologique de même classe, voire de classe différente. Les nouvelles petites molécules (inhibiteurs de Janus kinases : tofacitinib) qui ont récemment complété l’éventail des traitements possibles de la RCH obligent aussi à une surveillance régulière, avec un hémogramme, un bilan hépatique complet 1 à 2 mois après son initiation, puis tous les 3 mois ainsi qu’un bilan lipidique à 2 mois. Les éventuelles interactions médicamenteuses doivent être également prises en compte.
En résumé, le diagnostic des MICI est parfois complexe et repose surtout sur l’endoscopie digestive avec biopsies en cas de poussées inflammatoires digestives récurrentes. Si le patient est en rémission sous traitement, le suivi requiert une évaluation clinique et un dosage régulier de la protéine C-réactive ou de la calprotectine fécale pour dépister la rechute. L’échographie ou l’IRM sont utiles pour objectiver une poussée et évaluer son étendue et sa sévérité, voire détecter une complication.
La surveillance des risques liés aux traitements (infections, cancers) et le dépistage de la dysplasie/cancer colorectal doivent être réguliers, rigoureux et reposer sur des consultations spécialisées, un suivi biologique et des coloscopies dédiées.
Une prise en charge pluridisciplinaire des MICI est gage de succès, avec une maladie bien contrôlée sous un traitement au long cours bien toléré.
Fig. 2 Entéro-IRM : épaississement de la paroi iléale sur une iléite typique de maladie de Crohn.
2. Écarter un syndrome de l’intestin irritable (SII)
Devant des symptômes digestifs non spécifiques (diarrhée, douleurs, inconfort abdominal), la question de la différence entre une MICI débutante et un SII chez des patients jeunes se pose fréquemment. Le diagnostic d’intestin irritable, d’élimination, associe systématiquement un inconfort digestif et des troubles du transit plus ou moins invalidants, mais sans altération de l’état général, amaigrissement ou anomalies biologiques, à la différence des MICI. La distinction est parfois difficile au cours du suivi des MICI puisque l’intestin irritable est surreprésenté chez ces patients : la prévalence des symptômes de SII en cas de MICI inactive est de 39 % (soit 5 fois plus que la population générale).1
3. Médicaments potentiellement en cause dans les entérocolites iatrogènes
Diarrhée isolée
– Anti-inflammatoires non stéroïdiens
– Dérivés de l’ergot de seigle
– Contraception orale
– Digoxine
– Colchicine
Entérocolites inflammatoires « pseudo-MICI »
– AINS
– Salazopyrine et 5-ASA
– Sels d’or, sartans
– Mycophénolate mofétil, ciclosporine
– Rituximab
– Immunothérapies inhibiteurs de check-point anti-CTLA-4, PD-1, PD-1 ligand
1. Halpin SJ, Ford AC. Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2012;107:1474-82.
2. Boschetti G, Nancey S, Flourié B. Calprotectine fécale : quel intérêt ? Rev Prat Med Gen 2014;28;765-6.
3. Van Rheenen PF, Van de Vijver E, Fidler V. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. BMJ 2010;341:c3369.
4. Nancey S. Suivi non invasif des MICI. La Lettre de l’Hépatogastro- entérologue 2014;XVII:197-201.
5. Pastrenak B, Svanström H, Schmiegelow K, Jess T, Hviis A. Use of azathioprine and the risk of cancer in inflammatory bowel disease. Am J Epidemiol 2013;177:1296-305.
6. Peyrin-Biroulet L, Khosrotehrani K, Carrat F, et al. Increased risk for nonmelanoma skin cancers in patients who receive thiopurines for inflammatory bowel disease. Gastroenterology 2011;141:1621-8.
Sources d’information pour les patients
– Le Groupe d’étude thérapeutique des affections inflammatoires du tube digestif (GETAID) met à disposition des fiches explicatives sur les traitements disponibles. www.getaid.org
– L’Association François-Aupetit (AFA) se consacre à l’information et à l’accompagnement des malades souffrant de MICI et de leurs proches, au financement de la recherche sur les MICI et propose une aide aux patients (droit du travail). www.afa.asso.fr
– La fondation DigestScience de recherche sur les maladies de l’appareil digestif et la nutrition a pour vocation de proposer de l’information aux patients et au grand public sur les MICI, contribuer à la formation des professionnels de santé et soutenir des projets de recherche. www.digestscience.com

 Encadrés
Encadrés