En France, les maladies inflammatoires chroniques de l’intestin (MICI) concernent environ 300 000 personnes, selon les données de l’Assurance maladie.1 Elles comprennent la rectocolite hémorragique (RCH) et la maladie de Crohn, avec une proportion de chaque maladie à peu près égale dans notre pays. Leur spectre de sévérité est très variable : des formes minimes aux formes sévères et/ou réfractaires nécessitant une ou plusieurs chirurgies de résection intestinale et affectant considérablement la qualité de vie.
Les MICI sont en augmentation constante dans la plupart des régions du monde. Leur incidence et leur prévalence sont plus élevées dans les pays développés que dans les pays en développement, ainsi que dans les zones urbaines par rapport aux zones rurales.
Depuis le début des années 2000, l’arsenal thérapeutique s’est considérablement enrichi, avec les anti-TNF en tête. Cet essor des biothérapies s’est encore accru ces dernières années, avec l’arrivée de nouvelles classes thérapeutiques.
Poser le diagnostic de MICI
Le sex ratio des MICI est proche de 1. Le début de la maladie survient généralement entre la deuxième et la quatrième décennie de la vie, avec un pic plus faible observé entre 50 et 60 ans. Cependant, les MICI peuvent être diagnostiquées à tout âge. L’évolution se caractérise par des périodes de poussées et de rémissions. Il s’agit de maladies progressives pouvant entraîner des dommages intestinaux irréversibles.
Maladie de Crohn, une atteinte segmentaire
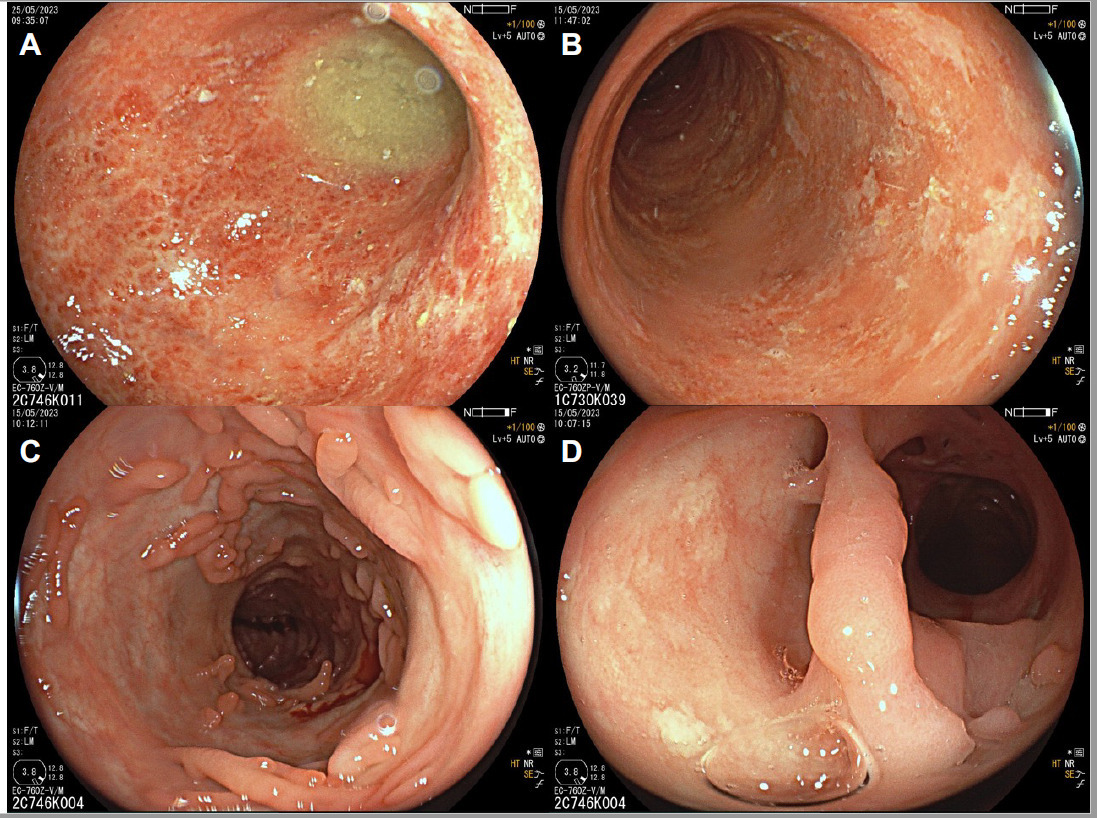
Au cours de la maladie de Crohn, tous les segments du tractus gastro-intestinal peuvent être touchés, l’iléon terminal et le côlon étant les zones les plus couramment affectées. L’inflammation se manifeste généralement de manière segmentaire, asymétrique et transmurale. La plupart des patients ont un phénotype inflammatoire au moment du diagnostic. Cependant, avec le temps, environ la moitié développent des complications telles que des sténoses, des fistules ou des abcès, nécessitant souvent une intervention chirurgicale.
La symptomatologie est en rapport avec l’organe atteint (anus, intestin grêle et/ou côlon) et peut comporter des douleurs abdominales chroniques, une perte de poids avec carences et dénutrition, ou une diarrhée chronique. L’atteinte anopérinéale est particulièrement délabrante et affecte fortement la qualité de vie, notamment la sexualité des patients.2
Rectocolite hémorragique, atteinte uniquement colorectale
La RCH, quant à elle, touche exclusivement le côlon et le rectum. Elle se caractérise par une inflammation de la muqueuse, débutant dans le rectum et s’étendant aux segments proximaux du côlon. La symptomatologie prédominante est en rapport avec l’atteinte inflammatoire et consiste essentiellement en une diarrhée associée à des rectorragies. Il peut exister des impériosités, des faux besoins, voire une incontinence, qui altèrent considérablement la qualité de vie.3
Les manifestations cliniques des MICI ne se limitent pas aux atteintes du tractus digestif. En effet, il existe, dans environ 30 % des cas, des manifestations extradigestives. Les plus fréquentes sont les atteintes articulaires inflammatoires axiales et/ou périphériques et les atteintes cutanées psoriasiformes ou eczématiformes. L’atteinte colique des MICI peut être associée à une atteinte inflammatoire des voies biliaires, la cholangite sclérosante primitive (CSP), qui entraîne non seulement un risque de cirrhose et de cholangiocarcinome mais aussi une augmentation importante du risque de cancer du côlon. Les patients atteints de MICI et de CSP doivent donc bénéficier d’un suivi spécifique et particulièrement rapproché.
Quels examens pour confirmer le diagnostic ?
Le diagnostic positif de MICI repose sur un faisceau d’arguments cliniques, biologiques, endoscopiques, histologiques et radiologiques. L’inflammation intestinale peut être authentifiée par le dosage de la calprotectine fécale et/ou de la protéine C-réactive (CRP). La carence martiale est fréquente.
L’examen du tractus digestif est mené grâce à des endoscopies digestives hautes et basses (fig. 1). Pour explorer l’intestin grêle, l’entéro-IRM est l’examen de choix, et la vidéocapsule endoscopique peut constituer une aide précieuse dans certains cas.
Au moment du diagnostic initial, il convient également d’éliminer des diagnostics différentiels, dont les principaux sont listés dans les encadrés 1 et 2. Par ailleurs, il est nécessaire de différencier les deux sous-types de MICI à l’aide des éléments divergents synthétisés dans le tableau 1.
Physiopathologie des MICI
La physiopathologie des MICI est complexe et non unique.
Chez des individus génétiquement prédisposés, il est communément accepté que les MICI résultent d’une réponse immunitaire excessive de l’hôte à son environnement – dont fait partie le microbiote.
Il existe une histoire familiale dans environ 10 % des cas. Des formes particulières monogéniques de MICI ont été également décrites ; elles sont d’autant plus fréquentes que le diagnostic est fait à un très jeune âge. Par ailleurs, plus de 200 allèles de susceptibilité aux MICI ont été découverts, donnant des pistes quant aux voies de l’inflammation impliquées. Par exemple, la découverte de gènes associés à l’interaction entre les bactéries et l’immunité innée, ainsi qu’à la fonction des cellules Th17 (NOD2, ATG16L1, LRRK2, IRGM, Il23R, HLA, STAT3, JAK2 et voies Th17), mais aussi utiles pour la production du mucus (MUC2), a apporté des connaissances importantes sur la physiopathologie des MICI.
Il existe également de nombreux facteurs environnementaux tels que l’allaitement, le contact avec des animaux mais aussi l’alimentation (risque accru associé aux aliments industriels ultratransformés). Le tabagisme est un facteur aggravant de la maladie de Crohn, et l’appendicectomie pour appendicite survenue dans l’enfance est un facteur protecteur contre la RCH.
Enfin, le microbiote joue un rôle clé dans la physiopathologie des MICI : il s’agit d’un médiateur des effets de certains facteurs environnementaux (comme l’alimentation) et est étudié comme cible thérapeutique et biomarqueur prédictif.
Prise en charge avant l’avènement des biothérapies
Traitements médicamenteux
Les traitements qui préexistaient aux biothérapies sont les corticoïdes, les aminosalicylés et les immunosuppresseurs classiques (thiopurines et méthotrexate).
À ce jour, ces traitements peuvent toujours être utiles à la prise en charge des patients ayant une MICI, mais dans un cadre différent. L’utilisation des corticoïdes est ainsi désormais limitée le plus possible dans le temps et en doses, car ils s’accompagnent d’effets indésirables majeurs ; ils sont généralement prescrits en cures très courtes pour traiter rapidement une poussée. Quant aux immunosuppresseurs, ils ne sont quasiment plus que réservés aux combothérapies ; ils sont associés à une biothérapie pour optimiser leur efficacité et diminuer le risque de survenue d’anticorps anti-biothérapie.
Ainsi, avant l’avènement des biothérapies, les options thérapeutiques étaient-elles très limitées, avec une exposition majeure et prolongée aux corticoïdes. La prise en charge s’orientait alors souvent vers une chirurgie de résection intestinale.
Résection intestinale : récidive et impact fonctionnel majeur
La chirurgie des MICI s’accompagne non seulement d’un risque de récidive élevé, même en cas de « blanchiment », lorsque toutes les parties atteintes sont retirées (environ 50 % de rechute endoscopique à un an dans la maladie de Crohn), mais également d’un retentissement fonctionnel important. C’est notamment le cas dans la chirurgie de la RCH, qui consiste en une colectomie totale avec anastomose iléo-anale (AIA) avec confection d’un réservoir iléal (néorectum). Les patients avec AIA ont en moyenne 5 ou 6 selles par jour et ont fréquemment une selle nocturne avec une grande variabilité entre les patients quant aux résultats fonctionnels. Le risque d’inflammation ultérieure sur les segments intestinaux restants est également non négligeable.
Essor des biothérapies
L’ensemble des biothérapies et des petites molécules ayant une autorisation de mise sur le marché (AMM) en France est présenté dans le tableau 2.
D’abord les anti-TNF…
Après les deux précurseurs anti-TNF que sont l’infliximab et l’adalimumab et qui ont révolutionné la prise en charge des MICI au début des années 2000, il a fallu attendre dix ans pour que d’autres biothérapies aux modes d’action différents démontrent une efficacité dans cette indication.
Le védolizumab, ciblant la migration des leucocytes, a prouvé son efficacité tout d’abord dans la RCH puis dans la maladie de Crohn et a obtenu une AMM en 2014 en France, initialement dans la RCH. Un essai, comparant directement le védolizumab et l’adalimumab chez les patients bionaïfs dans la RCH, a même démontré la supériorité du premier par rapport au second en première ligne de traitement par biothérapie.4
... puis les anti-IL et anti-JAK
Par la suite, d’autres anticorps monoclonaux ciblant une cytokine différente du TNFa ont montré une efficacité : ce sont des anti-interleukines (IL), ciblant l’IL- 12 et l’IL- 23, ou uniquement l’IL- 23. Il existe des essais de phase III positifs pour les deux modes d’action, que ce soit pour la RCH et/ou la maladie de Crohn.
Enfin, récemment, les anti-JAK (sélectifs ou non), des petites molécules administrées sous forme orale, se sont largement développés. Trois sont disponibles dans la RCH (le tofacitinib, le filgotinib et l’upadacitinib) et un seul a démontré son efficacité dans la maladie de Crohn dans un essai de phase III (l’upadacitinib).5
Choix de la molécule : une approche empirique
Malgré la disponibilité de nombreuses biothérapies et de petites molécules, la prise en charge n’est pas standardisée. Le choix du traitement dépend de nombreux facteurs liés aux caractéristiques de la maladie et/ou au terrain du patient. Ainsi, les données d’efficacité mais aussi de sécurité des traitements sont-elles finement évaluées. Malgré tout, la prise en charge consiste principalement en une approche empirique de cycling, consistant à les prescrire successivement sans pouvoir présager de leur efficacité. Ils possèdent tous des taux de réponse relativement similaires, de l’ordre de deux tiers de réponse et un tiers de non-réponse.
Le choix du traitement peut également être guidé par la présence d’une seconde affection immunomédiée. Par exemple, chez un patient ayant une MICI et une spondylarthropathie axiale, les anti-TNF et les anti-JAK sont privilégiés.
En France, les gastroentérologues sont particulièrement contraints par le cadre des remboursements pour la première ligne des biothérapies. Ainsi, pour la RCH, seuls les anti-TNF et le védolizumab peuvent être prescrits. En première ligne de biothérapie dans la maladie de Crohn, seuls les anti-TNF sont remboursés. Ce cadre restreint diffère de celui de nombreux pays comme les États-Unis ou l’Allemagne qui ont un libre choix de molécules, quelle que soit la ligne. Les instances françaises justifient cette décision par l’absence d’essai face-face comparant directement les molécules entre elles, au profit d’essais de phase III contre placebo permettant d’obtenir les AMM des agences européenne (European Medicines Agency) et américaine (Food and Drug Administration).
Vers une diminution des actes chirurgicaux
L’ère des biothérapies et leur utilisation de plus en plus large ont été associées à une baisse du recours à la prise en charge chirurgicale.6 En effet, dans les cas où l’urgence et/ou des complications ne l’imposent pas, le médecin est moins souvent limité dans les recours thérapeutiques.
Un suivi personnalisé selon l’atteinte et le traitement
L’essor des biothérapies s’est accompagné d’une amélioration de la prise en charge, avec notamment une diminution du recours à la chirurgie.
Leur utilisation induit néanmoins une augmentation du risque de certains effets indésirables, et donc la nécessité d’un bilan préthérapeutique et d’une surveillance particulière.
Par exemple, il existe un risque accru d’infection à mycobactérie avec les anti-TNF.7 Ainsi, un dépistage de la tuberculose latente par QuantiFERON et radiographie du thorax doit être réalisé avant l’initiation du traitement.
De même, il existe un risque de mélanome, ce qui impose un suivi régulier par un dermatologue.
D’autres surveillances spécifiques doivent être mises en place, selon les molécules, comme une mesure du bilan lipidique complet sous anti-JAK.
En outre, la gestion des vaccinations est centrale, avec la nécessité de respecter le calendrier vaccinal standard mais également d’être protégé contre l’hépatite B, le pneumocoque (rappel tous les 5 ans) et contre la grippe saisonnière.
Les patients ayant une MICI avec atteinte colique sont également plus à risque de développer un cancer du côlon, imposant une surveillance endoscopique régulière : de tous les ans à tous les cinq ans, en fonction de la présence ou non de facteurs de risque dont le principal est la coexistence d’une cholangite sclérosante primitive.
Concernant la surveillance de l’efficacité, outre la clinique, la biologie, les endo-scopies et l’entéro-IRM, le dosage de la calprotectine fécale s’est considérablement développé et s’impose comme un outil fiable et non invasif de surveillance et de prédiction de poussées.8
Que dire à vos patients ?
L’AFA Crohn RCH est une association de patients très active : www.afa.asso.fr
La maladie de Crohn peut se compliquer sur le long terme, du fait de la maladie elle-même et/ou des traitements, nécessitant un suivi rigoureux et à vie.
Il existe peu de données de haut niveau de preuve scientifique concernant l’alimentation. Le principal consensus est d’éviter les aliments industriels ultratransformés.
À ce jour, aucune donnée n’a démontré l’intérêt des probiotiques.
1. Principaux diagnostics différentiels de la rectocolite hémorragique
- Colite infectieuse : bactérienne, virale, fongique (histoplasmose), mycobactérienne et Clostridium difficile
- Colite ischémique
- Colite segmentaire associée à la diverticulite
- Rectite radique
- Colite induite par les médicaments (en particulier les anti-inflammatoires non stéroïdiens)
- Maladie de Crohn
- Infections sexuellement transmissibles (en particulier chez les patients atteints de rectite ayant eu des rapports sexuels anaux) : Chlamydia trachomatis, Neisseria gonorrhoeae, herpès et syphilis
- Si le symptôme prédominant est la diarrhée et non les saignements : maladie cœliaque, colite microscopique, intolérances au lactose et syndrome de l’intestin irritable
2. Principaux diagnostics différentiels de la maladie de Crohn
- Entérites et/ou colites infectieuses : Yersinia, C. difficile
- Ischémie mésentérique chronique
- Tuberculose intestinale
- Entérite radique
- Colite microscopique
- Rectocolite hémorragique
- Maladie de Behçet
- Entéropathie associée aux anti-inflammatoires non stéroïdiens
2. Torres J, Mehandru S, Colombel J-FF, et al. Crohn’s disease. Lancet 2017;389(10080):1741-55.
3. Ungaro R, Mehandru S, Allen PB, et al. Ulcerative colitis. Lancet 2017;389(10080):1756-70.
4. Sands BE, Peyrin-Biroulet L, Loftus EV, et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis. N Engl J Med 2019;381(13):1215-26.
5. Loftus EV, Panés J, Lacerda AP, et al. Upadacitinib Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med 2023;388(21):1966-80.
6. Frolkis AD, Dykeman J, Negrón ME, et al. Risk of surgery for inflammatory bowel diseases has decreased over time: A systematic review and meta-analysis of population-based studies. Gastroenterology 2013;145(5):996-1006.
7. Kirchgesner J, Lemaitre M, Carrat F, et al. Risk of Serious and Opportunistic Infections Associated With Treatment of Inflammatory Bowel Diseases. Gastroenterology 2018;155(2):337-346.e10.
8. Turner D, Ricciuto A, Lewis A, et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021;160(5):1570-83.

 Encadrés
Encadrés