La recherche en génétique, microbiomique et autres technologies « omiques » ouvre des perspectives très intéressantes de dépistage de précision. En attendant que ces nouveaux outils permettent la mise en oeuvre d'un dépistage personnalisé efficient du cancer colorectal (CCR), la mesure du taux d'hémoglobine fécale par test immunochimique quantitatif s'avère la méthode la plus efficace pour évaluer le risque de CCR. Toutefois, les niveaux de risque sur lesquels reposent les recommandations françaises de dépistage doivent être actualisées. Trois propositions pour optimiser le dépistage.
Avec plus de 43 000 nouveaux cas et 17 000 décès en 2018 en France, le cancer colorectal (CCR) est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.1 Bon nombre de ces CCR et de ces décès sont évitables. Le principal facteur pronostique est le stade au diagnostic : 90 % de survie à cinq ans en cas de stade localisé et 14 % en cas de stade métastatique.2 Le dépistage précoce est facilité par un processus de carcinogenèse relativement lent, s’étalant sur dix à quinze ans. Plusieurs essais contrôlés randomisés ont démontré que le dépistage par recherche de sang occulte dans les selles et par rectosigmoïdoscopie permettait de diminuer la mortalité par CCR, voire son incidence.3 Dans notre pays, les recommandations de dépistage reposent sur le cahier des charges du programme national de dépistage organisé (DO) du CCR, actualisé périodiquement : la population âgée de 50 à 74 ans, asymptomatique et à risque moyen, est invitée tous les deux ans à participer au programme de DO par test immunochimique fécal (TIF) quantitatif de recherche de sang occulte ; la population à risque élevé et très élevé relève d’un dépistage opportuniste (ou individuel) par coloscopie.
Ces recommandations s’appuient sur trois niveaux de risque de CCR – moyen, élevé et très élevé – dont la définition est inchangée depuis 2002.4, 5 Or les connaissances ont évolué, de sorte que des incohérences sont apparues dans les recommandations françaises. Par exemple, il est démontré qu’un individu n’ayant qu’un ou deux adénomes mesurant moins de 10 mm en dysplasie de bas grade réséqués lors d’une coloscopie est à risque faible de CCR et peut réintégrer le programme de DO par TIF au lieu d’une surveillance coloscopique « à vie ».6, 7 Les indications de coloscopie reposent sur des recommandations de 2004 n’intégrant ni certaines maladies ou situations sources d’un sur-risque de CCR (telles que mucoviscidose, radiothérapie et survivant de cancer pédiatrique) ni l’utilisation du TIF.7, 8
Les progrès récents en cancérologie nous apprennent que le CCR est une entité très hétérogène : il n’y a pas un CCR mais de nombreux sous-types de CCR aux causes et caractéristiques propres. Chaque CCR est génétiquement et épigénétiquement unique. La meilleure connaissance des anomalies moléculaires des sous-types de CCR et de leurs facteurs de risque spécifiques est à l’origine du concept de médecine de précision, à la fois pronostique, thérapeutique (permettant de proposer un traitement « à la carte ») et préventive, avec l’objectif de proposer à chacun une stratégie personnalisée de prévention et de dépistage associée à une balance bénéfices-risques optimale. Si la médecine de précision a déjà des applications en pratique courante dans le traitement du CCR, elle n’en a pas encore dans le domaine de la prévention et du dépistage du CCR (sauf les rares syndromes de prédisposition héréditaire au CCR) et pourrait même avoir un effet délétère.9-11 On distingue trois niveaux de prévention : primaire (éviter l’apparition de la maladie, en réduire l’incidence), secondaire (la dépister à un stade précoce pour en faciliter le traitement) et tertiaire (éviter les complications et récidives). Cet article a pour objectif de faire le point sur les connaissances actuelles en matière d’évaluation du niveau de risque de CCR d’un individu, sur les recommandations spécifiques de dépistage en cas de risque accru et sur les opportunités, actuelles et futures, offertes en dépistage personnalisé.
Comment affiner l’évaluation du risque de CCR ?
L’interrogatoire permet de colliger l’ensemble des facteurs de risque et protecteurs d’un individu et de définir son niveau de risque clinique et anamnestique de CCR.7 Cette évaluation reste relativement grossière, et il est tentant d’essayer de l’affiner : biomarqueurs et scores de risque sont les principales voies de recherche.
De multiples biomarqueurs à l’étude
De très nombreux biomarqueurs font l’objet de recherches.12 Non invasifs, leur vocation est d’éviter des coloscopies invasives. Ils doivent donc offrir une très grande spécificité en sus d’une grande sensibilité pour la détection des stades précoces de CCR et de ses précurseurs. Leur acceptabilité est aussi déterminante. Si l’acceptabilité des tests fécaux est moindre que celle des tests sanguins, les anomalies liées au CCR et à ses précurseurs sont plus précocement détectables dans les selles que dans le sang : le flux fécal emporte avec lui un flot continu de cellules néoplasiques exfoliées en cas de CCR ou d’adénome ; au contraire, l’apparition de biomarqueurs dans le sang est plus tardive, car elle dépend du processus d’angiogenèse tumorale. Les altérations épigénétiques, précoces et plus fréquentes que les altérations génétiques dans la carcinogenèse colorectale, sont des biomarqueurs de choix, principalement méthylation aberrante de gènes et micro-ARN. Chaque CCR étant unique, aucune anomalie génétique ou épigénétique n’est universellement présente dans les CCR. Aussi, pour accroître au maximum leur sensibilité, est-il nécessaire de recourir à des biomarqueurs couvrant des panels de plusieurs altérations génétiques et épigénétiques parmi les plus fréquentes. Seuls sont évoqués les biomarqueurs ayant passé l’étape de la recherche fondamentale et évalués sur des séries significatives.
Dans les selles
Hémoglobine
C’est le biomarqueur le mieux évalué.3, 13, 14 Aucun critère clinique ou anamnestique n’a de pouvoir discriminant supérieur au taux d’hémoglobine fécale (THF), tel que mesuré par un TIF quantitatif, pour évaluer le risque de CCR. Au seuil de positivité de 30 µg/g adopté par le programme français de DO, il offre une sensibilité d’environ 65-70 % pour le diagnostic de CCR, avec un taux de positivité de 3,9 %. Nous avons proposé, dans un article publié dans la revue Hépato-gastro & oncologie digestive en février 2022, d’abaisser le seuil de positivité à 20 µg/g, ce qui augmenterait la sensibilité autour de 69-75 % pour un taux de positivité de 5,3 %, compatible avec les capacités françaises de coloscopies.14 La spécificité est excellente, de 95-96 % pour ces seuils de positivité. Qui plus est, le THF a une valeur pronostique, y compris pour des valeurs très faibles, inférieures à la plage de mesure du fabricant (10 µg/g). Il est démontré que le THF mesuré lors d’un TIF négatif (inférieur au seuil de positivité du programme) est corrélé au risque de futurs CCR, néoplasie et néoplasie colorectale avancée.14 Cette propriété offre des perspectives de dépistage personnalisé jamais exploitées à ce jour.14
ADN et ARN
Un test fécal ADN multi-cibles est commercialisé aux États-Unis depuis 2014 (Cologuard). Il recherche la présence de mutations de KRAS, de méthylations aberrantes de NDRG4 et BMP3, de β-actine et de l’hémoglobine. Il offre une excellente sensibilité pour le diagnostic de CCR, supérieure à celle du TIF (92 % versus 74 %), au prix d’une spécificité moindre. Son grand nombre de faux positifs, sa complexité et son coût sont autant de freins pour une utilisation en population.12
Les micro-ARN sont des régulateurs post-transcriptionnels dont la dérégulation participe à la carcinogenèse colorectale. Ils sont détectables dans les selles et le sang. Plusieurs profils de micro-ARN dérégulés associés significativement à la présence d’un CCR ont été décrits. Leurs performances diagnostiques restent modestes à ce jour.12
Protéines
Parmi les protéines fécales associées au CCR, la M2-pyruvate kinase (M2-PK) a été la plus étudiée. Une méta-analyse a montré la supériorité du TIF sur le dosage de M2-PK pour le diagnostic de CCR, la spécificité de ce dernier étant notamment insuffisante.12
Signature microbienne
Le microbiote intestinal est à l’interface entre environnement et muqueuse colorectale. Certains facteurs de risque environnementaux, en particulier alimentaires, induisent des modifications du microbiote intestinal et de ses fonctions métabolique et immunitaire.15 Cette dysbiose (déséquilibre pathologique quantitatif, qualitatif et fonctionnel du microbiote intestinal) permet aux facteurs de risque environnementaux d’initier et de promouvoir la carcinogenèse colorectale (inflammation chronique, métabolites carcinogènes…). Elle intervient précocement dès la formation de lésions adénomateuses précancéreuses.15 Il est acquis que CCR et adénome sont associés à une dysbiose permettant de définir une signature bactérienne fécale relativement spécifique, avec en particulier un enrichissement en bactéries issues de la cavité buccale associées aux maladies parodontales.16 Par exemple, plusieurs études ont montré des taux significativement plus élevés de Fusobacterium nucleatum dans les selles de patients porteurs d’adénome ou de CCR par rapport aux personnes saines contrôles. La combinaison de la mesure du THF à la quantification d’une ou plusieurs bactéries fécales, en particulier F. nucleatum, augmente significativement la sensibilité et l’aire sous la courbe ROC (receiver operating characteristic) pour le diagnostic de CCR par rapport à la mesure du THF seule.17 Une revue de la littérature a montré que la plupart des modèles prédictifs fondés sur des marqueurs microbiens ont un pouvoir discriminant satisfaisant (aire sous la courbe ROC > 0,7, voire 0,8).15, 16
Dans le sang
ADN et ARN
Divers produits issus du CCR peuvent être détectés dans le sang, le mieux étudié étant l’ADN tumoral circulant (ADNtc) qui correspond au relargage d’ADN par les cellules tumorales dans la circulation sanguine. Le mieux évalué est le test Septin9, qui recherche une méthylation aberrante du gène SEPT9. Ses sensibilité et spécificité pour le diagnostic de CCR sont cependant inférieures à celles du TIF, insuffisantes pour une utilisation en population (69 % et 92 % respectivement, performances moindres pour les stades précoces que pour les stades évolués).12
D’autres tests détectant la dérégulation de panels de micro-ARN ou une méthylation aberrante d’autres gènes impliqués dans la carcinogenèse colorectale sont en cours d’évaluation.
Protéines
Il n’est pas inutile de rappeler que le dosage d’antigène carcino-embryonnaire (ACE) n’est d’aucun intérêt pour le dépistage et le diagnostic du CCR. En revanche, les taux sériques de deux types de lécithine (sDC-SIGN et sDC-SIGNR) semblent offrir de bonnes sensibilité et spécificité pour le diagnostic de CCR.12
Composés organiques volatils
Les composés organiques volatils (COV) sont un ensemble de substances dont le point commun est de s’évaporer rapidement à température ambiante. Chez l’être humain, ils sont issus des processus métaboliques physiologiques et pathologiques et sont détectables à partir de tout prélèvement biologique : air expiré, urines, selles, sang, etc. Plusieurs études pilotes ont montré l’existence de profils spécifiques comportant plusieurs COV associés à différentes pathologies, dont les cancers, CCR et ses précurseurs compris (cette propriété a d’ailleurs été utilisée pour dépister certains cancers grâce au flair de chiens entraînés).11, 18 Ces études rapportent des aires sous la courbe ROC variant de 0,67 à 0,98 et des sensibilités situées entre 63 % et 100 % pour le diagnostic de CCR.18 Une étude a montré que la détection de COV urinaires permettait d’augmenter le nombre de CCR détectés chez des personnes ayant un TIF négatif.11 Ces résultats sont très préliminaires : il n’y a pas de COV unique signature du CCR mais toujours un panel de plusieurs COV, différents selon les études ; les échantillons analysés varient (air expiré, urines, selles, sang) et les techniques d’analyse sont sophistiquées et non standardisées. Le développement de nez électroniques facilitera probablement le transfert de cette approche diagnostique à la pratique courante.18
Des scores de risque différents selon la présence ou non de symptômes
Pour affiner le niveau de risque de CCR d’un individu, de nombreux scores ont été élaborés pour guider le clinicien dans deux situations : chez les personnes asymptomatiques pour personnaliser le mode de dépistage adapté à chacun en matière de balance bénéfices-risques, et chez les personnes symptomatiques pour trier les personnes à risque négligeable des personnes à risque élevé qui doivent être référées au gastroentérologue en vue d’une coloscopie (et définir son degré d’urgence). Ces scores sont plus ou moins complexes, combinant biomarqueurs, symptômes, facteurs de risque environnementaux, comportementaux, anamnestiques et génétiques. Leurs performances sont toujours nettement supérieures pour le diagnostic de CCR que pour celui de ses précurseurs.
Chez les personnes asymptomatiques, le pouvoir discriminant des scores cliniques est au maximum acceptable (aire sous la courbe ROC > 0,7), toujours inférieur à celui du THF (aire sous la courbe ROC = 0,84).19 Les scores mixtes, associant THF et facteurs de risque cliniques tels que sexe, âge, indice de masse corporelle, antécédents familiaux, antécédent de dépistage et tabagisme, offrent un pouvoir discriminant à peine supérieur à celui du THF seul.20 Un modèle associant deux micro-ARN fécaux, le THF, le sexe et l’âge offre une aire sous la courbe ROC de 0,9 pour le diagnostic de CCR.21 L’adjonction de facteurs de risque génétiques aux scores cliniques améliore discrètement leur pouvoir discriminant, qui reste modeste.22 En sus des mutations à haute pénétrance des gènes des syndromes de prédisposition héréditaire au CCR, les études d’association pangénomique (genome-wide association study [GWAS]) ont identifié de nombreux polymorphismes nucléotidiques (SNP, variation d’une seule paire de bases) associés au risque de CCR (plus de 150 à ce jour). Ceux-ci n’expliquent cependant qu’une faible fraction des facteurs génétiques en cause, la grande majorité d’entre eux restant à identifier. Plusieurs scores de risque polygéniques ont été élaborés à partir de ces polymorphismes nucléotidiques associés au risque de CCR. Leur pouvoir discriminant, supérieur à celui des antécédents familiaux, reste modeste (aire sous la courbe ROC < 0,7).22 Malgré leurs performances prometteuses, l’utilité clinique de tous ces scores de risque n’a jamais été démontrée.10 Ils restent du domaine de la recherche.
Chez les personnes symptomatiques (signes digestifs bas ou généraux), des scores de risque de CCR ont été élaborés pour rendre plus objectif et rationnel le recours à la coloscopie, principalement au Royaume-Uni où les ressources sont limitées. Une revue récente fait le point sur cette question.13 Les performances des scores associant THF et facteurs cliniques sont légèrement supérieures à celles des scores symptomatiques. Cependant, le THF seul semble offrir un pouvoir discriminant au moins équivalent à celui des scores plus complexes.23
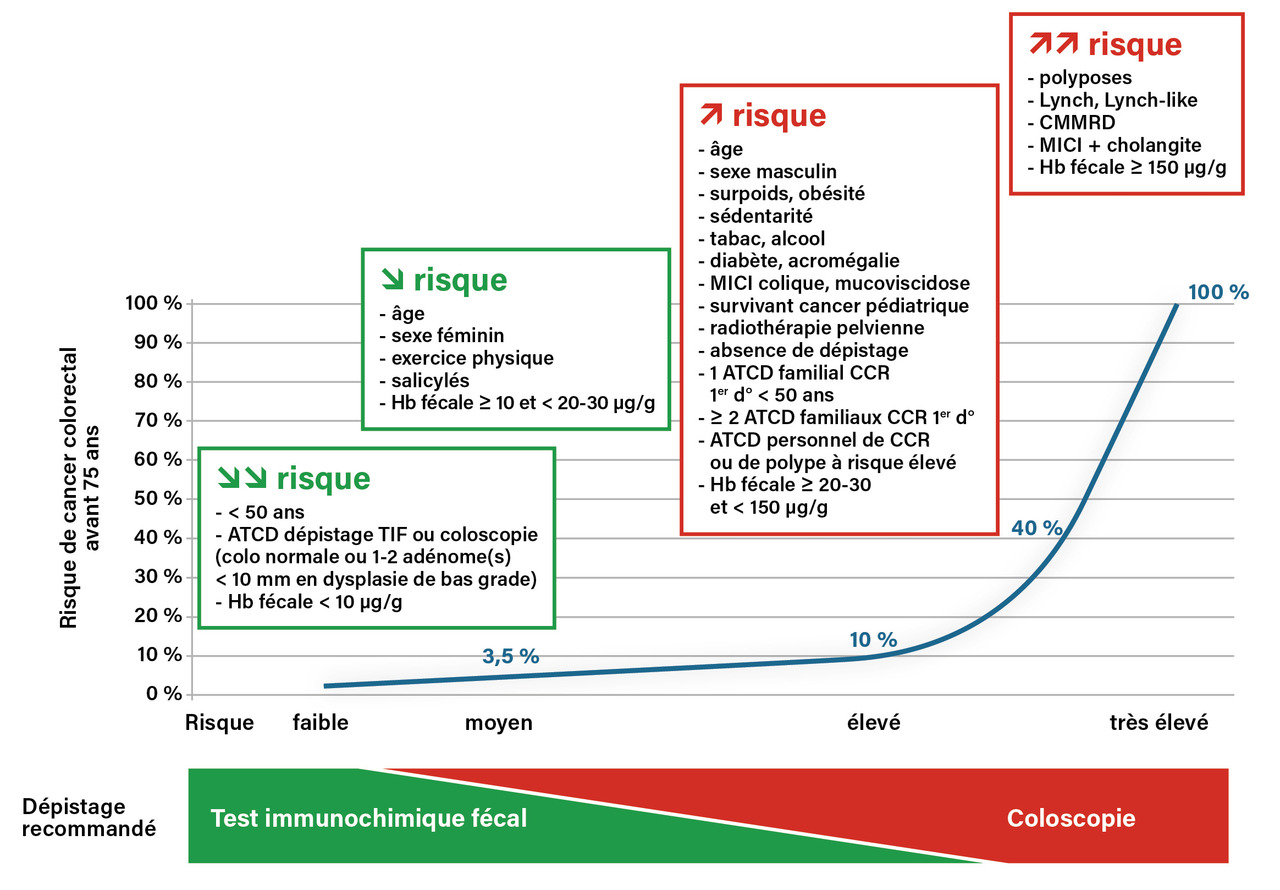
Une nouvelle classification des niveaux de risque de CCR est nécessaire
Le risque moyen correspond par définition au risque de la population générale. Dans notre pays, le risque cumulé moyen d’être atteint de CCR avant 75 ans est de l’ordre de 3,5 %. Il diminue avec la cohorte de naissance : 4,1 % chez l’homme et 2,5 % chez la femme pour les personnes nées en 1945 (3,8 % et 2,4 % respectivement pour celles nées en 1950).1 La classification habituelle de la population en trois niveaux de risque de CCR – moyen, élevé et très élevé – telle qu’utilisée depuis 2002 pour définir la population cible du programme français de DO du CCR et rappelée dans les recommandations françaises de la Haute Autorité de santé (HAS) en 2017 est obsolète.4, 5 Elle est fausse pour ce qui est des antécédents personnels et familiaux de néoplasme colorectal, incomplète, ne tenant pas compte des facteurs anamnestiques, environnementaux, comportementaux et de certaines situations à risque accru (telles que mucoviscidose, radiothérapie et survivants d’un cancer pédiatrique) et simpliste car il existe un continuum de risques du plus faible au plus élevé. Le niveau de risque élevé n’a pas de définition ni de seuils précis : il correspond à un risque intermédiaire entre risque moyen et très élevé, ce dernier n’ayant pas non plus de seuil établi (d’environ 15 à 100 %).
Une nouvelle classification schématique en quatre groupes est proposée (
Des recommandations de dépistage adaptées en cas de risque accru de CCR
Les recommandations en vigueur sont résumées dans le
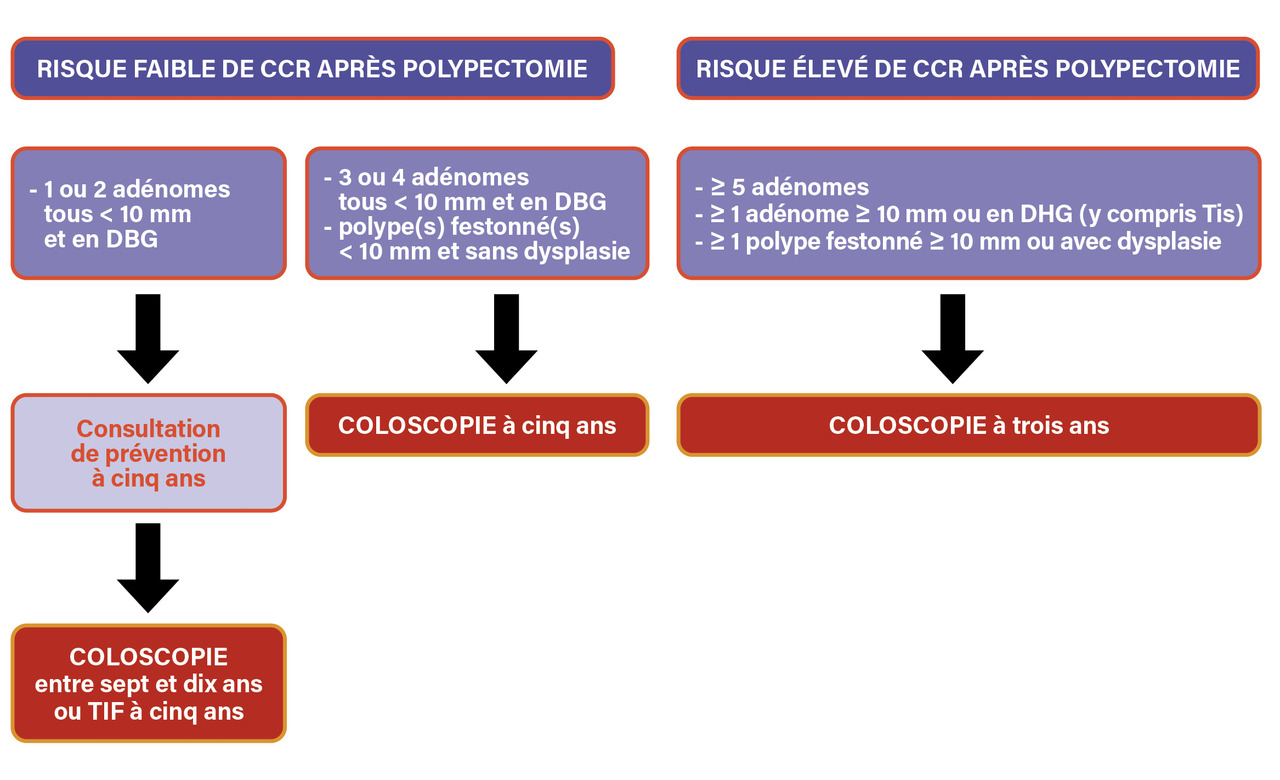
Des recommandations contradictoires en cas d’antécédent personnel de polype ou de CCR
Les recommandations professionnelles françaises de surveillance après polypectomie colique, récemment actualisées, stipulent qu’une personne ayant un ou deux adénome(s) mesurant moins de 10 mm en dysplasie de bas grade ne doit plus être surveillée par coloscopie, mais revenir à un examen de dépistage : soit TIF à cinq ans, soit coloscopie à sept à dix ans (
Ces nouvelles recommandations professionnelles, issues des recommandations européennes et proches des autres recommandations internationales, sont en contradiction avec celles de la HAS de 2013 et du cahier des charges du programme de DO du CCR qui excluent définitivement du DO par TIF toute personne ayant eu une polypectomie (sauf polype hyperplasique).4, 5
Cette situation qui met les acteurs de terrain en porte-à-faux n’est pas isolée, la HAS n’actualisant pas aussi souvent qu’il le faudrait ses recommandations au gré des nouvelles connaissances.
Des recommandations variables selon les pays en cas d’antécédents familiaux de CCR
Les recommandations européennes de 2019 restreignent la notion de risque élevé significatif (multiplié par 3) lié à des antécédents familiaux à deux situations : soit un parent au 1er degré atteint de CCR avant 50 ans, soit deux parents au 1er degré atteints de CCR quel que soit l’âge.24 Le dépistage par coloscopie est impératif dans ces cas (
Dépistage par coloscopie chez les patients irradiés jeunes
Un dépistage par coloscopie dix ans après la radiothérapie semble pertinent chez les patients irradiés jeunes, singulièrement les femmes traitées pour cancer du col utérin (incidence maximale vers 30-35 ans).
Première coloscopie à 45 ans après un cancer du sein survenu avant 50 ans
Les femmes atteintes de cancer du sein relèvent du programme de DO du CCR par TIF à partir de 50 ans, à l’exception de celles dont le cancer du sein survient avant l’âge de 50 ans à qui on peut proposer un premier dépistage du CCR par coloscopie à 45 ans.
Dépistage par TIF avant transplantation d'organe
Malgré un risque de CCR modérément accru et un pronostic plus péjoratif, les recommandations françaises de dépistage du CCR dans le bilan prétransplantation sont celles de la population générale, soit un TIF bisannuel à partir de 50 ans, sauf autre facteur de risque ajouté (HAS 2015).
Une nécessaire évolution des recommandations de dépistage et du programme français de dépistage organisé
Les recommandations françaises de dépistage du CCR en vigueur sont en partie obsolètes. Nous proposons de nouvelles modalités de dépistage selon une classification pragmatique en deux groupes :
– dépistage impératif par coloscopie ;
– dépistage au choix, par TIF préférentiellement ou par coloscopie (
Il est démontré que le fait d’offrir la possibilité de choisir son mode de dépistage, soit d’emblée (choix entre deux tests), soit de façon séquentielle (offrir une alternative en cas de refus d’un test), augmente significativement le taux de personnes dépistées.27 Il n’y a pas de test de dépistage meilleur qu’un autre : le meilleur est celui qui est effectivement réalisé. L’essentiel est de se faire dépister quel que soit le test. Il est impossible de définir une frontière précise entre risque moyen et risque élevé. Il n’y a donc pas d’erreur à proposer à une personne à risque élevé ou soi-disant élevé de se faire dépister par TIF, de même qu’il n’y a pas d’erreur à proposer un dépistage par coloscopie à une personne à risque moyen. Seules certaines personnes à risque élevé et toutes celles à risque très élevé relèvent impérativement d’un dépistage et d’une surveillance régulière par coloscopie (
Il est paradoxal et contre-productif que les personnes les plus à risque de CCR relèvent des aléas d’un dépistage opportuniste (ou individuel) et soient exclues du programme de DO et des avantages liés (invitations périodiques systématiques, relances, suivi, assurance qualité…).28 C’est d’ailleurs une exception française : la plupart des programmes de DO invitent toute la population de la tranche d’âge concernée à se faire dépister, le choix de la modalité optimale de dépistage adaptée à chaque individu étant effectué secondairement après entretien avec un professionnel de santé (évaluation du niveau de risque, information personnalisée, consentement éclairé…).
Les centres régionaux de coordination des dépistages des cancers (CRCDC) sont les mieux placés pour gérer une telle organisation dédiée, encore faudrait-il qu’ils disposent d’un système d’information intelligent qui réunisse toutes les informations pertinentes et nécessaires (médecin traitant, coloscopies des établissements de santé, analyses histologiques des laboratoires d’anatomie pathologique, remboursements de l’Assurance maladie, voire comptes-rendus des réunions de concertation pluridisciplinaire et informations colligées par les registres des cancers…).28 De même, certaines personnes actuellement exclues du programme de DO pourraient/devraient le rejoindre : antécédents personnel de 1 ou 2 adénome(s) < 10 mm en dysplasie de bas grade, antécédents familiaux de CCR et d’adénome, personnes symptomatiques. Pour ces dernières, seuls les symptômes digestifs bas ou généraux anciens (troubles fonctionnels intestinaux) ou récents qui se prolongent au-delà de deux à quatre semaines malgré le traitement symptomatique relèvent du TIF.13 Les symptômes digestifs aigus ne sont en aucun cas une indication de TIF. Chez une personne avec symptômes récents qui se prolongent, le seuil de positivité devrait être abaissé à 10 µg/g, voire 4 µg/g.13
Il est aberrant que les TIF qualitatifs soient encore utilisés et remboursés et que l’utilisation des TIF quantitatifs soit exclusivement réservée au programme de DO du CCR.13 Les arguments des autorités sanitaires en faveur de l’exclusivité (traçabilité des TIF du DO, participation au DO, économies…) ne sont plus recevables. Vaut-il mieux rembourser des TIF qualitatifs de mauvaise qualité et des coloscopies normales, que des TIF quantitatifs évalués et fiables ?13 La participation au programme français de DO du CCR, la plus faible d’Europe occidentale, peut-elle être pénalisée plus encore par l’extension encadrée des TIF quantitatifs à d’autres indications validées ?28
Actuellement, le laboratoire Cerba, appliquant les recommandations du fabricant, ne rend pas les résultats de THF < 10 µg/g en dessous du seuil de linéarité du test OC Sensor. En fait, ces valeurs sont parfaitement exploitables et pourraient/devraient être exploitées. Encore faudrait-il que médecins généralistes et gastroentérologues apprennent à les interpréter.13
Les données de participation au programme de DO du CCR publiées chaque année par Santé publique France sont trop restrictives, ignorant la fraction de population dépistée par endoscopie (coloscopie ou rectosigmoïdoscopie). La publication des taux de couverture serait plus pertinente (taux de personnes à jour pour un dépistage du CCR quel qu’il soit, TIF ≤ 2 ans ou coloscopie ou rectosigmoïdoscopie ≤ 10 ans). Il varie selon les régions, situé autour de 55 % pour la France entière.14 Un Français sur deux n’est donc pas dépisté.
À terme, la médecine de précision pour personnaliser le dépistage du CCR
La plupart des facteurs de risque connus n’augmentent que de 10 à 50 % le risque relatif de CCR, rares sont ceux qui le doublent.10 Ces augmentations statistiquement significatives à l’échelle de populations ne se traduisent pas par un risque absolu élevé à l’échelle de l’individu. Par exemple, tenir compte du seul tabagisme pour définir un risque élevé conduirait à réaliser une coloscopie à 1 000 personnes pour dépister 7 CCR au lieu de 6.10 Les scores de risque actuels, cliniques et génétiques, et les nouveaux biomarqueurs ne font pas mieux. En outre, leur complexité (scores cliniques) et leur coût (scores polygéniques, nouveaux biomarqueurs) sont autant de freins pour une utilisation courante. La plupart des biomarqueurs et des scores ont été évalués par de petites études cas-témoins. Ils doivent être validés par de grandes études prospectives en population. De plus, leurs faisabilité, acceptabilité et coût-efficacité doivent être évalués et comparés aux stratégies de dépistage établies.10, 11 Sous réserve de progrès significatifs, ils pourraient être utilisés à terme pour personnaliser les modalités de dépistage, en particulier avancer l’âge au premier dépistage chez les individus à risque significativement plus élevé que celui de la population générale. De plus, une personne informée d’un éventuel sur-risque significatif de CCR pourrait être sensibilisée et mieux adhérer à un programme de dépistage personnalisé.10, 11 À l’inverse, cette information pourrait avoir des effets psychologiques néfastes.11
Dans l’attente, un simple interrogatoire est suffisant pour déterminer si une personne relève d’un dépistage par coloscopie ou par TIF, et la mesure du THF s’avère l’outil le plus discriminant pour évaluer le risque de CCR d’un individu, symptomatique ou non (à l’exception des personnes qui relèvent d’une coloscopie impérative [tableau 2]). Seul le THF semble suffisant, au point qu’il apparaît incohérent d’évaluer le niveau de risque de CCR d’un individu sans mesurer son THF. Ce serait comme calculer un risque d’accident cardiovasculaire sans mesurer ni la tension artérielle ni le cholestérol plasmatique.14 Qui plus est, le dépistage par TIF pourrait être personnalisé, adapté au niveau de risque de CCR de chacun, à relativement brève échéance, avant que les nouveaux biomarqueurs et autres scores ne soient disponibles.
Aujourd’hui, tous les programmes de DO du CCR sont de taille unique (mêmes seuil et périodicité pour tous) et n’exploitent pas les résultats des mesures itératives de THF. Ce faisant, les femmes et les plus jeunes sont désavantagés.14 Certains pays nordiques ont adopté un seuil de positivité plus faible chez la femme, pour corriger les inégalités entre sexes.14 D’autres ont évalué la possibilité d’exploiter les mesures de THF lors de TIF négatifs itératifs. Des THF situés immédiatement sous le seuil de positivité (30 µg/g) ou augmentant régulièrement pour s’en approcher pourraient conduire soit à rapprocher la date du prochain TIF à six ou douze mois au lieu de vingt-quatre, soit à proposer une coloscopie sans attendre que le seuil de 30 µg/g soit franchi. À l’inverse, des THF régulièrement < 2 µg/g, témoignant d’une hémoglobine réellement indétectable, permettraient de retarder la date du prochain TIF à trois ans ou plus.14
Enfin, il est possible qu’un score mixte associant THF successifs et un petit nombre de facteurs de risque cliniques faciles à colliger, tels que sexe, âge et antériorité en matière de dépistage, offre un pouvoir discriminant supérieur à celui du THF seul.13, 20, 29 Ce score mixte reste à élaborer, valider et son utilité clinique (efficience, coût-efficacité) à démontrer.
Nouvelles classification et organisation du dépistage pour améliorer l’efficience
Il est bien trop tôt pour qu’une médecine de précision autorise un dépistage personnalisé efficient du CCR. La recherche en génétique, microbiomique et dans toutes les technologies « omiques », dopée par l’intelligence artificielle et l’apprentissage machine, ouvre néanmoins des perspectives très intéressantes. Un test, autre que fécal, à la fois sensible et très spécifique, serait le Graal pour accroître la proportion notoirement insuffisante de personnes dépistées pour le CCR dans notre pays.28 Une fois développé, encore faudra-t-il qu’il fasse la preuve de son utilité clinique : réduction coût-efficace de mortalité et d’incidence du CCR en population générale. Dans l’attente, les niveaux de risque sur lesquels reposent les recommandations françaises actuelles de dépistage du CCR sont en partie obsolètes.
Nous proposons donc une nouvelle classification pragmatique de la population en deux groupes définis selon leur modalité optimale de dépistage : soit coloscopie impérative, soit choix éclairé entre TIF préférentiel et coloscopie. De plus, une nouvelle organisation du programme de DO du CCR pourrait inclure les personnes à risque élevé au lieu de les exclure. Enfin, nous insistons sur le potentiel inexploité des TIF quantitatifs qui devraient remplacer les TIF qualitatifs et être accessibles sur prescription médicale pour utilisation diagnostique chez les personnes symptomatiques et dépistage hors du cadre de la population cible du programme actuel de DO : personnes à risque soi-disant élevé, personnes de moins de 50 ans ayant un ou plusieurs facteurs de risque établis, familiaux, environnementaux ou comportementaux ou de plus de 74 ans sans comorbidité.13, 14
1. Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 Tumeurs solides. 2019 ; 92-107. Disponible sur : www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-sein/documents/rapport-synthese/estimations-nationales-de-l-incidence-et-de-la-mortalite-par-cancer-en-france-metropolitaine-entre-1990-et-2018-volume-1-tumeurs-solides-etud
2. Siegel RL, Miller KD, Goding Sauer A, Fedewa SA, Butterly LF, Anderson JC, et al. Colorectal cancer statistics, 2020. CA Cancer J Clin 2020;70:145-64.
3. Denis B, Guittet L. Dépistage du cancer colorectal par test immunologique quantitatif de recherche de sang occulte dans les selles : une révolution ? Hépato-Gastro & Oncologie digestive 2015;22:119-29.
4. Dépistage et prévention du cancer colorectal. Actualisation du référentiel de pratiques de l’examen périodique de santé (EPS). HAS juin 2013. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/2013-07/referentieleps_format2clic_kc_colon-vfinale_2013-07-24_16-05-56_103.pdf
5. Cancer colorectal : modalités de dépistage et de prévention chez les sujets à risque élevé et très élevé. HAS, mai 2017. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/2017-06/dir76/reco248_rapport_elaboration_cancer__colorectal.pdf
6. Robaszkiewicz M, Rahmi G, Lecomte T, Denis B, Vaillant E, Gronier O, et al. Modalités de surveillance après polypectomie colique. Hépato-Gastro & Oncologie digestive 2021;28:805-16.
7. Denis B. Facteurs de risque et de protection du cancer colorectal. Rev Prat 2022;72(8)889-897
8. Recommandations pour la pratique clinique. Endoscopie digestive basse : indications en dehors du dépistage en population. Anaes avril 2004. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/endoscopie_2004_recommandations_mise_en_forme_2006.pdf
9. Brenner H, Chen C. The colorectal cancer epidemic: challenges and opportunities for primary, secondary and tertiary prevention. Br J Cancer 2018;119:785-92.
10. Robertson DJ, Ladabaum U. Opportunities and challenges in moving from current guidelines to personalized colorectal cancer screening. Gastroenterology 2019;156:904-17.
11. Hull MA, Rees CJ, Sharp L, et al. A risk-stratified approach to colorectal cancer prevention and diagnosis. Nat Rev Gastroenterol Hepatol 2020;17:773-80.
12. Zygulska AL, Pierzchalski P. Novel diagnostic biomarkers in colorectal cancer. Int J Mol Sci 2022;23:852.
13. Denis B, Fraser CG. En pratique courante, quel est le meilleur test pour rechercher du sang dans les selles? Rev Prat 2021;71:543-50.
14. Denis B, Plastaras L, Fraser CG. Test immunochimique quantitatif de recherche de sang fécal occulte : le couteau suisse. Hépato-Gastro & Oncologie digestive 2022;29:165-80.
15. Song M, Chan AT, Sun J. Influence of the gut microbiome, diet, and environment on risk of colorectal cancer. Gastroenterology 2020;158:322-40.
16. Wirbel J, Pyl PT, Kartal E, Zych K, Kashani A, Milanese A, Fleck JS, et al. Meta-analysis of fecal metagenomes reveals global microbial signatures that are specific for colorectal cancer. Nat Med 2019;25:679-89.
17. Wong SH, Kwong TNY, Chow TC, Luk AKC, Dai RZW, Nakatsu G, et al. Quantitation of faecal Fusobacterium improves faecal immunochemical test in detecting advanced colorectal neoplasia. Gut 2017;66:1441-8.
18. van Keulen KE, Jansen ME, Schrauwen RWM, Kolkman JJ, Siersema PD. Volatile organic compounds in breath can serve as a non-invasive diagnostic biomarker for the detection of advanced adenomas and colorectal cancer. Aliment Pharmacol Ther 2020;51:334-46.
19. Peng L, Weigl K, Boakye D, Brenner H. Risk scores for predicting advanced colorectal neoplasia in the average-risk population: A systematic review and meta-analysis. Am J Gastroenterol 2018;113:1788-800.
20. Kortlever TL, van der Vlugt M, Dekker E, Bossuyt PMM. Individualized faecal immunochemical test cut-off based on age and sex in colorectal cancer screening. Prev Med Rep 2021;23:101447.
21. Duran-Sanchon S, Moreno L, Gómez-Matas J, Augé JM, Serra-Burriel M, Cuatrecasas M, et al. Fecal microrna-based algorithm increases effectiveness of fecal immunochemical test-based screening for colorectal cancer. Clin Gastroenterol Hepatol 2021;19:323-30.
22. Sassano M, Mariani M, Quaranta G, Pastorino R, Boccia S. Polygenic risk prediction models for colorectal cancer: A systematic review. BMC Cancer 2022;22:65.
23. Digby J, Steele RJ, Strachan JA, Mowat C, Anderson AS, McCann R, et al. Do other variables add value to assessment of the risk of colorectal disease using faecal immunochemical tests for haemoglobin? Ann Clin Biochem 2019;56:472-9.
24. van Leerdam ME, Roos VH, van Hooft JE, Balaguer F, Dekker E, Kaminski MF, et al. Endoscopic management of Lynch syndrome and of familial risk of colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:1082-93.
25. Leddin D, Lieberman DA, Tse F, Barkun AN, Abou-Setta AM, Marshall JK, et al. Clinical practice guideline on screening for colorectal cancer in individuals with a family history of nonhereditary colorectal cancer or adenoma: the Canadian Association of Gastroenterology Banff Consensus. Gastroenterology 2018;155:1325-47.
26. Monahan KJ, Bradshaw N, Dolwani S, Desouza B, Dunlop MG, East JE, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut 2020;69:411-44.
27. Pilonis ND, Bugajski M, Wieszczy P, Rupinski M, Pisera M, Pawlak E, et al. Participation in competing strategies for colorectal cancer screening: a randomized health services study (PICCOLINO Study). Gastroenterology 2021;160:1097-105.
28. Denis B, Gendre I, Perrin P. Dépistage organisé du cancer colorectal : un bilan décevant qu’il faut améliorer. Rev Prat 2018;68:839-46.
29. Meester RGS, van de Schootbrugge-Vandermeer HJ, Breekveldt ECH, de Jonge L, Toes-Zoutendijk E, Kooyker A, et al. Faecal occult blood loss accurately predicts future detection of colorectal cancer. A prognostic model. Gut 2022 May 10:gutjnl-2022-327188. Epub ahead of print.
30. Dhooge M, Perrod G. Polyposes digestives et syndromes de prédisposition au cancer colorectal. Quelle prise en charge en 2021 ? Hépato-Gastro & Oncologie digestive 2021;28:1112-32.
31. van Leerdam ME, Roos VH, van Hooft JE, Dekker E, Jover R, Kaminski MF, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:877-95.
32. Buisine MP, Bonnet D, Bonadona V, Baert-Desurmont S, Bonnet D, Coulet F, Dhooge M, et al. La polypose associée à MUTYH : synthèse des données disponibles en 2020 et actualisation des recommandations françaises établies en 2012 sous l’égide de l’Institut national du cancer (INCa). Hépato-Gastro & Oncologie digestive 2020;27:396-406.
33. Colas C, Ribière S, Mariani P, Le Mentec M, Delhomelle H, Tzanis D, et al. Du nouveau dans le champ des polyposes adénomateuses colorectales : synthèse des données disponibles en 2020. Hépato-Gastro & Oncologie digestive 2020;27:386-95.
34. Muller M, Broséus J, Feugier P, Beaugerie L, Peyrin-Biroulet L. Cancers digestifs et lymphomes au cours des maladies inflammatoires chroniques de l’intestin : quels sont les risques ? Hépato-Gastro & Oncologie digestive 2021;28:485-90.
35. Hampton JS, Sharp L, Craig D, Rees CJ. Colorectal cancer screening and surveillance for non-hereditary high-risk groups-Is it time for a re-think? Curr Treat Options Gastroenterol 2021;19:48-67.
Dans cet article
- Comment affiner l’évaluation du risque de CCR ?
- Une nouvelle classification des niveaux de risque de CCR est nécessaire
- Des recommandations de dépistage adaptées en cas de risque accru de CCR
- Une nécessaire évolution des recommandations de dépistage et du programme français de dépistage organisé
- À terme, la médecine de précision pour personnaliser le dépistage du CCR
- Nouvelles classification et organisation du dépistage pour améliorer l’efficience