Qu’est-ce que la médecine génomique ? (rang A)
Quand penser à une maladie génétique ? (rang A)
Connaître les conditions de prescription d’un test génétique, les principales indications (rang B).
Introduction
Le développement des nouvelles technologies de génomique, notamment du séquençage à très haut débit, est une véritable évolution en médecine, considérée comme équivalente à celle de la découverte du microscope. Il est en effet maintenant possible, en l’espace de quelques jours, de séquencer l’ensemble de notre génome (WGS, whole genome sequencing) (3 milliards de paires de bases) ou de notre exome (WES, whole exome sequencing) qui représente les parties codantes du génome (environ 40 millions de paires de bases). L’effondrement de leurs coûts de production au cours des cinq dernières années permet de les intégrer massivement dans le soin, à l’origine de la médecine génomique.
Médecine génomique
Définition
La médecine génomique est définie par le National Human Genome Research Institute américain (NHGRI) comme « une discipline médicale émergente qui implique l’utilisation de l’information génomique des individus comme part entière de leur prise en charge clinique (par exemple pour le diagnostic ou le choix thérapeutique), avec des conséquences sur la santé et des implications dans les recommandations pour l’utilisation clinique ». Cette discipline s’est vue largement favorisée par le développement majeur du séquençage à haut débit, classé en 2013, par le McKinsey Global Institute (MGI) comme la 7e révolution technologique la plus importante au monde en termes d’impact sociétal.
La médecine génomique se différencie des termes de médecine prédictive, préventive, personnalisée ou de précision (
Lorsque la composante génétique prend une part importante dans la prise en charge globale du patient, il est préférable d’utiliser le terme de médecine génomique. C’est en particulier le cas quand il y a recours à des examens pangénomiques, tels que le séquençage d’exome (WES) ou de génome (WGS).
L’intégration de la médecine génomique dans le soin a d’ores et déjà un impact substantiel sur le diagnostic, la prévention et les applications thérapeutiques, pour les cancers et les maladies rares, puis à terme pour les maladies communes.
Le déploiement international de la médecine génomique
Au niveau international, l’implémentation de la médecine génomique dans les systèmes de santé fait l’objet d’investissements financiers majeurs dans plus d’une quinzaine de pays. Différentes stratégies émergent, fondées soit, comme en France, sur le diagnostic d’un grand nombre de patients atteints de maladies rares et de cancers (Royaume-Uni, Australie, Suède…), soit sur la population générale (États-Unis, Estonie…). Le pays le plus avancé est actuellement le Royaume-Uni grâce au 100,000 Genomes Project, lancé en 2012 et intégré dans une approche plus globale qui a redéfini entièrement les stratégies de diagnostic (CGH, Comparative Genomic Hybridization, panels, whole exome sequencing, whole genome sequencing). En 2018, il a lancé le NHS (National Health Service) Genomic Medicine Service (GMS) pour le remboursement du séquençage du génome entier dans le diagnostic des maladies rares et de certains cancers. En parallèle, les États-Unis ont lancé leur plan stratégique de séquençage de génome à grande échelle dans le cadre de la Precision Medicine Initiative, avec notamment le projet All of Us qui engage 1 million de volontaires de tous âges, états de santé, ethnies, et de toutes les régions géographiques, reflétant ainsi la diversité humaine du pays. La Chine a récemment mis en place un projet sur 15 ans visant à séquencer 1 milliard de génomes d’ici à 2030.
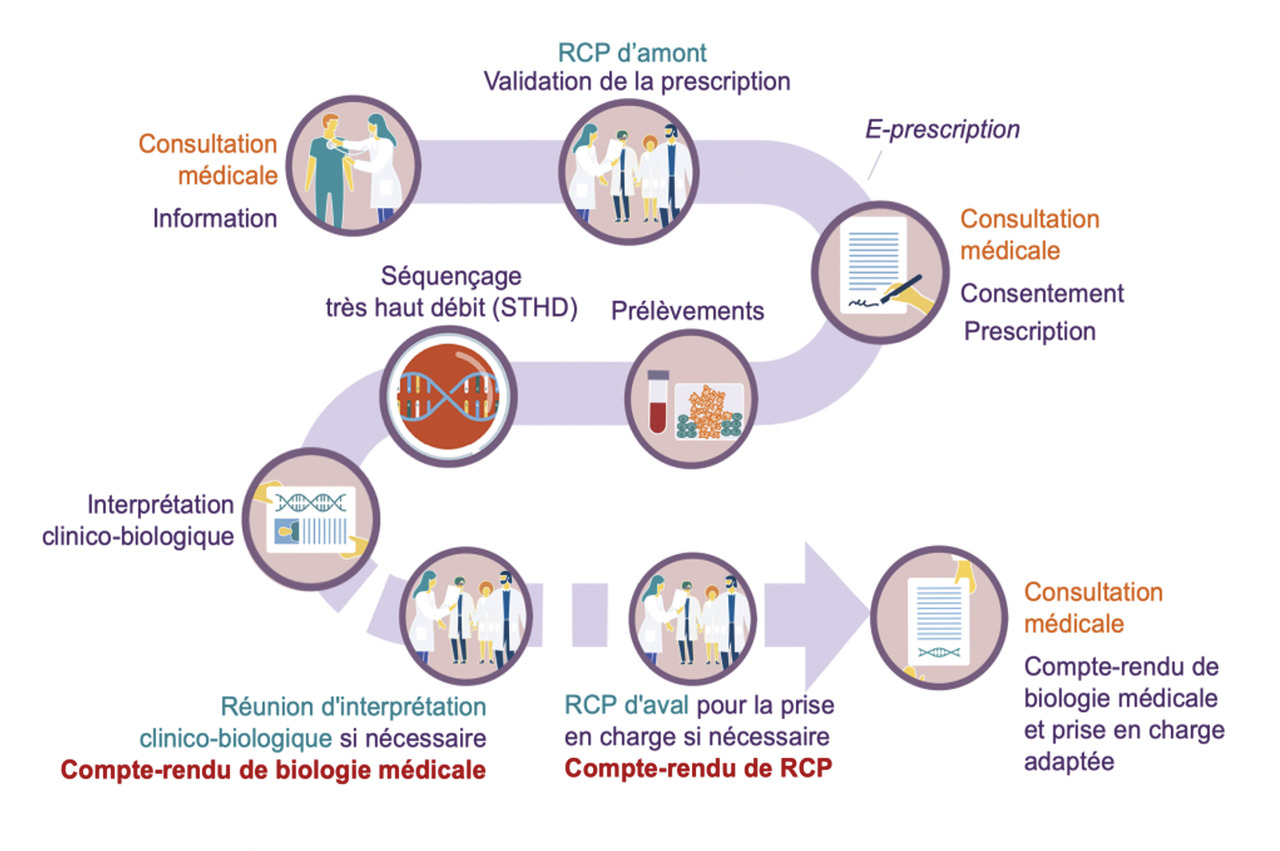
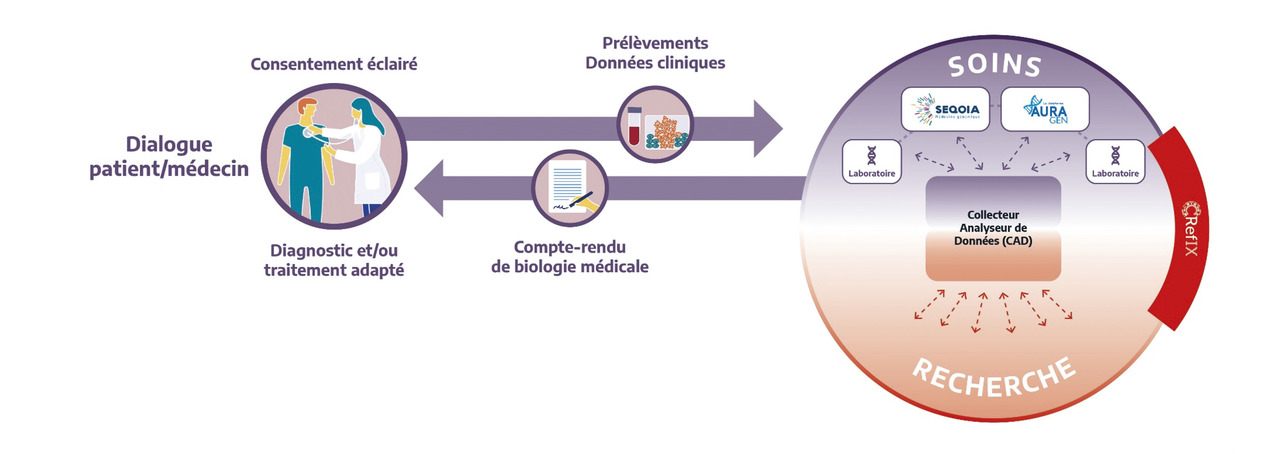
En France, le Plan France Médecine Génomique 2025 (PFMG 2025) a été lancé en 2016. L’objectif est de permettre à chaque personne d’accéder, dans le cadre du soin, aux technologies de séquençage à haut débit dans le champ des maladies rares et des cancers, puis des maladies communes. Des parcours de soins spécifiques sont ainsi déployés pour chaque indication clinique, permettant de définir les modalités de prescription, les protocoles de séquençage, les outils d’analyse des données, et les modalités d’interprétation et de rendu des résultats (
- un réseau de laboratoires de biologie médicale dédiés au séquençage à très haut débit (LBM-FMG) du génome entier dans un cadre de soins, prenant en charge les échantillons des patients sur l’ensemble du territoire métropolitain et d’outre-mer ;
- une infrastructure de gestion et d’analyse des données génomiques (collecteur analyseur de données ; CAD) ;
- un centre de référence, d’innovation, d’expertise et de tranfert (CRefIX) [fig. 2].
En 2019, les deux premiers laboratoires de biologie médicale dédiés au séquençage à très haut débit ont débuté leur activité : SeqOIA (Paris-Île-de-France) et AURAGEN (Auvergne-Rhône-Alpes).
Enjeux et défis
La médecine génomique constitue un défi important puisqu’elle repose sur notre capacité à mettre en place des parcours de soins permettant, dans un contexte clinique, de prescrire, séquencer, analyser et interpréter des génomes individuels, à coût maîtrisé et délai adapté, pour un grand nombre de patients atteints de maladies rares ou de cancers, puis de maladies communes. Les enjeux sont majeurs, à la fois médicaux, scientifiques, technologiques, organisationnels, économiques et éthiques.
Dans le domaine des maladies rares, il s’agit avant tout de lutter contre l’impasse diagnostique et d’établir un diagnostic génétique causal, permettant ainsi de proposer un pronostic plus précis, d’éviter la réalisation de nombreux autres tests, d’adapter les traitements et la prise en charge, de prévenir des futures complications connues, de faciliter l’obtention d’aides spécifiques aux familles, et pour certaines, le lien avec d’autres familles affectées par la même pathologie. Cela permet également d’établir un conseil génétique fiable, en précisant les risques de récurrence, et de proposer un diagnostic prénatal et/ou préimplantatoire si besoin. Dans le domaine des cancers, il s’agit principalement d’adapter les traitements aux variations génétiques tumorales, mais aussi au patrimoine génétique des individus. Séquencer les tumeurs peut ainsi permettre de trouver le traitement le plus efficace (théranostique). Cela peut également révéler la présence de variants constitutionnels dans des gènes de prédisposition aux cancers, permettant de proposer des mesures de suivi et de prévention adaptées à la personne malade et à sa famille.
D’un point de vue technologique, les nouveaux défis à relever concernent principalement les données de génomique. Le séquençage du génome humain à grande échelle génère une quantité massive de données, faisant entrer la médecine génomique dans l’ère du Big Data. L’analyse et l’interprétation de ces données nécessitent des investissements technologiques majeurs dans un environnement adapté aux données de santé, qu'il s'agisse d’infrastructures informatiques dédiées (supercalculateurs), d’algorithmes bio-informatiques ou de déploiement de bases de données interopérables (séquençage, données cliniques, imagerie…).
Le déploiement de la médecine génomique nécessite également le développement de nouvelles expertises, comme la bio-informatique, de savoir-faire, de pratiques, et de métiers (bio-informaticiens, biostatisticiens, assistants de prescription, ingénieurs de plateforme de séquençage…), avec un véritable enjeu de formation pour l’ensemble des acteurs du parcours de soins.
L’enjeu économique s’avère majeur, avec non seulement l’opportunité de développer une nouvelle filière industrielle mais surtout une médecine plus efficiente, des diagnostics plus rapides et plus précis, permettant de choisir les thérapies les plus efficaces. Cette approche diminue le nombre de bilans inadaptés, imprécis et onéreux, de réduire les délais de rendu de résultats, de choisir le juste traitement avec le meilleur rapport efficacité/toxicité, de supprimer les médicaments inutiles et d’éviter les effets secondaires à long terme…
Les enjeux éthiques sont importants puisque le WGS/WES permet de connaître les prédispositions génétiques d’un individu à de nombreuses maladies, de même que ses risques de transmission à sa famille. S’y ajoutent les questions éthiques liées au recueil, à la conservation et au traitement des données génétiques. Le génome entier d’un individu est une donnée de santé qui ne peut jamais être rendue totalement anonyme et qui contient des informations sensibles vis-à-vis de l’individu et de sa famille. Les conserver dans des bases de données nationales induit un risque supplémentaire d’identification à l’échelle des populations. L’information des patients et de la population générale sur les tenants et les aboutissants de la médecine génomique s’avère ainsi primordiale, notamment en termes d’utilisation, de protection et de confidentialité des données personnelles.
Les tests génétiques
Définition
Les tests génétiques consistent à rechercher des anomalies sur la molécule d’ADN elle-même, ou à identifier des anomalies concernant le nombre ou la forme des chromosomes. Il faut distinguer les tests qui apportent des informations sur le patrimoine génétique transmissible (génétique constitutionnelle) et ceux qui informent sur l’état du génome des cellules tumorales (génétique somatique).
Modalités réglementaires
Les tests de génétique constitutionnelle sont considérés comme des examens des caractéristiques génétiques d’une personne et soumis à la réglementation de la loi de bioéthique de 2004, nouvellement révisée en 2021.
Celle-ci mentionne que « L’examen des caractéristiques génétiques d’une personne ne peut être entrepris qu’à des fins médicales ou de recherche scientifique. Le consentement exprès de la personne doit être recueilli par écrit préalablement à la réalisation de l’examen, après qu’elle a été dûment informée de sa nature et de sa finalité. Le consentement mentionne la finalité de l’examen. Il est révocable sans forme et à tout moment. » Avant tout test génétique, le prescripteur doit donc informer le patient ou son/ses représentant(s) de manière claire et loyale, afin de pouvoir recueillir le consentement écrit et éclairé. Le patient ou son/ses représentant(s) signe(nt) ensuite le consentement alors que le médecin prescripteur signe l’attestation de conseil génétique. En France, tout médecin peut prescrire un test génétique à condition qu'il soit en capacité d’en expliquer le résultat et les conséquences au patient et à sa famille. À la suite de la révision de la loi de bioéthique promulguée en 2021, les conseillers en génétique peuvent désormais prescrire des examens de génétique constitutionnelle selon des modalités restant à définir par décret. Pour les examens de génétique somatique (altérations génétiques des tumeurs), le recueil d’un consentement spécifique n’est pas requis. Néanmoins, certains de ces examens sont susceptibles de révéler la présence de variants constitutionnels dans des gènes de prédisposition aux cancers. Dans ce contexte, des circuits spécifiques doivent être mis en place pour délivrer aux patients concernés une information de qualité, recueillir si besoin leur consentement et les accompagner en cas de découverte d’une prédisposition héréditaire au cancer. Pour ces situations, la loi de bioéthique 2021 définit les modalités d’information des patients et les parcours de soins à mettre en place.
C’est le prescripteur qui informe son patient des résultats des tests de génétique constitutionnelle.
Depuis 2013, l’information à la parentèle est devenue obligatoire pour les examens de génétique constitutionnelle. En effet, avant tout examen des caractéristiques génétiques d’une personne, le médecin prescripteur doit informer le patient des risques qu’un silence ferait courir aux membres de sa famille potentiellement concernés, si une anomalie génétique, pouvant être responsable d’une affection grave justifiant des mesures de prévention, y compris de conseil génétique, ou de soins était diagnostiquée. L’information peut être effectuée par le patient ou s’il le souhaite par le médecin prescripteur.
À l’échelle internationale, un véritable marché économique lié aux tests génétiques s’est développé. Un certain nombre d’entreprises privées proposent ainsi au monde entier de réaliser des tests génétiques et de répondre à une liste hétéroclite de questions : quelles sont vos origines ethniques ? D’où viennent vos ancêtres ? Avez-vous une forte susceptibilité au surpoids, à l’obésité, au diabète ? Au-delà de ces analyses, certaines entreprises en font un business très lucratif, car elles constituent ainsi d’immenses bases de données génétiques. Ces tests dits « récréatifs » ne correspondent en rien à des analyses de médecine génomique. En France, ils sont strictement interdits par l’article 226-28-1 du code pénal : « Le fait, pour une personne, de solliciter l’examen de ses caractéristiques génétiques ou de celles d’un tiers, ou l’identification d’une personne par ses empreintes génétiques en dehors des conditions prévues par la loi est puni de 3 750 euros d'amende ». La réalisation de tests ADN ne peut être demandée que par un médecin, un juge ou la police, comme cela est inscrit dans le Code civil, article 16-10 : « L’examen des caractéristiques d’une personne ne peut être entrepris qu’à des fins médicales ou de recherche scientifique ».
Par ailleurs, en France, seuls les laboratoires autorisés par les agences régionales de santé (ARS) peuvent réaliser des tests génétiques constitutionnels.
Principales indications
Les tests génétiques ne doivent être prescrits que lorsqu’ils ont une utilité clinique et qu’ils sont souhaités par la personne. Le seul fait qu’un examen soit disponible et réalisable ne justifie ni sa prescription ni sa réalisation.
Génétique constitutionnelle
Les tests génétiques constitutionnels sont réalisés le plus souvent pour établir et/ou confirmer un diagnostic de maladies génétiques (v. paragraphe Quand penser à une maladie génétique ?) mais également pour effectuer un diagnostic prénatal, préimplantatoire, ou présymptomatique, un dépistage des apparentés en vue d’un conseil génétique, une recherche de prédisposition aux cancers (oncogénétique) ou encore pour obtenir des informations sur la réponse à un traitement ou sur des risques d’effets indésirables (pharmacogénétique).
Différentes techniques sont actuellement disponibles, notamment le caryotype, la FISH (fluorescence in situ hybridization), la PCR quantitative, l’analyse chromosomique sur puce à ADN (ACPA), ou CGH array, le séquençage de gènes ciblés (pouvant inclure le séquençage de panels de gènes), le séquençage de l’exome (WES), le séquençage du génome (WGS), le séquençage de l'ARN : RNAseq (
Dans le cadre du Plan France Médecine Génomique 2025, le séquençage de génome est réalisé pour des préindications déterminées par la Haute Autorité de Santé (HAS).
Génétique somatique
Les tests génétiques somatiques sont réalisés le plus souvent afin d’adapter au mieux le traitement de la personne atteinte d’un cancer aux caractéristiques génétiques de la tumeur. On parle alors de tests à visée théranostique. Ces examens peuvent également être réalisés pour contribuer au diagnostic, à visée pronostique, afin d’orienter le traitement des patients, ou encore pour effectuer le suivi de la maladie résiduelle. Pour les tumeurs solides, il s’agit le plus souvent d’analyses génétiques faites à partir de la tumeur elle-même, mais l’analyse de l’ADN tumoral circulant dans le sang des patients est une approche de plus en plus utilisée.
Les tests génétiques à visée théranostique sont indiqués dans de nombreux cancers pour lesquels la prescription de thérapies ciblées ou de traitements d’immunothérapie (inhibiteurs de points de contrôle) est guidée par les caractéristiques génétiques de la tumeur ou de la personne malade. On peut citer à titre d’exemple le cancer colorectal avec panitumumab-cétuximab pour les tumeurs ne portant pas de mutations KRAS et NRAS ou pembrolizumab-nivolumab pour les tumeurs ayant une instabilité microsatellitaire élevée (MSI-H) ou une déficience du système de réparation des mésappariements de l’ADN (dMMR), le cancer du poumon avec géfitinib, erlotinib, afatinib, osimertinib ciblant les mutations d’EGFR (Epidermal Growth Factor Receptor), le mélanome avec vémurafénib, dabrafénib, cobimétinib, tramétinib ciblant la mutation BRAF V600. En 2020, 37 des 62 traitements ayant obtenu une autorisation de mise sur le marché (AMM) au cours des cinq dernières années nécessitaient la réalisation préalable d’un test théranostique (The IQVIA Institute – Global Oncology Trends, 2021).
Dans le cadre du Plan France Médecine Génomique 2025, le séquençage de l’exome, du génome et le RNAseq sont réalisés pour des préindications déterminées par la Haute Autorité de Santé (HAS).
Résultats, avantages et limites
Le séquençage de l’exome et du génome conduit à l’identification de plusieurs milliers de variations génétiques par rapport à la séquence de référence. Il faut déterminer, parmi celles-ci, celle(s) qui explique(nt) le phénotype du patient ou qui constitue(nt) une cible actionnable pour la prescription d’un traitement de précision.
Lors d’un test génétique constitutionnel, les variations génétiques sont interprétées par le biologiste dans un contexte clinique et classées en cinq catégories selon les recommandations de l’American College of Medical Genetics (ACMG) : classe 1 (variation bénigne), classe 2 (variation probablement bénigne), classe 3 (variation de signification incertaine, ou VSI), classe 4 (variation probablement pathogène) ou classe 5 (variation pathogène). Seul le prescripteur reçoit le compte-rendu de l’analyse génétique, qui peut être :
- concluant (diagnostic positif) : présence de variation(s) de classe 4 ou 5 expliquant complètement ou partiellement le phénotype ;
- non conclusif (diagnostic négatif on non concluant) : soit aucune variation n’a été retenue comme causale, soit des VSI imposent des analyses complémentaires (ségrégation familiale, tests fonctionnels…).
En cancérologie, l’interprétation clinico-biologique des résultats de séquençage pangénomique consiste dans un premier temps à identifier les variants impliqués dans la tumorigenèse et à les classer selon leur impact biologique (variants pathogènes, probablement pathogènes, etc.). Leur actionnabilité est ensuite analysée et évaluée en fonction de leur niveau de preuve clinique (données précliniques, cas cliniques, résultats d’essais cliniques, AMM…). L’intégration aux informations cliniques du patient permet alors de prioriser la variation la plus pertinente à cibler.
Les tests génétiques fondés sur le séquençage de l’exome ou du génome présentent ainsi certains avantages :
- analyse en parallèle de toutes les régions codantes (exons) connues (séquençage de l’exome), voire de la totalité du génome (WGS) ;
- amélioration du rendement diagnostique (par exemple, 40 à 50 % pour le séquençage de génome en trio [cas index et parents] utilisé en première intention dans le diagnostic de la déficience intellectuelle) ;
- possibilité de réanalyse régulière des données de séquençage au regard de l’amélioration des connaissances médicales et scientifiques, en particulier en cas de résultat non conclusif.
Ils présentent néanmoins certaines limites d’ordre technologique car, actuellement, le séquençage à haut débit n’identifie pas certains types de variations, comme les répétitions de triplets ou certaines variations de structure (
Les tests génétiques fondés sur le séquençage de l’exome ou du génome augmentent par ailleurs le risque d’identifier des données additionnelles (dans 1 à 3 % des analyses – voir paragraphe dédié) et des variations de signification inconnue.
Données additionnelles
Avec le séquençage de l’exome ou du génome, il existe un risque de découvertes additionnelles. Il s’agit de variations génétiques pathogènes impliquées dans des maladies rares mendéliennes ou de prédisposition à certains cancers mais qui ne s’avèrent pas liées à la pathologie pour laquelle le séquençage de l’exome ou du génome a été initialement prescrit. Ces données sont dites incidentes lorsqu’elles sont découvertes de façon fortuite ou accidentelle, ou secondaires lorsqu’elles sont recherchées activement à partir d’une liste de gènes déterminée. Certaines données peuvent s’avérer pertinentes en termes de prévention pour les patients et/ou leurs apparentés, notamment lorsqu’elles prédisposent à une maladie à révélation plus tardive accessible à une prévention ou un traitement, donnent des informations sur le risque de transmettre une maladie grave (conseil génétique familial) ou permettent d’adapter un traitement (variations pharmacogénétiques).
La loi de bioéthique votée en 2021 détermine les modalités d’accès aux données additionnelles.
Gestion des variations de signification incertaine dans le cadre d’un continuum soins-recherche
Dans les cas où le résultat d’un test génétique constitutionnel par séquençage de l’exome ou du génome est non conclusif, des analyses complémentaires peuvent être menées dans le cadre de la recherche, pour identifier de nouvelles variations génomiques d’intérêt ou pour confirmer ou infirmer la pathogénicité d’une variation de signification incertaine : intégration des données génétiques avec d’autres types de données (analyses multi-omiques), réanalyse avec de nouveaux outils bio-informatiques, études de validation fonctionnelle de variant de signification incertaine, identification de patients exprimant des phénotypes similaires…
Dans ce contexte, le partage des données au niveau national et/ou international est un enjeu crucial, qu'il s'agisse des données brutes de séquençage, des fichiers de variants ou des variations génomiques d’intérêt. Dans cet objectif, le collecteur analyseur de données (CAD) a été créé, qui rassemblera l’ensemble des données génomiques issues du Plan France Médecine Génomique 2025 en vue de proposer des outils d’aide à l’interprétation, à la fois dans le cadre du soin et de la recherche. Le partage de variations génomiques d’intérêt sur des plateformes internationales comme Matchmaker Exchange a déjà conduit à l’identification de nouveaux gènes impliqués dans des maladies rares.
Au-delà de la classification des variations de signification incertaine, le partage et la réutilisation des données de génomique dans le cadre de la recherche constituent une opportunité majeure pour répondre à des questions scientifiques ou développer de nouveaux outils d’analyse bio-informatique.
Quand penser à une maladie génétique ?
Une large majorité des maladies génétiques sont des maladies rares (qui affectent moins d'une personne sur 2 000). Une maladie génétique peut atteindre un seul ou plusieurs organes.
Une maladie génétique doit systématiquement être évoquée devant des antécédents familiaux du même spectre clinique pouvant faire évoquer une transmission mendélienne (autosomique dominante, autosomique récessive, liée au chromosome X) ou non mendélienne (mitochondriale, par expansion de triplets, empreinte génomique, oligogénique...).
Elle doit également être évoquée dans de nombreuses situations cliniques, telles que :
- les troubles du neurodéveloppement (retard de développement psychomoteur, déficience intellectuelle…), l’épilepsie, les troubles du langage et/ou de la phonation ;
- les malformations et les syndromes polymalformatifs ;
- les anomalies de la croissance staturopondérale (retard ou avance staturale) ;
- les troubles sensoriels, tels que les baisses de l’audition/surdité ou les troubles visuels tels que les atteintes rétiniennes ;
- les difficultés de procréation, qu'il s'agisse de troubles de la fertilité ou de fausses couches à répétition ;
- les maladies neurodégénératives de l’adulte jeune ;
- les pathologies cardiaques familiales, comme les troubles du rythme ou les cardiomyopathies, les morts subites, etc.
Certaines formes de cancers sont liées à une altération génétique constitutionnelle. Des signes cliniques sont évocateurs de ces formes héréditaires familiales : excès de cas de cancers au sein d'une même branche parentale (paternelle ou maternelle), précocité du cancer, formes bilatérales et multifocales pour les organes doubles. Des critères précis d’orientation vers une consultation d’oncogénétique et de prescription sont définis par le Groupe Génétique et cancer, notamment pour les cancers du sein, de l’ovaire, du côlon…
Conclusion
Le déploiement de la médecine génomique apparaît comme un véritable enjeu de santé publique. Le séquençage du génome en routine permettra aux patients de bénéficier d’une prise en charge diagnostique et thérapeutique plus personnalisée, liée à leurs caractéristiques génétiques constitutionnelles et aux caractéristiques génétiques de leur tumeur. La France déploie un plan d’envergure afin de permettre l’accès à la médecine génomique sur l’ensemble du territoire pour les patients atteints de maladies rares ou de cancers, puis à terme de maladies fréquentes.
POINTS FORTS À RETENIR
La médecine génomique est une discipline médicale émergente qui implique l’utilisation de l’information génomique des individus comme part entière de leur prise en charge clinique (exemple : diagnostic ou choix thérapeutique).
En 2016, le Plan France Médecine génomique 2025 (PFMG 2025) a été lancé pour permettre à chaque personne en France d’accéder dans le cadre du soin aux technologies de séquençage à haut débit dans le domaine des maladies rares et des cancers, puis des maladies communes.
Les données additionnelles sont des variations génétiques pathogènes impliquées dans des maladies rares mendéliennes ou des cancers mais qui ne s’avèrent pas liées à la pathologie pour laquelle le WES/WGS a été initialement prescrit.
Avant tout test génétique, le prescripteur doit informer le patient ou son/ses représentant(s) de manière claire et loyale. Pour les tests de génétique constitutionnelle, le prescripteur doit ensuite recueillir le consentement écrit et éclairé du patient ou de son/ses représentant(s) et signer l’attestation de conseil génétique.
L’information à la parentèle est devenue obligatoire depuis 2013.
En France, la réalisation de tests ADN ne peut être demandée que par un médecin, un conseiller en génétique, un juge ou la police, comme cela est inscrit dans le Code civil : « L’examen des caractéristiques d’une personne ne peut être entrepris qu’à des fins médicales ou de recherche scientifique ». Les tests dits « récréatifs », ne correspondant en rien à des analyses de médecine génomique, sont ainsi strictement interdits.
Les différents types de variations génétiques d’intérêt (d’après Manolio, 2019)
Les variations génétiques en italique sont difficilement détectables, voire indétectables par le WES et le WGS.
Variations nucléotidiques uniques (single nucleotide variants [SNV]) : une base nucléotidique remplacée par une autre
➥ Synonyme : pas de changement de l’acide aminé
➥ Faux-sens : changement de l’acide aminé
➥ Non-sens : interruption prématurée de la chaîne peptidique
➥ De site d’épissage : variation génétique survenant à la jonction exon/intrion (splice site) qui peut modifier l’épissage de l’ARN et entraîner une perte d’exons ou une rétention d’introns, et ainsi une altération de la séquence protéique
Variations de structure
➥ Délétion : une ou plusieurs bases enlevée(s) de la séquence
➥ Insertion : une ou plusieurs bases ajoutée(s) à la séquence
➥ Duplication : fragment d’ADN copié anormalement une ou plusieurs fois
➥ Tronquant : ajout ou délétion d’une ou deux bases (ou d'un nombre qui n’est pas un multiple de 3), qui modifie la phase de lecture, produisant une protéine altérée ou tronquée
➥ Expansion : séquences courtes d’ADN répétées plusieurs fois
➥ Inversion : segment chromosomique inversé de bout en bout
Manolio TA, Rowley R, Williams MS, Roden M, Ginsburg GS, Bult C, et al. Opportunities, resources, and techniques for implementing genomics in clinical care. Lancet 2019;394(10197):511-20.
Shendure J, Balasubramanian S, Church GM, Gilbert W, Rogers J, Schloss JA, et al. DNA sequencing at 40: past, present and future. Nature 2017;550:345-53.
Kovanda A, Zimani AN, Peterlin B. How to design a national genomic project-a systematic review of active projects. Hum Genomics 2021;15:20.
Stark Z, Dolman L, Manolio TA, Ozenberger B, Hill SL, Caulfied MJ, et al. Integrating Genomics into Healthcare: A Global Responsibility. Am J Hum Genet 2019;104:13-20.
Van El CG, Cornel MC, Borry P, Hastings RJ, Fellmann F, Hodgson SV, et al. Whole-genome sequencing in health care: recommendations of the European Society of Human, Genetics. Eur J Hum Genet 2013;21:580-4.
Xue Y, Ankala A, Wilcox WR, Hegde MR. Solving the molecular diagnostic testing conundrum for Mendelian disorders in the era of next-generation sequencing: single-gene, gene panel, or exome/genome sequencing. Genet Med 2015;17:444-51.
Site internet de Plan France Médecine génomique 2025 : https://pfmg2025.aviesan.fr/
Agence de la biomédecine. Bioéthique, biomédecine : pourquoi & comment encadrer la médecine ? 1er septembre 2021 : https://www.agence-biomedecine.fr/Bioethique-biomedecine-pourquoi-comment-encadrer-la-medecine
Inserm. Tests génétiques, à quoi servent-ils ? 11 juillet 2017 : https://www.inserm.fr/information-en-sante/dossiers-information/tests-genetiques
Site internet de La Génétique médicale et vous : https://www.genetique-medicale.fr/
Site internet d’oncogénétique.fr : https://www.oncogenetique.fr/
Institut national du cancer. Les tests ou marqueurs déterminant l’accès à des thérapies ciblées. 24 novembre 2017. https://www.e-cancer.fr/Professionnels-de-sante/Les-therapies-ciblees/Les-tests-moleculaires/Les-tests-ou-marqueurs-determinant-l-acces-a-des-therapies-ciblees
Lorec A, Mathé F, Russo D, et al. La génomique. Les défis du CEA mai 2016. https://www.cea.fr/multimedia/Documents/infographies/Defis-du-CEA-207-infographie-la-genomique.pdf
Iqvia. Global Oncology Trends 2021. 3 juin 2021.https://www.iqvia.com/insights/the-iqvia-institute/reports/global-oncology-trends-2021

 Encadrés
Encadrés