Les causes en sont multiples, comme l’endométriose, les fibromes utérins, les dysrégulations hormonales, voire une grossesse, mais dans la moitié des cas aucune cause n’est identifiée, ce qui doit faire évoquer une anomalie de l’hémostase, en particulier s’il existe une autre symptomatologie hémorragique associée (épistaxis, tendance ecchymotique, gingivorragies, antécédent d’extraction dentaire ou de chirurgie hémorragique).1 Une telle cause n’est néanmoins retrouvée que dans environ 20 % des cas,2 mais son identification permet d’améliorer la qualité de vie de ces patientes.
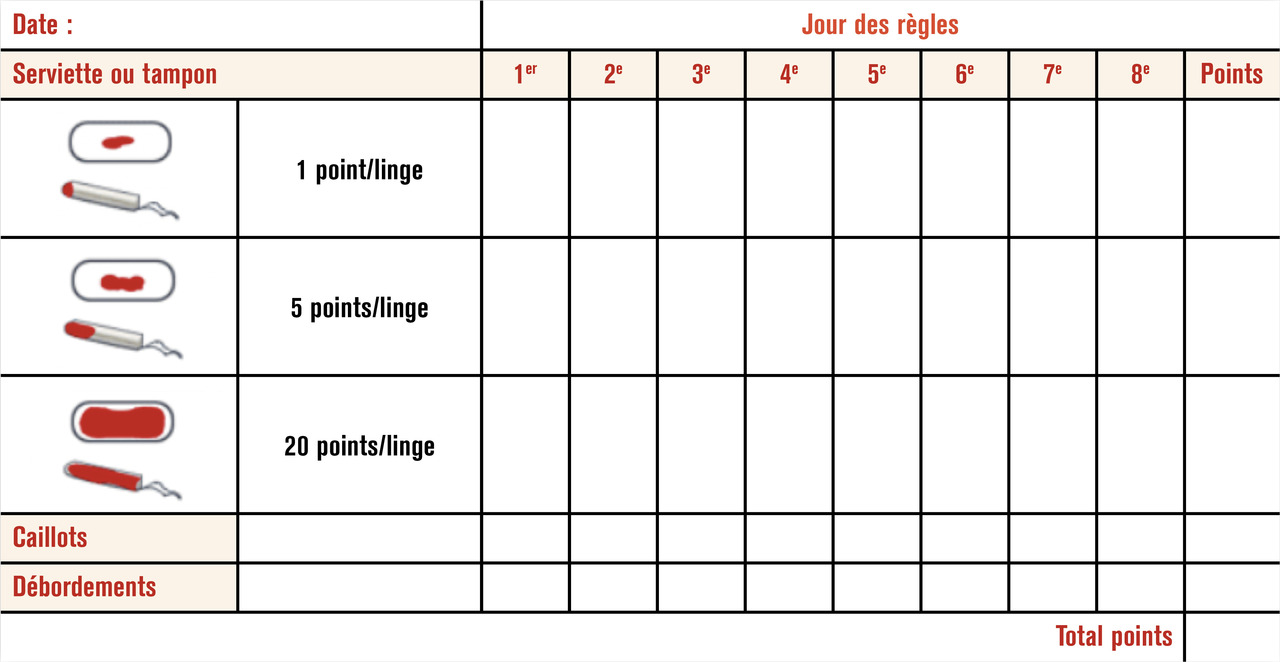
Évaluer l’abondance des ménorragies
Afin de mieux quantifier l’abondance du saignement, l’utilisation du score de Higham (
Deux situations
Anticiper les premières règles
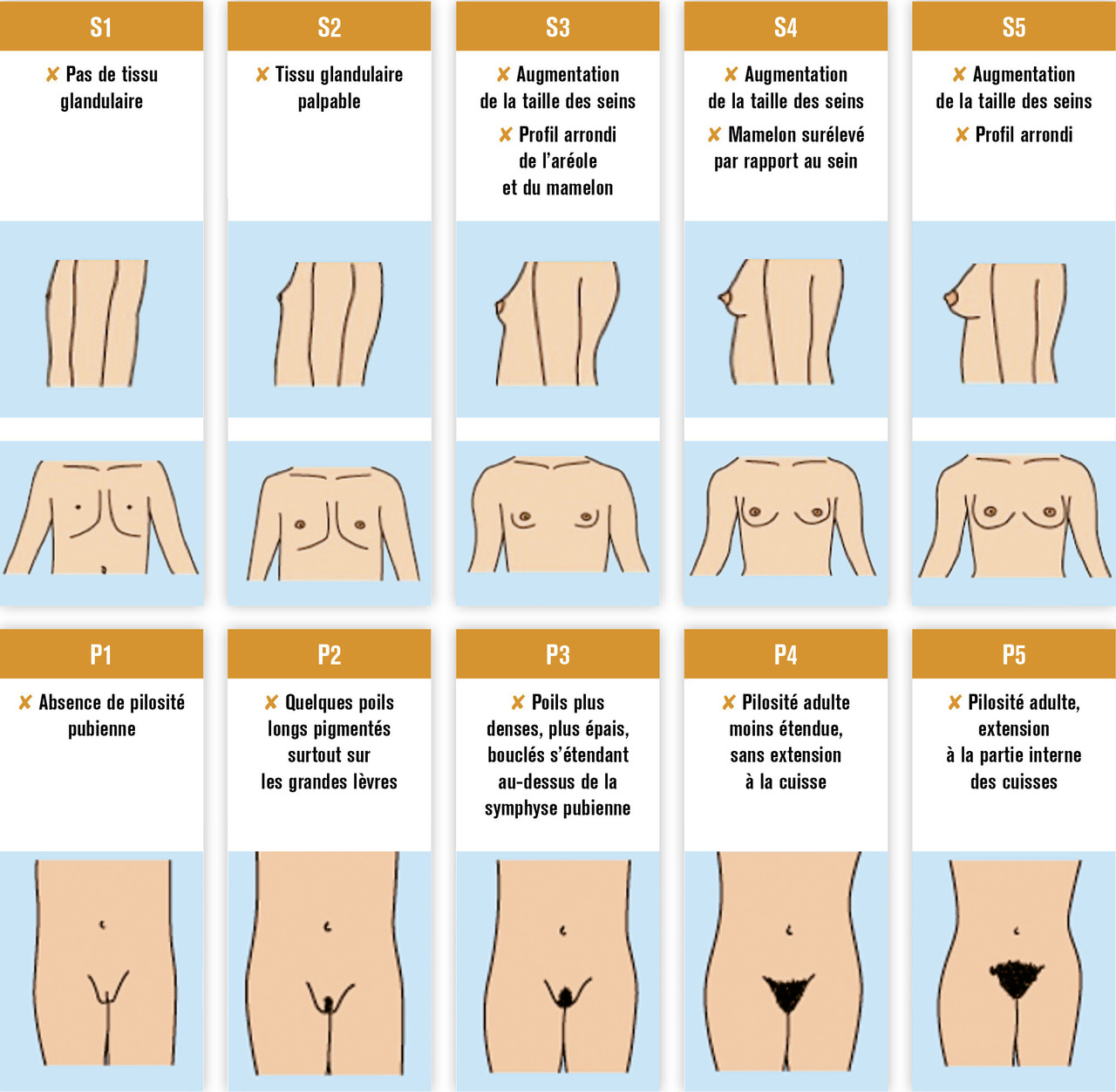
Les premières règles apparaissent en général au cours des 2 ans suivant le début de la puberté. Une échographie par voie sus-pubienne permet d’évaluer, tous les 6 mois à partir du stade pubertaire de Tanner S3 (
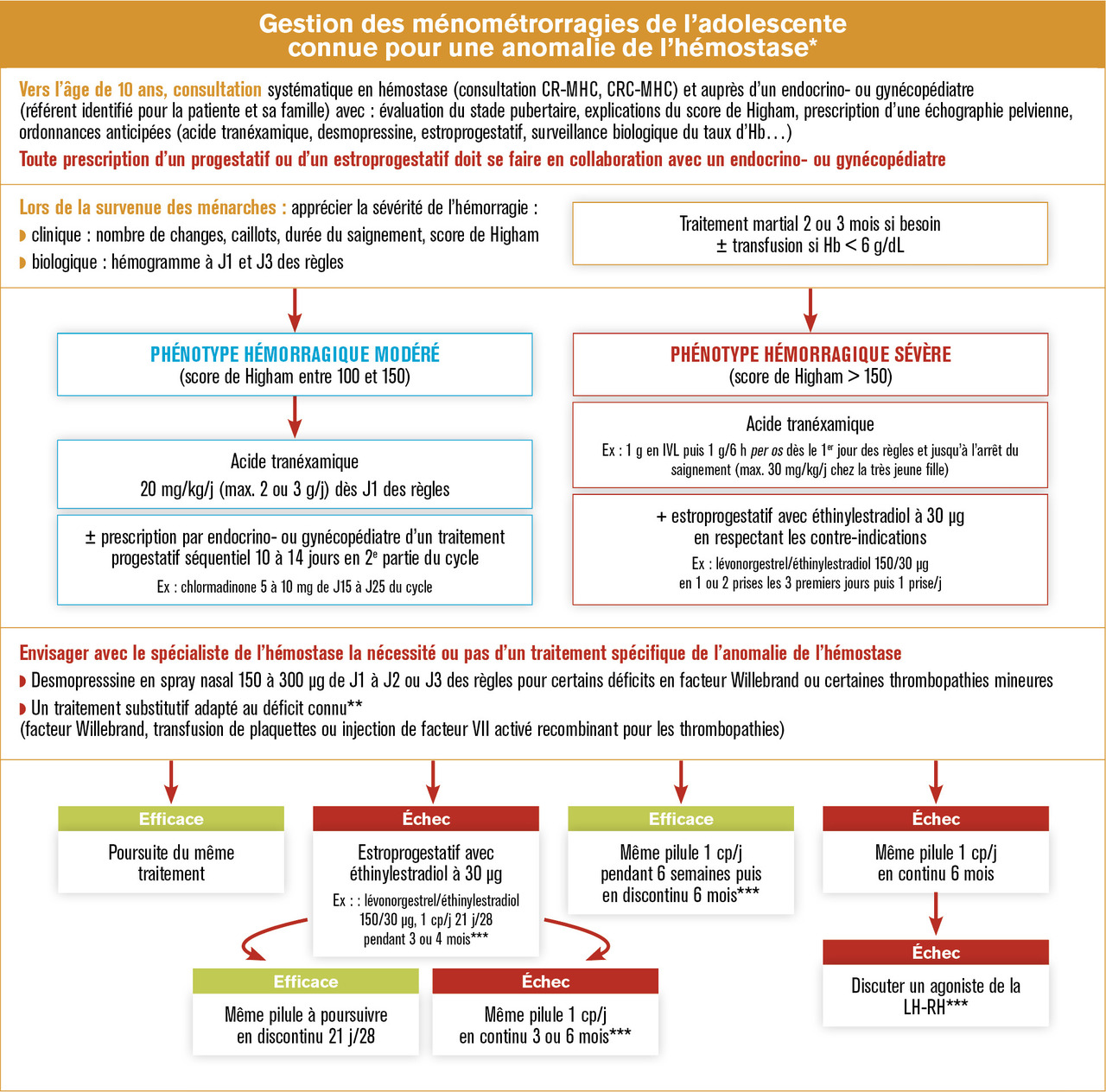
La jeune fille doit en être prévenue, et une consultation dédiée auprès d’un endocrinologue pédiatre ou d’un gynécologue pédiatre est à proposer. Cette consultation a pour objectif de lui expliquer, ainsi qu’à ses parents, le risque de voir apparaître des règles abondantes et la conduite à tenir sur le plan thérapeutique. Le score de Higham est explicité pour pouvoir en faire l’évaluation lors d’une consultation ultérieure. Le recours aux anti-inflammatoires non stéroïdiens a une contre-indication relative dans ce contexte. Leur utilisation en cas de dysménorrhée ne doit pas se faire en première intention et nécessite un avis hématologique. Des ordonnances sont remises : antifibrinolytique (acide tranéxamique) à prendre dès l’apparition des règles si elles sont d’emblée abondantes, prescription d’une pilule, prise en charge spécifique du trouble de l’hémostase quand cela est possible (traitement substitutif par desmopressine, facteur VIII, facteur Willebrand, etc.), et un hémogramme est prescrit afin de dépister l’apparition d’une anémie au 2e jour des règles, si elles sont abondantes. Il est également conseillé de limiter les activités sportives lors des règles.
Toutes ces mesures permettent de sécuriser au mieux les premières règles des patientes à risque de ménorragies.10
Minimiser l’abondance des règles
En cas de ménorragies modérées
En cas d’échec, un traitement estroprogestatif est proposé, d’abord en discontinu (21 jours sur 28), puis en continu pendant 3 à 6 mois si les ménorragies persistent. Les contre- indications aux estrogènes doivent être respectées (antécédents thromboemboliques, par exemple).
En cas de ménorragies importantes
Autres mesures
Un saignement en cours de plaquette fait doubler la dose de pilule pendant 24 à 48 heures.
Par ailleurs, il est important de prendre en charge les dysménorrhées (règles douloureuses), plus fréquentes lorsqu’il y a des ménorragies.17 La prescription d’anti-inflammatoires non stéroïdiens doit être discutée avec l’hématologue du fait du risque de majoration de la symptomatologie hémorragique.
Ces jeunes femmes doivent également bénéficier d’un examen gynécologique de l’hymen, permettant de dépister la présence d’une bride hyménale ou d’un hymen charnu. Il leur est alors conseillé le port de tampons périodiques afin de diminuer le risque de saignement abondant lors des premiers rapports sexuels.
Enfin, la survenue de kystes fonctionnels ovariens est possible, avec le risque, particulièrement chez ces patientes, de rupture hémorragique. La présence de ces kystes peut ainsi faire poser l’indication d’un traitement hormonal afin d’éviter ce type de complication.
Devenir gynéco-obstétrical
Lle suivi en consultation se fait initialement tous les 3 mois, puis tous les 6 mois.
Cette surveillance est clinique, elle se fait par l’interrogatoire de la patiente et l’évaluation du score de Higham.18
Une désescalade thérapeutique peut être envisagée après 6 à 12 mois d’aménorrhée ou de règles d’abondance normale, après décision conjointe avec l’hématologue.
L‘arrêt de l’hormonothérapie est nécessaire en cas de désir et de projet de grossesse. La prise en charge doit être pluridisciplinaire. Le couple doit être reçu, et un bilan d’hémostase orienté prescrit au conjoint en cas de symptomatologie hémorragique. Le risque hémorragique doit être expliqué : celui de la mère en pré-, per- et post-partum, la contre-indication possible à une anesthésie péridurale, le risque de transmission de la pathologie de l’hémostase à l’enfant à naître, et le risque hémorragique néonatal potentiel.
Prise en charge pluridisciplinaire
Lorsque l’anomalie de l’hémostase est connue avant la puberté, il est important d’anticiper les premières règles de ces jeunes filles afin d’éviter les complications de ménorragies très importantes. Enfin, le risque hémorragique gynéco-obstétrical est également à prendre en charge en cas de désir de grossesse.
Examens de première intention :
– hémogramme
– taux de prothrombine, temps de céphaline kaolin, fibrinogène
– facteur Willebrand antigène et activité, facteur VIII
En seconde intention :
Adresser la patiente en consultation d’hémostase, notamment si d’autres symptômes hémorragiques sont associés :
– exploration des fonctions plaquettaires
– dosage du facteur XIII
Messages clés
Importance d’une prise en charge précoce des jeunes filles :
en parler aux parents et à la jeune fille avant l’adolescence ;
anticiper l’apparition des premières règles.
Maîtriser l’abondance des règles :
antifibrinolytique et prise en charge du trouble de l’hémostase (traitement substitutif) ;
progestatif au cours de la seconde partie du cycle ;
pilule estroprogestative séquentielle ou en continu.
Prise en charge multidisciplinaire des jeunes femmes :
collaboration médicale essentielle hématologue- gynécologue ;
prise en charge préconceptionnelle du couple en cas de désir de grossesse.
2. Lukes A. Disorders of hemostasis and excessive menstrual bleeding: prevalence and clinical impact. Fertil Steril 2005;84:1345-51.
3. Kulp JL, Mwangi CN, Loveless M. Screening for coagulation disorders in adolescents with abnormal uterine bleeding. J Pediatr Adolesc Gynecol 2008;21:27-30.
4. Higham JM, O’Brien PMS, Shaw RW. Assessment of menstrual blood loss using a pictorial chart. Br J Obstet Gynaecol 1990;97:734-9.
5. Reid PC, Coker A, Coltard R. Assessment of menstrual blood loss using a pictorial chart: a validation study. Br J Obstet Gynaecol 2000;107:320-23.
6. Collège national des gynécologues et obstétriciens français (32es Journées nationales 2008).
7. Shankar M, Lee CA, Sabin CA, Economides DL, Kadir RA. Von Willebrand disease in women with menorrhagia: a systematic review. Br J Obstet Gynaecol 2004;111:734-40.
8. Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls. Arch Dis Childhood 1969;44:291-303.
9. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Childhood 1970;45:13-23.
10. Bidet M. Ménométrorragies pubertaires. Pas à pas en pédiatrie, mai 2013. http://pap-pediatrie.fr/endocrinologie/menometrorragies-pubertaires
11. James AH, Kouides PA, Abdul-Kadir R, et al. Von Willebrand disease and other bleeding disorders in women: consensus on diagnosis and management from an international expert panel. Am J Obstet Gynecol 2009;201:12.e1-8
12. Rajpurkar M, O’Brien SH, Haamid FW, Cooper DL, Gunawardena S, Chitlur M. heavy menstrual bleeding as a common presenting symptom of rare platelet disorders: illustrative case examples. J Pediatr Adolesc Gynecol 2016;29:537-41.
13. Balci YI, Karabulut A, Kabukcu S, Sari I, Keskin A. Intensive menstrual bleeding successfully treated with recombinant factor VIIa in Glanzmann thrombasthenia. Clin Appl Thromb Hemost 2011;17:320-2.
14. Abshire, Cox-Gill J, Kempton CL, et al. Prophylaxis escalation in severe von Willebrand disease: a prospective study from the von Willebrand Disease Prophylaxis network. J Thromb Haemost 2015;13:1585-9.
15. James A, Matchar DB, Myers ER. Testing for von Willebrand disease in women with menorrhagia: a systematic review. Obst Gynecol 2004;104:381-8.
16. Kadir RA, Lukes AS, Kouides PA, Fernandez H, Goudemand J. Management of excessive menstrual bleeding in women with hemostatic disorders. Fertil Steril 2005;84:1352-9.
17. Bricaire L, Laroche E, Christin-Maitre S. Ménométrorragies, dysménorrhées de l’adolescente. Arch Pediatr 2013;20:910-4.
18. De Raucourt E, Ternisien C. Prise en charge des ménométrorragies : bonnes pratiques et valeur diagnostique de la biologie : hémostase-hématologie. J Gynecol Obstet Biol Reprod 2008;37:S317-28.

 Encadrés
Encadrés