Contrairement à la définition de la ménopause chez la femme correspondant à l’arrêt permanent des menstruations résultant d’une perte de l’activité folliculaire ovarienne (OMS 1996), l’andropause (ou syndrome de déficit en testostérone lié à l’âge tel qu’il est nommé aujourd’hui) n’affecte qu’une proportion limitée des hommes. Son diagnostic clinique relève de signes cliniques non spécifiques du fait de l’existence de nombreux facteurs confondants apparaissant avec l’âge, comme l’obésité, les pathologies chroniques métaboliques (diabète, pathologies hépatiques, syndrome d’apnées du sommeil…), de l’iatrogénie médicamenteuse et ne peut être affirmé qu’en présence d’un déficit biochimique en testostérone.
Physiologie
Rappel physiologique sur la sécrétion de testostérone
Le testicule possède une double fonction :
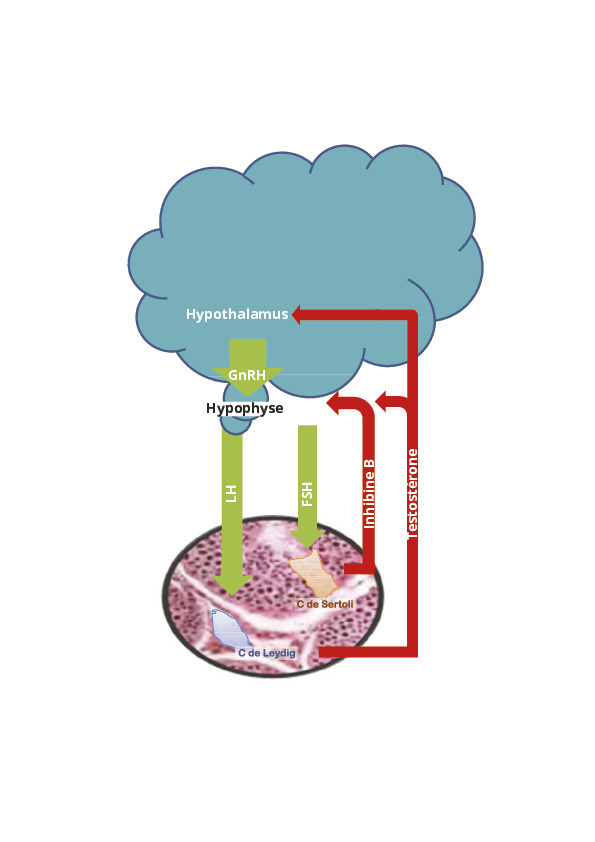
Lors de la puberté, sous l’influences de différents facteurs (hormonaux, génétiques, environnementaux…), il existe une reprise de la sécrétion de GnRH par les cellules hypothalamiques médiée également par les Kissneurones centraux ; cette sécrétion pulsatile permet ensuite la sécrétion également pulsatile des gonadotrophines (FSH et LH) par les cellules hypophysaires. Au niveau testiculaire, la LH agit sur les cellules de Leydig stimulant la sécrétion de testostérone, la FSH agit sur les cellules de Sertoli dans les tubules séminifères, permettant la mise en place de la spermatogenèse (également régulée par la testostérone intratesticulaire).
Il existe un système de régulation de cet axe principalement par l’intermédiaire des rétrocontrôles hormonaux et des Kisspeptines issues des Kissneurones centraux :
- la production de spermatozoïdes issus des spermatogonies régulée par les cellules de Sertoli situées dans les tubules séminifères ;
- la fonction endocrine, avec principalement la production de testostérone par les cellules de Leydig situées dans le tissu interstitiel (entre les tubules séminifères) du testicule.
Lors de la puberté, sous l’influences de différents facteurs (hormonaux, génétiques, environnementaux…), il existe une reprise de la sécrétion de GnRH par les cellules hypothalamiques médiée également par les Kissneurones centraux ; cette sécrétion pulsatile permet ensuite la sécrétion également pulsatile des gonadotrophines (FSH et LH) par les cellules hypophysaires. Au niveau testiculaire, la LH agit sur les cellules de Leydig stimulant la sécrétion de testostérone, la FSH agit sur les cellules de Sertoli dans les tubules séminifères, permettant la mise en place de la spermatogenèse (également régulée par la testostérone intratesticulaire).
Il existe un système de régulation de cet axe principalement par l’intermédiaire des rétrocontrôles hormonaux et des Kisspeptines issues des Kissneurones centraux :
- au niveau cérébral, les Kissneurones exercent un rôle de coordinateur de l’activité reproductive en régulant l’hypothalamus via de nombreux signaux métaboliques ou hormonaux comme les glucocorticoïdes, la leptine reflétant la masse grasse, la vasopressine liée aux rythmes circadiens, les stéroïdes sexuels, etc. Ils permettent ainsi de garantir que la reproduction puisse se faire dans les conditions métaboliques et environnementales favorables ;
- le rétrocontrôle négatif de l’axe hypothalamo-hypophysaire s’effectue aux différents étages par différentes hormones. Les pulses hypothamaliques de GnRH sont principalement inhibés par la testostérone et ses métabolites (l’estradiol [E2], la dihydrotestostérone [DHT]). Au niveau hypophysaire, la sécrétion de LH est également freinée par la testostérone alors que la sécrétion de FSH est inhibée par l’inhibine B sécrétée des cellules de Sertoli
(fig. 1).
Stéroïdogenèse testiculaire
Les cellules de Leydig représentent 5 % environ du volume testiculaire mais permettent la sécrétion de 95 % de la testostérone chez l’homme. Le reste de la synthèse de testostérone est assuré par le tissu adipeux périphérique et par les surrénales.
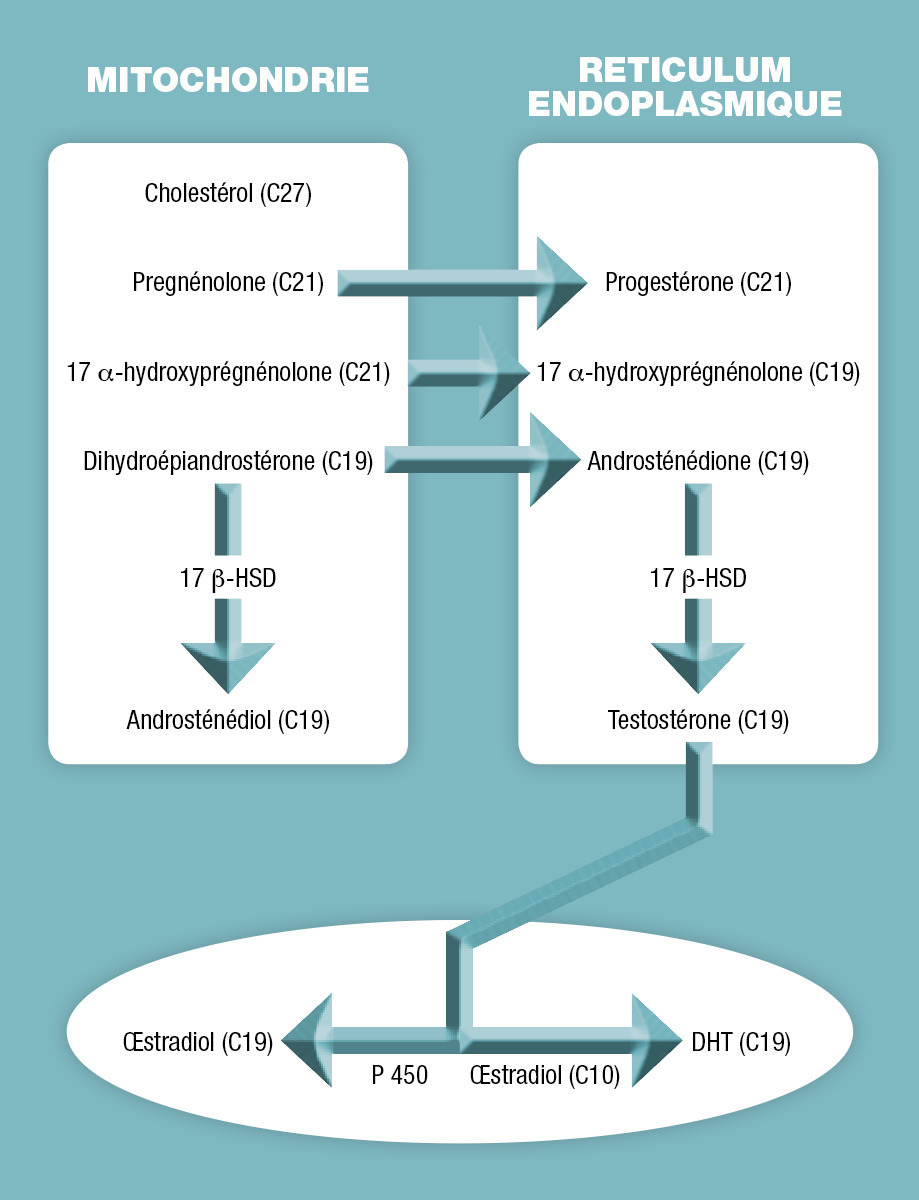
La testostérone est un métabolite du cholestérol qui est capté par la cellule de Leydig, puis transporté dans la mitochondrie où, par un jeu enzymatique faisant intervenir le cytochrome P450, il est transformé en prégnénolone ; celle-ci est ensuite métabolisée par d’autres interventions enzymatiques en testostérone. Cette voie est régulée par la LH qui intervient par l’intermédiaire de la protéine StAR dans le transfert du cholestérol de la membrane externe vers la membrane interne de la mitochondrie (permettant un contrôle rapide de la stéroïdogenèse en quelques minutes) et également en intervenant sur la transcription et la traduction des gènes codant pour les enzymes de la stéroïdogenèse dans la mitochondrie pour la formation de la prégnénolone (contrôle de plus long terme de la stéroïdogenèse, fig. 2)
La testostérone peut suivre ensuite deux autres voies de métabolisation conduisant à la formation de la DHT (qui a une action 2 fois plus puissante que la testostérone elle-même) et à la formation de l’E2. La DHT est issue de la testostérone par l’intervention de la 5-α réductase au niveau de la prostate, de la peau, et du foie principalement. L’E2 est métabolisé par l’intermédiaire de l’aromatase principalement dans le tissu adipeux mais aussi dans la peau, le cerveau, le rein, l’os et le testicule.
La testostérone est un métabolite du cholestérol qui est capté par la cellule de Leydig, puis transporté dans la mitochondrie où, par un jeu enzymatique faisant intervenir le cytochrome P450, il est transformé en prégnénolone ; celle-ci est ensuite métabolisée par d’autres interventions enzymatiques en testostérone. Cette voie est régulée par la LH qui intervient par l’intermédiaire de la protéine StAR dans le transfert du cholestérol de la membrane externe vers la membrane interne de la mitochondrie (permettant un contrôle rapide de la stéroïdogenèse en quelques minutes) et également en intervenant sur la transcription et la traduction des gènes codant pour les enzymes de la stéroïdogenèse dans la mitochondrie pour la formation de la prégnénolone (contrôle de plus long terme de la stéroïdogenèse, fig. 2)
La testostérone peut suivre ensuite deux autres voies de métabolisation conduisant à la formation de la DHT (qui a une action 2 fois plus puissante que la testostérone elle-même) et à la formation de l’E2. La DHT est issue de la testostérone par l’intervention de la 5-α réductase au niveau de la prostate, de la peau, et du foie principalement. L’E2 est métabolisé par l’intermédiaire de l’aromatase principalement dans le tissu adipeux mais aussi dans la peau, le cerveau, le rein, l’os et le testicule.
Effets de la testostérone chez l’homme
Ce sont :
- sur le comportement sexuel : effet sur la libido et les érections nocturnes (effet dose-dépendant) ;
- sur la fonction érectile : action franche sur les érections nocturnes (fréquence et rigidité) et modérée sur les érections psychogènes relationnelles ;
- sur l’éjaculation et l’orgasme : aucun effet franc n’a été démontré sur les orgasmes, il pourrait y avoir un effet sur le volume de l’éjaculat ;
- sur l’appareil musculo-squelettique : effet anabolisant musculaire avec maintien de la masse musculaire. Au niveau osseux, facilitation de la fixation calcique sur l’os ;
- sur le métabolisme glucido-lipidique : augmentation de la synthèse du glycogène et diminution de la glycogénolyse. Par ailleurs, diminution de l’absorption lipidique avec stimulation de la lipolyse adipocytaire, participation dans le stockage androïde des lipides (stockage dans la partie supérieure du corps) ;
- sur l’érythropoïèse : stimulation de l’érythropoïèse ;
- effet psycho-comportemental : maintien de la concentration, effet antifatigabilité, maintien de l’humeur ;
au cours de la vie fœtale : action sur la différenciation sexuelle et l’établissement des organes génitaux masculins ;
au cours de la puberté : développement et maintien des caractères sexuels secondaires.
Testostérone circulante
Dans la circulation sanguine, la testostérone est sous 3 formes (fig. 3) :
La part libre et celle associée à la l’albumine composent la testostérone dite biodisponible.
Le dosage de la testostéronémie totale (celui qui doit être réalisé en première intention, à jeun le matin, entre 8 et 10 h) comporte les 3 fractions de la testostérone circulante. Le taux de testostérone total est susceptible d’être faussé dans certaines situations interférant avec la SHBG ; une fausse diminution de la testostéronémie peut ainsi être rencontrée du fait d’une élévation de la SHBG en cas d’hyperthyroïdie, de cirrhose hépatique, d’anorexie, de prise d’œstrogènes… Une fausse élévation du taux de testostéronémie peut être rencontrée en cas de diminution de la SHBG en cas d’hypothyroïdie, d’obésité, d’hyperinsulinisme, d’hyperprolactinémie, d’acromégalie et lors du vieillissement…
- libre : 2 % (testostérone active biologiquement) ;
- liée à l’albumine : 30-55 % (testostérone faiblement active) ;
- liée à la SHBG : 45-75 % (testostérone non active).
La part libre et celle associée à la l’albumine composent la testostérone dite biodisponible.
Le dosage de la testostéronémie totale (celui qui doit être réalisé en première intention, à jeun le matin, entre 8 et 10 h) comporte les 3 fractions de la testostérone circulante. Le taux de testostérone total est susceptible d’être faussé dans certaines situations interférant avec la SHBG ; une fausse diminution de la testostéronémie peut ainsi être rencontrée du fait d’une élévation de la SHBG en cas d’hyperthyroïdie, de cirrhose hépatique, d’anorexie, de prise d’œstrogènes… Une fausse élévation du taux de testostéronémie peut être rencontrée en cas de diminution de la SHBG en cas d’hypothyroïdie, d’obésité, d’hyperinsulinisme, d’hyperprolactinémie, d’acromégalie et lors du vieillissement…
Physiopathogie
Au niveau testiculaire
Le déficit en testostérone lié à l’âge est principalement lié à une insuffisance testiculaire (insuffisance androgénique périphérique).
Il existe une diminution du nombre de cellules de Leydig et de Sertoli. Il en résulte une élévation du taux de LH avec un dépassement de la réponse leydigienne prouvée par l’absence de réponse aux tests de stimulation à l’HCG.
Il existe une diminution du nombre de cellules de Leydig et de Sertoli. Il en résulte une élévation du taux de LH avec un dépassement de la réponse leydigienne prouvée par l’absence de réponse aux tests de stimulation à l’HCG.
Au niveau central
L’avancée en âge peut être responsable d’une altération de la régulation neuro-endocrine avec une altération de la sécrétion gonadotrope par dysfonctionnement de l’hypothalamus et une diminution de la sensibilité hypophysaire. Il existe alors une élévation de la LH et de la FSH mais d’activité réduite et avec une réponse faible ou retardée à la GnRH.
Épidémiologie
Au cours du vieillissement, il existe une chute du taux de testostérone chez l’homme. Indépendamment de tout symptôme, la baisse du taux de testostérone chez l’homme est estimée à 1 à 3 % par an. Environ 20 % des hommes de 60 ans auraient des taux sériques de testostérone inférieurs à la normale, cette baisse atteindrait 50 % des hommes de plus de 80 ans. Cependant, tous les hommes en hypotestostéronémie n’ont pas de symptômes cliniques d’hypogonadisme et tous les hommes qui ont des symptômes d’hypogonadisme n’ont pas de déficit biologique en testostérone.
Diagnostic
Définition de l’andropause
Consensus de 2008 : le syndrome de déficit en testostérone lié à l’âge est un syndrome clinique et biologique associant à l’âge des symptômes cliniques d’insuffisance en testostérone avec un niveau sanguin de testostérone inférieur à celui d’un adulte en bonne santé pouvant affecter significativement la qualité de vie et entraîner une dysfonction multiple d’organes.
Diagnostic clinique
Il nécessite l’existence de signes d’hypogonadisme. Le symptôme majeur est la baisse de la libido. Les autres manifestations peuvent être une dysfonction érectile, une diminution de la masse et de la force musculaires, une augmentation de la masse graisseuse, une diminution de la densité osseuse, et une diminution de l’élan vital, avec l’apparition d’une humeur dépressive.
Ces symptômes n’étant pas spécifiques d’un hypogonadisme, ces manifestations cliniques doivent être corrélées avec un dosage biologique de la testostérone.
Ces symptômes n’étant pas spécifiques d’un hypogonadisme, ces manifestations cliniques doivent être corrélées avec un dosage biologique de la testostérone.
Diagnostic paraclinique
Le premier dosage de la testostéronémie totale est effectué entre 8 et 10 heures le matin dans un laboratoire fiable (par méthode immunologique ou spectrométrie de masse).
Si le taux est > 12 nmol/L (3,5 ng/mL), il n’y a pas d’intérêt de mettre en place un traitement substitutif, il ne s’agit pas d’un déficit androgénique.
Si le taux est < 8 nmol/L (2,3 ng/mL), un traitement substitutif peut être proposé d’emblée, il s’agit d’un déficit androgénique franc.
En cas de valeur située entre 8 à 12 nmol/L, il convient de réaliser un nouveau dosage de la testostéronémie totale en association avec un dosage de la SHBG et de l’albuminémie afin de calculer la testostéronémie libre.
Chez l’obèse, le dosage de la testostéronémie libre ou biodisponible peut être demandé du fait du risque d’erreur lié aux variations de la SHBG ; un seuil de testostérone libre sérique inférieur à 225 pmol/L (65 pg/mL) peut être alors retenu avant la mise en place d’un traitement substitutif.
En cas d’hypogonadisme avéré, il convient de réaliser d’autres explorations afin d’étayer le diagnostic :
Si le taux est > 12 nmol/L (3,5 ng/mL), il n’y a pas d’intérêt de mettre en place un traitement substitutif, il ne s’agit pas d’un déficit androgénique.
Si le taux est < 8 nmol/L (2,3 ng/mL), un traitement substitutif peut être proposé d’emblée, il s’agit d’un déficit androgénique franc.
En cas de valeur située entre 8 à 12 nmol/L, il convient de réaliser un nouveau dosage de la testostéronémie totale en association avec un dosage de la SHBG et de l’albuminémie afin de calculer la testostéronémie libre.
Chez l’obèse, le dosage de la testostéronémie libre ou biodisponible peut être demandé du fait du risque d’erreur lié aux variations de la SHBG ; un seuil de testostérone libre sérique inférieur à 225 pmol/L (65 pg/mL) peut être alors retenu avant la mise en place d’un traitement substitutif.
En cas d’hypogonadisme avéré, il convient de réaliser d’autres explorations afin d’étayer le diagnostic :
- dosage de la LH : afin de différentier un hypogonadisme primaire ou secondaire ;
- dosage de la prolactine (en cas de testostéronémie basse ou d’hypogonadisme secondaire suspecté).
- réalisation d’une IRM de la selle turcique en cas de signes clinico- biologiques évocateurs d’un adénome hypophysaire (céphalées, trouble du champ visuel, hyperprolactinémie, LH normale ou basse).
Diagnostics différentiels
Les causes des déficits androgéniques secondaires recherchés par le bilan paraclinique sont à connaître afin de ne pas méconnaître une pathologie pouvant bénéficier d’un traitement spécifique (les étiologies de déficit congénital ne sont pas données) :
- adénomes hypophysaires ;
- tumeurs de la selle turcique-craniopharyngiome ;
- traumatismes crâniens ;
- hémochromatose, sarcoïdose, hystiocytose X ;
- anorexie.
Bilan préthérapeutique
Avant la mise en place du traitement substitutif par androgènes, il convient d’éliminer un cancer de la prostate (PSA + toucher rectal) et de faire un bilan de retentissement : dosage de l’hématocrite, réalisation d’une ostéodensitométrie osseuse.
Éliminer une contre-indication au traitement
Contre-indications absolues :
- cancer de la prostate ;
- cancer du sein ;
- antécédents de délinquance sexuelle ;
- polyglobulie ;
- hématocrite > 55 % ;
- risque de thrombose ;
- risque de rétention aiguë d’urine sur adénome de prostate symptomatique ;
- syndrome d’apnées du sommeil.
Bilan préthérapeutique
Il comprend une évaluation prostatique (toucher rectal et dosage de PSA total), un bilan biologique endocrinien (hématocrite, bilan lipidique, bilan hépatique, glycémie) et une ostéodensitométrie osseuse en cas de déficit androgénique lié à l'âge profond ou de points d’appel cliniques.
Conclusion
Le diagnostic du déficit androgénique lié à l’âge se fonde sur l’apparition de signes cliniques non spécifiques (baisse de la libido, asthénie, prise adipeuse, trouble de l’humeur, bouffées de chaleur…) associé à une confirmation par dosage de la testostéronémie totale en premier lieu. Une fois le diagnostic établi, un bilan préthérapeutique devra être effectué avant l’institution d’un traitement substitutif (initialement par un spécialiste d’urologie, d’endocrinologie ou de gynécologie avec renouvellement ensuite possible par le médecin traitant). La surveillance se portera sur l’efficacité qui sera le principal critère de poursuite du traitement. La tolérance du traitement, aussi bien clinique que biologique (fonction mictionnelle, hématocrite, bilan lipidique, glycémie, bilan hépatique, PSA), devrait être également fréquemment surveillée.•
Message de l'auteur
La question du déficit en testostérone lié à l’âge est très transversale :• gériatrie, • endocrinologie, • urologie, • médecine interne…). Elle peut facilement s’intégrer dans de nombreux cas cliniques. Les valeurs de la testostéronémie ne sont pas à retenir précisément car elles varient selon les laboratoires, mais il faut bien savoir quel dosage de la testostéronémie demander et bien connaître les limites d’un tel dosage selon les antécédents du patient.

 Encadrés
Encadrés