Radiologie interventionnelle. Son utilisation est croissante, surtout depuis ces 20 dernières années pour traiter les métastases hépatiques.1, 2 Elle peut être utilisée seule ou venir en complément des deux grandes approches classiques que sont les résections tumorales chirurgicales ou les chimiothérapies par voie intraveineuse.
La radiologie interventionnelle permet une approche qui répond au concept de traitement mini-invasif avec une faible morbi-mortalité et la possibilité d’une réalisation en ambulatoire ou lors d’une courte hospitalisation.
Quelles sont les techniques ?
Cathétérisme de l’artère hépatique
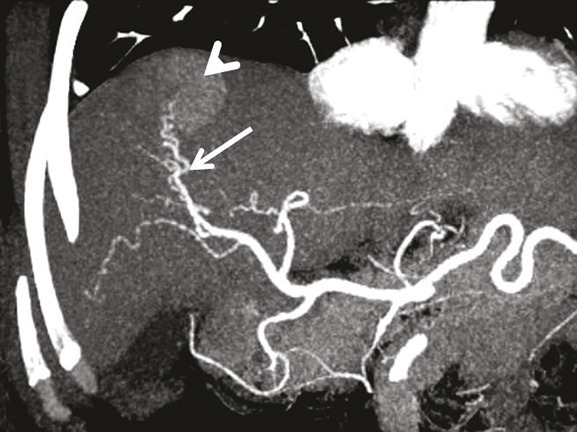
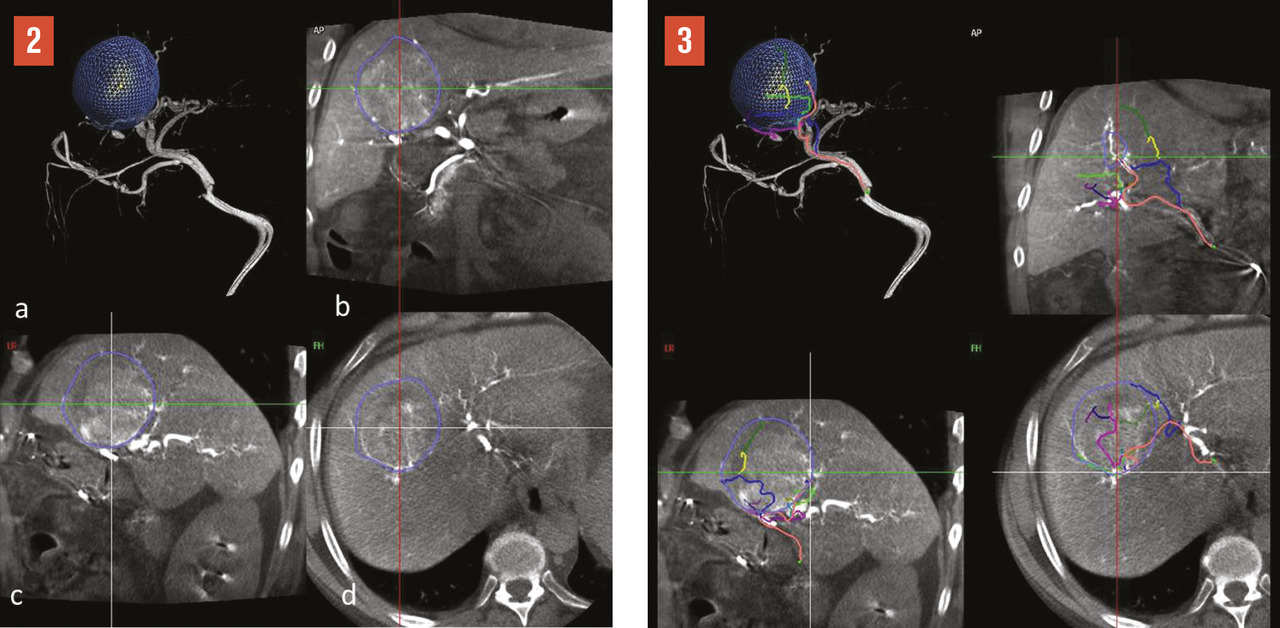
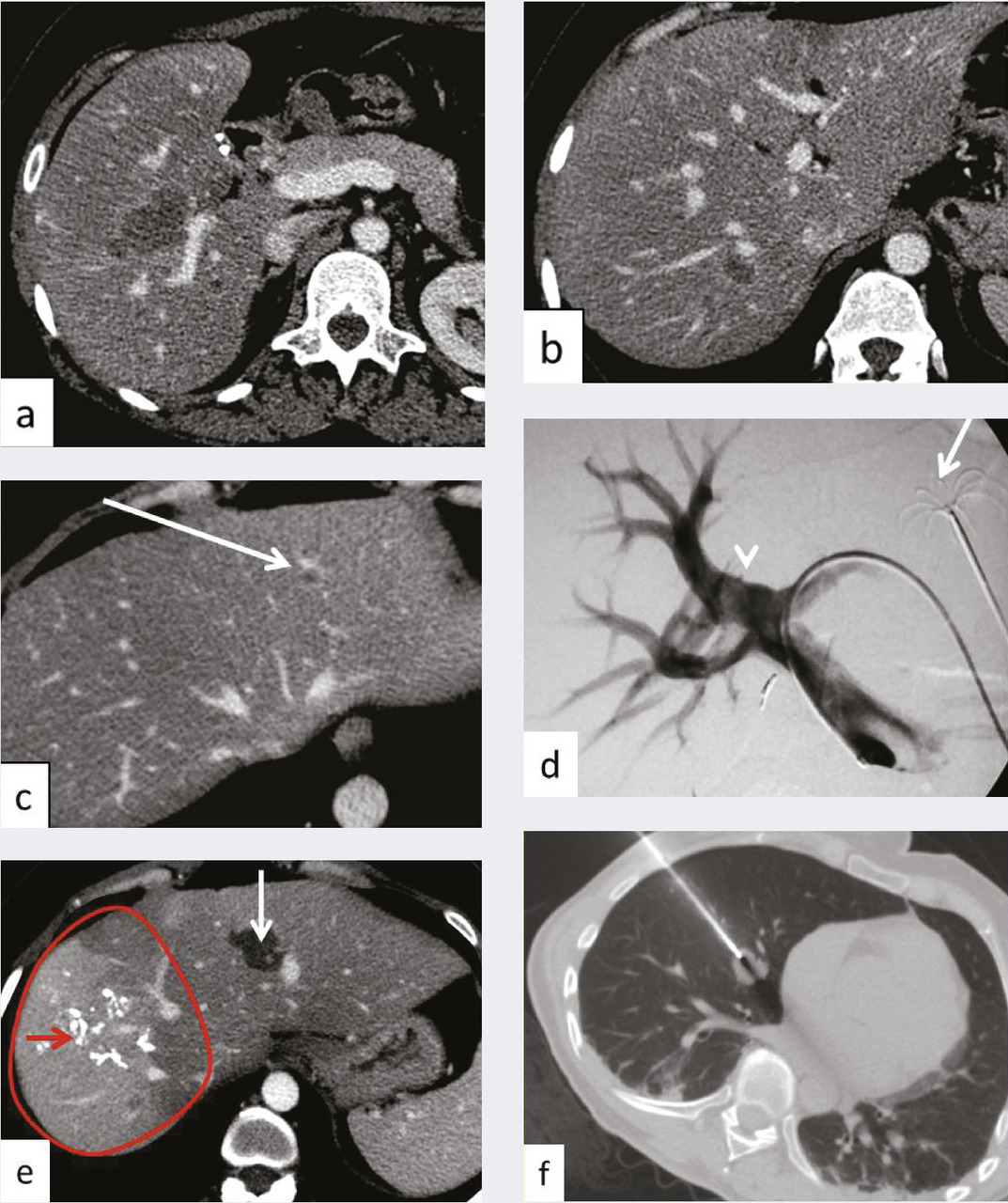
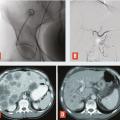
La radiologie interventionnelle a commencé à se développer grâce au progrès de la navigation intra- artérielle à l’aide de cathéters de plus en plus miniaturisés.3 Le positionnement de l’extrémité du cathéter dans l’artère hépatique, voire dans une de ses branches segmentaires à partir d’une voie d’abord périphérique le plus souvent fémorale, permet une obstruction (embolisation)4 [fig. 1 à 4 ], une libération locale intra-artérielle de chimiothérapie5 et plus récemment de microsphères chargées de médicaments6 ou de particules radioactives permettant une irradiation interne sélective du foie.7, 8 Le but est d’obtenir une concentration élevée des agents cytotoxiques au plus près des tumeurs dans le foie avec un faible relargage dans la circulation générale. Enfin, il est possible de placer par radiologie interventionnelle un cathéther dans l’artère hépatique relié à une cham-bre implantable (fig. 5 ). La chimiothérapie est ainsi injectée directement dans le système artériel du foie de façon répétée (en général toutes les deux semaines) avec des concen- trations intrahépatiques de médi- caments bien supérieures à celles obtenues après une injection par voie veineuse. L’objectif est d’obtenir une réduction tumorale qui permette au patient d’être éligible à une éventuelle chirurgie curative.9
Cathétérisme du réseau veineux porte
La navigation endovasculaire peut aussi se faire dans le réseau veineux portal. Le cathétérisme de ce réseau et l’obstruction des veines alimentant les segments métastatiques par embolisation portale segmentaire entraînent une redistribution du flux sanguin vers les veines que l’on maintient perméables. Il est ainsi possible d’induire une atrophie du foie en aval des veines obstruées mais surtout une hypertrophie compensatrice du foie qui reste normalement perfusé. L’objectif est d’entraîner la croissance d’une région du foie non métastatique en quelques semaines pour permettre la résection d’une autre région qui, elle, est tumorale sans courir le risque d’une insuffisance hépato- cellulaire postopératoire. C’est le concept d’atropho-hypertrophie hépatique préopératoire par embolisation portale segmentaire (fig. 6 ).10
Ablation percutanée
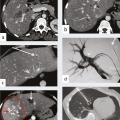
À côté de la voie endovasculaire, une deuxième approche est apparue dans les années 2000 avec l’utilisation d’aiguilles dont l’extrémité est mise en place dans la tumeur par voie percutanée sous contrôle de l’imagerie, le plus souvent l’échographie ou la tomodensitométrie. L’aiguille libère dans la tumeur un courant de radiofréquence qui provoque une augmen- tation locale de la température et la détruit (fig. 6 et 7 ). Ces techniques d’ablathermie constituent un progrès majeur, et d’autres agents physiques tels que les micro-ondes ou la cryogenèse ont été développés par la suite.11, 12 Il est même possible de détruire la tumeur sans effraction cutanée à l’aide d’ultrasons focalisés de haute énergie.13
Ainsi, l’ablathermie percutanée peut constituer, en intention curative, une alternative à la chirurgie quand celle-ci n’est pas possible comme par exemple dans le cas de métastases hépatiques non opérables mais accessibles à une destruction percutanée moins invasive.
L’ablathermie est aussi souvent associée en peropératoire à la résec- tion chirurgicale quand les métastases ne sont pas toutes résécables chirurgicalement.1, 2
Actuellement, la radiologie inter- ventionnelle est donc indispensable pour préparer la chirurgie, voire la compléter, et ainsi élargir les pos- sibilités curatives (fig. 6 ). Tous les centres experts en pathologie oncologique colorectale et hépatique sont associés à des services de radiologie interventionnelle équipés de blocs dédiés incluant des dispositifs de radiologie vasculaire, d’échographie et souvent de tomodensitométrie.
Ainsi, l’ablathermie percutanée peut constituer, en intention curative, une alternative à la chirurgie quand celle-ci n’est pas possible comme par exemple dans le cas de métastases hépatiques non opérables mais accessibles à une destruction percutanée moins invasive.
L’ablathermie est aussi souvent associée en peropératoire à la résec- tion chirurgicale quand les métastases ne sont pas toutes résécables chirurgicalement.1, 2
Actuellement, la radiologie inter- ventionnelle est donc indispensable pour préparer la chirurgie, voire la compléter, et ainsi élargir les pos- sibilités curatives (
Principaux traitements en pratique
Méthodes d’ablation percutanée guidée par l’imagerie
C’est la seule approche réalisée dans un but curatif. Les traitements mini-invasifs percutanés d’ablation tumorale sont fondés sur la mise en place d’une aiguille dans la tumeur guidée par l’imagerie, principalement l’échographie souvent couplée à la tomodensitométrie. Il n’existe qu’une technique ne nécessitant pas d’effraction cutanée, l’application d’ultrasons focalisés de haute énergie.13
Les ablations peuvent être thermi- ques par radiofréquences (fig. 6 et 7 ), micro-ondes, laser et cryoablation, on non thermiques par injection d’un agent chimique ou par électroporation.14
Actuellement, les traitements les plus utilisés et faisant l’objet d’une littérature abondante sont princi- palement la radiofréquence et plus récemment les micro-ondes.12 Les autres techniques ne sont pratiquement plus utilisées dans cette indi- cation, comme le laser et les agents chimiques, et les autres (cryoablation, électroporation) ne sont utilisées que par très peu d’équipes avec un manque de données et de comparaisons sur des séries de patients significatives.
Ces traitements sont réalisés dans la grande majorité des cas sous anesthésie générale, avec dans certains cas une prise en charge ambulatoire.
Les ablations peuvent être thermi- ques par radiofréquences (
Actuellement, les traitements les plus utilisés et faisant l’objet d’une littérature abondante sont princi- palement la radiofréquence et plus récemment les micro-ondes.12 Les autres techniques ne sont pratiquement plus utilisées dans cette indi- cation, comme le laser et les agents chimiques, et les autres (cryoablation, électroporation) ne sont utilisées que par très peu d’équipes avec un manque de données et de comparaisons sur des séries de patients significatives.
Ces traitements sont réalisés dans la grande majorité des cas sous anesthésie générale, avec dans certains cas une prise en charge ambulatoire.
Méthodes locorégionales par cathétérisme artériel
Il s’agit de l’injection locale dans le foie de médicaments, d’agent d’embolisation ou d’agents radioactifs. Après cathétérisme artériel à partir le plus souvent de l’artère fémorale et repérage des lésions, le radiologue interventionnel injecte localement différents types d’agents selon le type de métastases, l’extension de la maladie et les traitements antérieurs, après décision en réunion de concertation multidisciplinaire (fig. 1 à 4 ).
Il existe aussi la possibilité de réaliser une chimiothérapie intra-artérielle répétée sur plusieurs cycles par la mise en place d’un cathéter dans l’artère hépatique branchée sur une chambre implantable placée dans la région inguinale (fig. 5 ).
Ces traitements sont réalisés sous anesthésie locale, sauf pour la mise en place d’un cathéter avec chambre implantable, qui se pose sous anesthésie générale. La prise en charge ambulatoire est possible.
Il existe aussi la possibilité de réaliser une chimiothérapie intra-artérielle répétée sur plusieurs cycles par la mise en place d’un cathéter dans l’artère hépatique branchée sur une chambre implantable placée dans la région inguinale (
Ces traitements sont réalisés sous anesthésie locale, sauf pour la mise en place d’un cathéter avec chambre implantable, qui se pose sous anesthésie générale. La prise en charge ambulatoire est possible.
Atropho-hypertrophie hépatique par embolisation portale
Cette technique repose sur les propriétés naturelles de régénération du tissu hépatique.
L’apport sanguin hépatique est issu pour 30 % de l’artère hépatique et pour 70 % du tronc porte. L’occlusion d’une branche portale droite s’accompagne ainsi d’une redistribution sanguine dans la branche gauche avec en corollaire une hypertrophie des segments hépatiques alimentés par la branche perméable du lobe gauche.
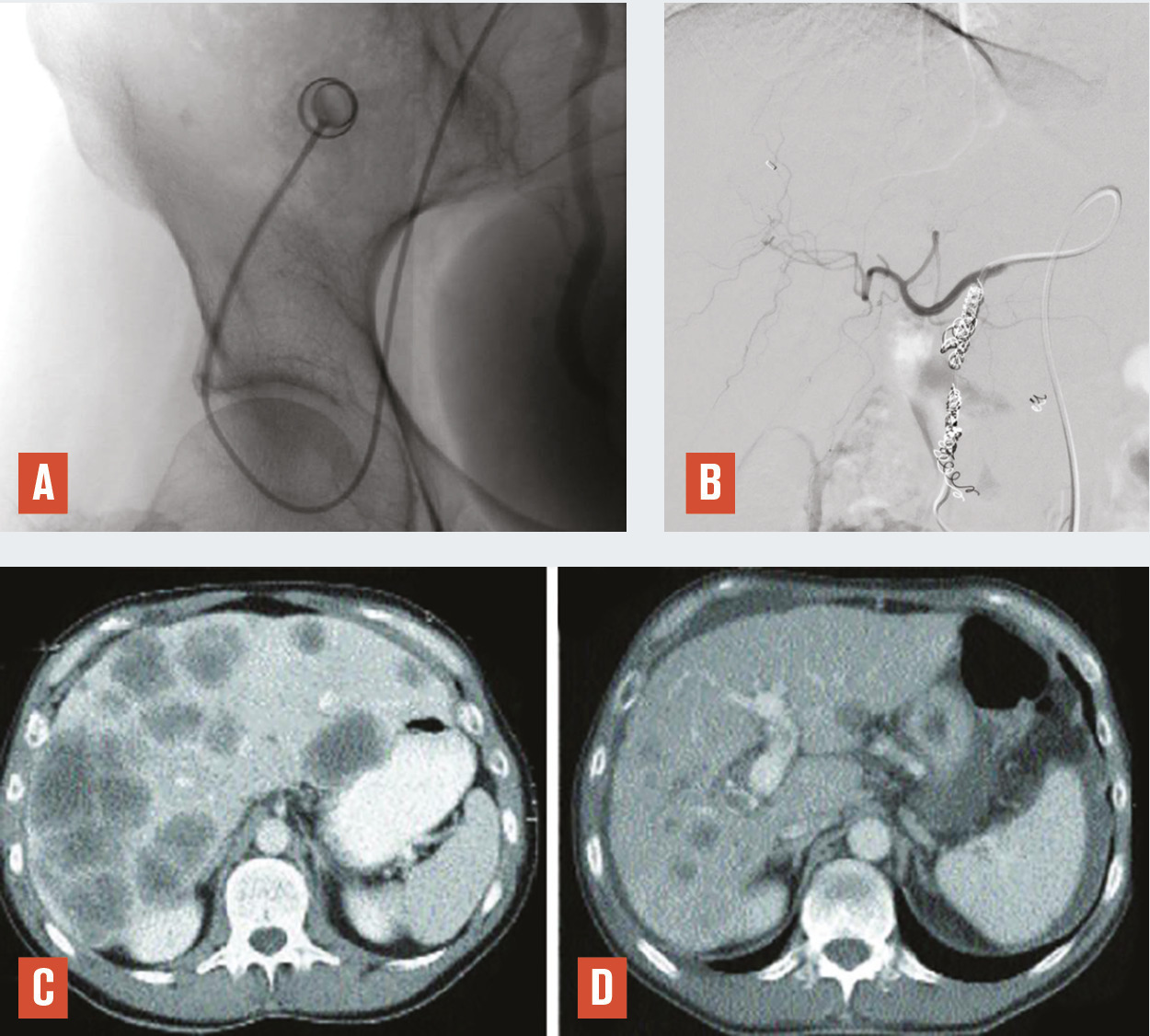
Une hépatectomie ne peut être réalisée que s’il reste au moins 30 % de volume hépatique après chirurgie pour éviter une insuffisance hépatocellulaire aiguë postopératoire. Ainsi dans le cas d’un patient qui nécessite une hépatectomie droite en raison de la maladie métastatique et dont le foie gauche est épargné mais a un volume inférieur à 30 %, ce traitement de radiologie inter- ventionnelle guidée par l’imagerie avec embolisation des branches portales droites va permettre d’ob- tenir une hypertrophie hépatique du foie gauche par redistribution vasculaire permettant, dans un délai en général de 40 jours, une intervention chirurgicale. Il est à noter que l’éventuelle présence d’une localisation secondaire dans le foie gauche peut être traitée par thermothérapie dans le même temps que l’embolisation portale (fig. 6 ).
Ce traitement est réalisé sous anes- thésie générale, avec possibilité de prise en charge ambulatoire.
L’apport sanguin hépatique est issu pour 30 % de l’artère hépatique et pour 70 % du tronc porte. L’occlusion d’une branche portale droite s’accompagne ainsi d’une redistribution sanguine dans la branche gauche avec en corollaire une hypertrophie des segments hépatiques alimentés par la branche perméable du lobe gauche.
Une hépatectomie ne peut être réalisée que s’il reste au moins 30 % de volume hépatique après chirurgie pour éviter une insuffisance hépatocellulaire aiguë postopératoire. Ainsi dans le cas d’un patient qui nécessite une hépatectomie droite en raison de la maladie métastatique et dont le foie gauche est épargné mais a un volume inférieur à 30 %, ce traitement de radiologie inter- ventionnelle guidée par l’imagerie avec embolisation des branches portales droites va permettre d’ob- tenir une hypertrophie hépatique du foie gauche par redistribution vasculaire permettant, dans un délai en général de 40 jours, une intervention chirurgicale. Il est à noter que l’éventuelle présence d’une localisation secondaire dans le foie gauche peut être traitée par thermothérapie dans le même temps que l’embolisation portale (
Ce traitement est réalisé sous anes- thésie générale, avec possibilité de prise en charge ambulatoire.
Quelles sont les principales indications ?
Métastases hépatiques de cancer colorectal
Les métastases hépatiques sont présentes chez 45 % des patients atteints d’un cancer colorectal.
Entre 15 et 25 % des patients ont des métastases hépatiques lors de la découverte du cancer (synchrone) et 15 à 20 % des patients vont les voir apparaître après la résection de la tumeur digestive (métachrone). Si la résection chirurgicale de ces métastases constitue l’approche de référence chez les patients éligibles, avec une survie à 5 ans de 28 à 58 % selon les séries, malheureusement celle-ci n’est possible que chez 10 à 20 % des patients au moment de la découverte de la maladie, avec pour les autres une survie de 20 à 24 mois sous chimiothérapie par voie générale seule.15 Dans ce cas, les traitements percutanés guidés par l’imagerie tels que les ablathermies par radio- fréquence ou plus récemment par micro-ondes constituent une alternative efficace chez des patients non opérables ou qui récidivent après une chirurgie de résection. Selon les séries, la survie à 5 ans varie alors de 18 à 44 %.1 Ces différences s’expliquent par des critères de sélec- tion variables selon les équipes. Ces techniques mini-invasives s’accompagnent d’une morbi-mortalité moins importante que la chirurgie.
La radiologie interventionnelle offre aussi la possibilité de réaliser d’autres traitements locorégionaux chez les patients qui ont une récidive ne permettant plus une résection chirurgicale ou une ablathermie percutanée en intention curative. Si ces approches peuvent aussi permettre de rendre à nouveau les patients éligibles à un traitement chirurgical alors qu’ils étaient initialement non résécables, ils peuvent aussi réduire les récidives, prolonger la survie et améliorer le confort de vie de ceux dont les métastases ne sont pas résécables.
Dans ce cas, la voie d’accès est intra- artérielle, soit en injectant dans l’artère hépatique des chimiothérapies microsphères chargées à l’irinotécan6 ou des particules radioactives,8 soit en plaçant un cathéter dans l’artère hépatique, avec chambre implantable, permettant d’injecter de plus fortes doses de chimiothérapie in situ.9
Le choix de la stratégie thérapeutique se décide en réunion de concertation multidisciplinaire.
Entre 15 et 25 % des patients ont des métastases hépatiques lors de la découverte du cancer (synchrone) et 15 à 20 % des patients vont les voir apparaître après la résection de la tumeur digestive (métachrone). Si la résection chirurgicale de ces métastases constitue l’approche de référence chez les patients éligibles, avec une survie à 5 ans de 28 à 58 % selon les séries, malheureusement celle-ci n’est possible que chez 10 à 20 % des patients au moment de la découverte de la maladie, avec pour les autres une survie de 20 à 24 mois sous chimiothérapie par voie générale seule.15 Dans ce cas, les traitements percutanés guidés par l’imagerie tels que les ablathermies par radio- fréquence ou plus récemment par micro-ondes constituent une alternative efficace chez des patients non opérables ou qui récidivent après une chirurgie de résection. Selon les séries, la survie à 5 ans varie alors de 18 à 44 %.1 Ces différences s’expliquent par des critères de sélec- tion variables selon les équipes. Ces techniques mini-invasives s’accompagnent d’une morbi-mortalité moins importante que la chirurgie.
La radiologie interventionnelle offre aussi la possibilité de réaliser d’autres traitements locorégionaux chez les patients qui ont une récidive ne permettant plus une résection chirurgicale ou une ablathermie percutanée en intention curative. Si ces approches peuvent aussi permettre de rendre à nouveau les patients éligibles à un traitement chirurgical alors qu’ils étaient initialement non résécables, ils peuvent aussi réduire les récidives, prolonger la survie et améliorer le confort de vie de ceux dont les métastases ne sont pas résécables.
Dans ce cas, la voie d’accès est intra- artérielle, soit en injectant dans l’artère hépatique des chimiothérapies microsphères chargées à l’irinotécan6 ou des particules radioactives,8 soit en plaçant un cathéter dans l’artère hépatique, avec chambre implantable, permettant d’injecter de plus fortes doses de chimiothérapie in situ.9
Le choix de la stratégie thérapeutique se décide en réunion de concertation multidisciplinaire.
Métastases hépatiques de tumeurs neuro-endocrines
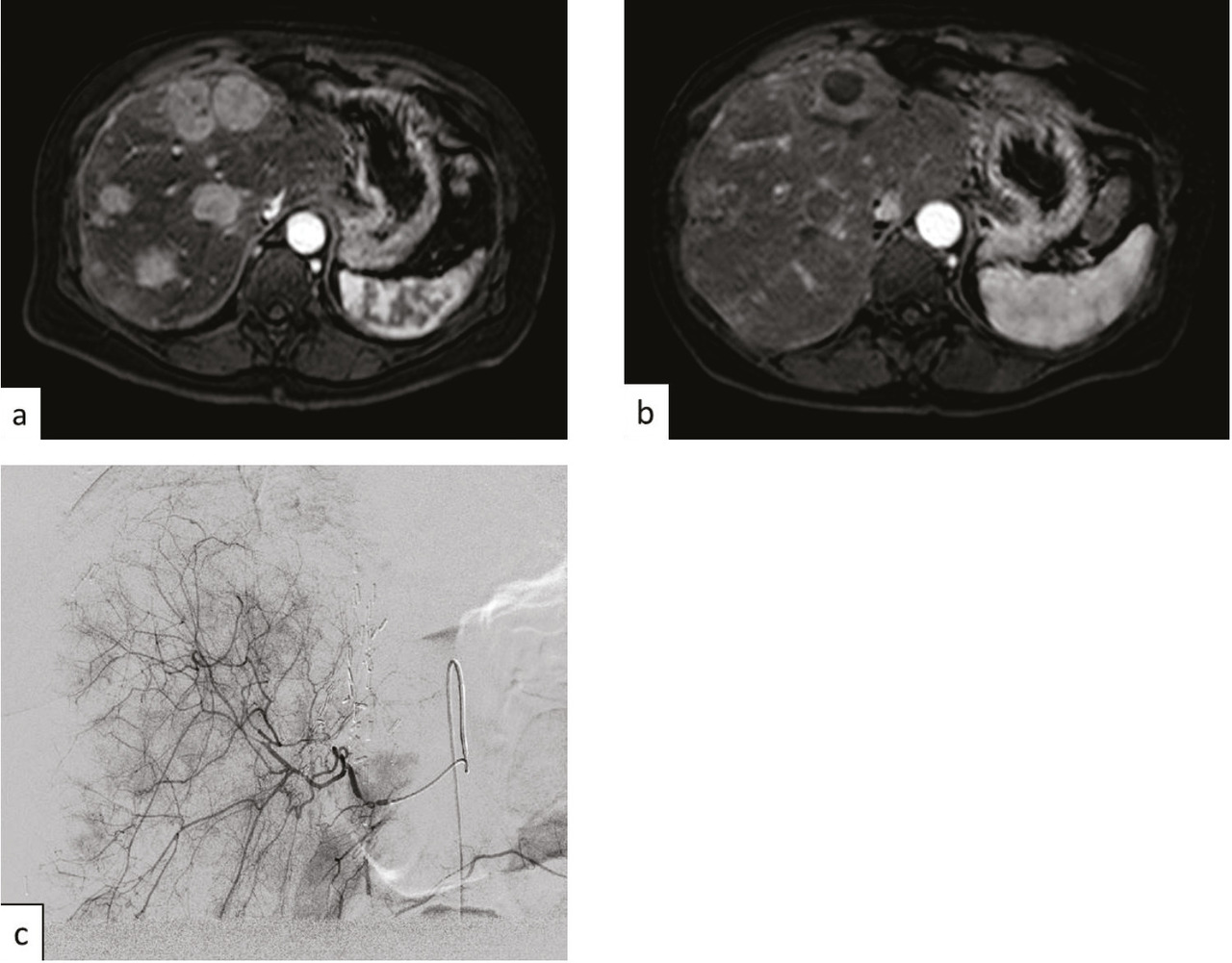
Les tumeurs neuro-endocrines sont relativement rares, avec une incidence de 5/100 000.16 Elles provien- nent de différents types de cellules neuro-endocrines qui ne sont pas uniquement présentes dans les glandes endocrines mais aussi dans de nombreux tissus, avec une prédominance dans le poumon dans 30 % des cas, et le système digestif, principalement le pancréas et le tube digestif creux dans 36 % des cas. Pour l’appareil digestif, ces tumeurs sont souvent découvertes à un stade avancé, avec des métastases hépatiques multiples. Les traitements ciblés sont privilégiés lorsque les tumeurs sont bien différenciées. En cas de tumeurs peu différenciées, les patients ayant des métastases peu nombreuses peuvent être traités par une chirurgie de résection ou par ablathermie, et les patients ayant une maladie diffuse par chimio- embolisation (fig. 4 ) ou injection de particules radioactives, sans consensus actuellement en raison de la taille limitée des séries. Là aussi, la décision est prise en réunion de concertation multidisciplinaire.
Métastases hépatiques de tumeurs d’origines variées
Actuellement, il n’y a pas de recommandations très claires qui permettent de proposer la radiologie interventionnelle pour le traitement de ces métastases. Les indications dépendent donc des expériences locales et sont dis- cutées au cas par cas.
Alternatives et élargissement des indications
La radiologie interventionnelle offre de multiples alternatives pour améliorer la survie des patients et leur confort. Elle est souvent combinée avec d’autres traitements et permet d’élargir l’indication de traitements curatifs en cas de métastases hépatiques de cancers colorectaux. Elle est réalisée dans des centres experts répartis sur le territoire qui combinent la présence de chirurgiens spécialisés du foie, d’oncologues digestifs et de radiologues inter- ventionnels spécialisés en hépato- gastro-entérologie.
Références
1. Mahnken AH, Pereira PL, de Baère T. Interventional oncologic approaches to liver metastases. Radiology 2013;266:407-30.
2. Fiorentini G, Sarti D, Aliberti C, Carandina R, Mambrini A, Guadagni S. Multidisciplinary approach of colorectal cancer liver metastases. World J Clin Oncol 2017;8:190-202.
3. Baum RA, Baum S. Interventional radiology: a half century of innovation. Radiology 2014;273:S75-91.
4. Yamada R, Sato M, Kawabata M, Nakatsuka H, Nakamura K, Takashima S. Hepatic artery embolization in 120 patients with unresectable hepatoma. Radiology 1983;148:397-401.
5. Lorenz M, Müller HH. Randomized, multicenter trial of fluorouracil plus leucovorin administered either via hepatic arterial or intravenous infusion versus fluorodeoxyuridine administered via hepatic arterial infusion in patients with nonresectable liver metastases from colorectal carcinoma. J Clin Oncol 2000;18:243-54.
6. Fiorentini G, Aliberti C, Tilli M, et al. Intra-arterial infusion of irinotecan-loaded drug-eluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res 2012;32:1387-95.
7. Sofocleous CT, Violari EG, Sotirchos VS, et al. Radioembolization as a salvage therapy for heavily pretreated patients with colorectal cancer liver metastases: factors that affect outcomes. Clin Colorectal Cancer 2015;14:296-305.
8. Boas FE, Bodei L, Sofocleous CT. Radioembolization of colorectal liver metastases: indications, technique, and outcomes. J Nucl Med 2017;58:104S-111S.
9. Deschamps F, Rao P, Teriitehau C, et al. Percutaneous femoral implantation of an arterial port catheter for intraarterial chemotherapy: feasibility and predictive factors of long-term functionality. J Vasc Interv Radiol 2010;21:1681-8.
10. Di Stefano DR, de Baere T, Denys A, et al. Preoperative percutaneous portal vein embolization: evaluation of adverse events in 188 patients. Radiology 2005;234:625-30.
11. Shady W, Petre EN, Gonen M, et al. Percutaneous radiofrequency ablation of colorectal cancer liver metastases: factors affecting outcomes--a 10-year experience at a single center. Radiology 2016;278:601-11.
12. Pathak S, Jones R, Tang JMF, et al. Ablative therapies for colorectal liver metastases: a systematic review. Colorectal Dis 2011;13:e252-265.
13. Trillaud H. Ultrasons focalisés de haute intensité dans la pathologie hépatique. Rev Prat 2017;67:479-82.
14. Sutter O, Calvo J, N’Kontchou G, et al. Safety and efficacy of irreversible electroporation for the treatment of hepatocellular carcinoma not amenable to thermal ablation techniques: a retrospective single-center case series. Radiology 2017;284:877-86.
15. Gallagher DJ, Kemeny N. Metastatic colorectal cancer: from improved survival to potential cure. Oncology 2010;78:237-48.
16. Yao JC, Hassan M, Phan A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008;26:3063-72.
2. Fiorentini G, Sarti D, Aliberti C, Carandina R, Mambrini A, Guadagni S. Multidisciplinary approach of colorectal cancer liver metastases. World J Clin Oncol 2017;8:190-202.
3. Baum RA, Baum S. Interventional radiology: a half century of innovation. Radiology 2014;273:S75-91.
4. Yamada R, Sato M, Kawabata M, Nakatsuka H, Nakamura K, Takashima S. Hepatic artery embolization in 120 patients with unresectable hepatoma. Radiology 1983;148:397-401.
5. Lorenz M, Müller HH. Randomized, multicenter trial of fluorouracil plus leucovorin administered either via hepatic arterial or intravenous infusion versus fluorodeoxyuridine administered via hepatic arterial infusion in patients with nonresectable liver metastases from colorectal carcinoma. J Clin Oncol 2000;18:243-54.
6. Fiorentini G, Aliberti C, Tilli M, et al. Intra-arterial infusion of irinotecan-loaded drug-eluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res 2012;32:1387-95.
7. Sofocleous CT, Violari EG, Sotirchos VS, et al. Radioembolization as a salvage therapy for heavily pretreated patients with colorectal cancer liver metastases: factors that affect outcomes. Clin Colorectal Cancer 2015;14:296-305.
8. Boas FE, Bodei L, Sofocleous CT. Radioembolization of colorectal liver metastases: indications, technique, and outcomes. J Nucl Med 2017;58:104S-111S.
9. Deschamps F, Rao P, Teriitehau C, et al. Percutaneous femoral implantation of an arterial port catheter for intraarterial chemotherapy: feasibility and predictive factors of long-term functionality. J Vasc Interv Radiol 2010;21:1681-8.
10. Di Stefano DR, de Baere T, Denys A, et al. Preoperative percutaneous portal vein embolization: evaluation of adverse events in 188 patients. Radiology 2005;234:625-30.
11. Shady W, Petre EN, Gonen M, et al. Percutaneous radiofrequency ablation of colorectal cancer liver metastases: factors affecting outcomes--a 10-year experience at a single center. Radiology 2016;278:601-11.
12. Pathak S, Jones R, Tang JMF, et al. Ablative therapies for colorectal liver metastases: a systematic review. Colorectal Dis 2011;13:e252-265.
13. Trillaud H. Ultrasons focalisés de haute intensité dans la pathologie hépatique. Rev Prat 2017;67:479-82.
14. Sutter O, Calvo J, N’Kontchou G, et al. Safety and efficacy of irreversible electroporation for the treatment of hepatocellular carcinoma not amenable to thermal ablation techniques: a retrospective single-center case series. Radiology 2017;284:877-86.
15. Gallagher DJ, Kemeny N. Metastatic colorectal cancer: from improved survival to potential cure. Oncology 2010;78:237-48.
16. Yao JC, Hassan M, Phan A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008;26:3063-72.