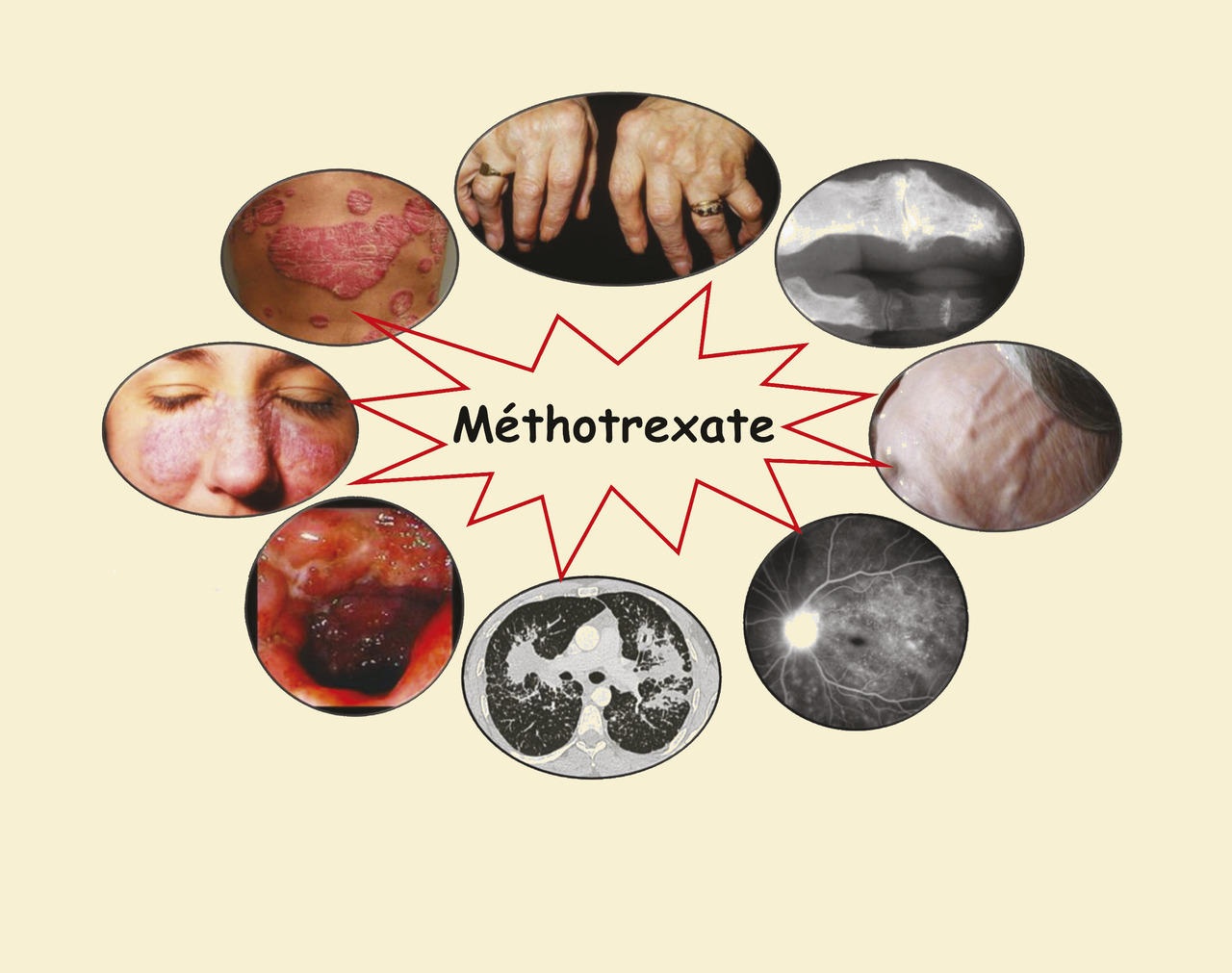
Une vieille arme très actuelle, de maniement délicat.
Le méthotrexate (ou améthoptérine) est un antimétabolite, découvert en 1947, utilisé peu après à fortes doses, comme chimiothérapie antinéoplasique active sur divers types de cancers, sur les choriocarcinomes placentaires, les leucémies aiguës lymphoblastiques et certains lymphomes malins non hodgkiniens. Ses propriétés antiprolifératives et immunosuppressives, lorsqu’il est utilisé à faibles doses, reposent essentiellement sur son activité antifolique. Elles ont été exploitées avec succès au début des années 1980, notamment dans la polyarthrite rhumatoïde et le psoriasis. Depuis la révolution des biothérapies, la place du méthotrexate s’est modifiée dans ses indications princeps, tout en gardant celle de traitement de référence, contre lequel (ou en association duquel) les nouvelles molécules sont testées. En parallèle, d’autres perspectives thérapeutiques sont apparues, notamment en médecine interne, où le méthotrexate représente un solide traitement de 2e ou 3e ligne dans diverses pathologies inflammatoires ou auto-immunes chroniques.
Structure et mécanisme d’action
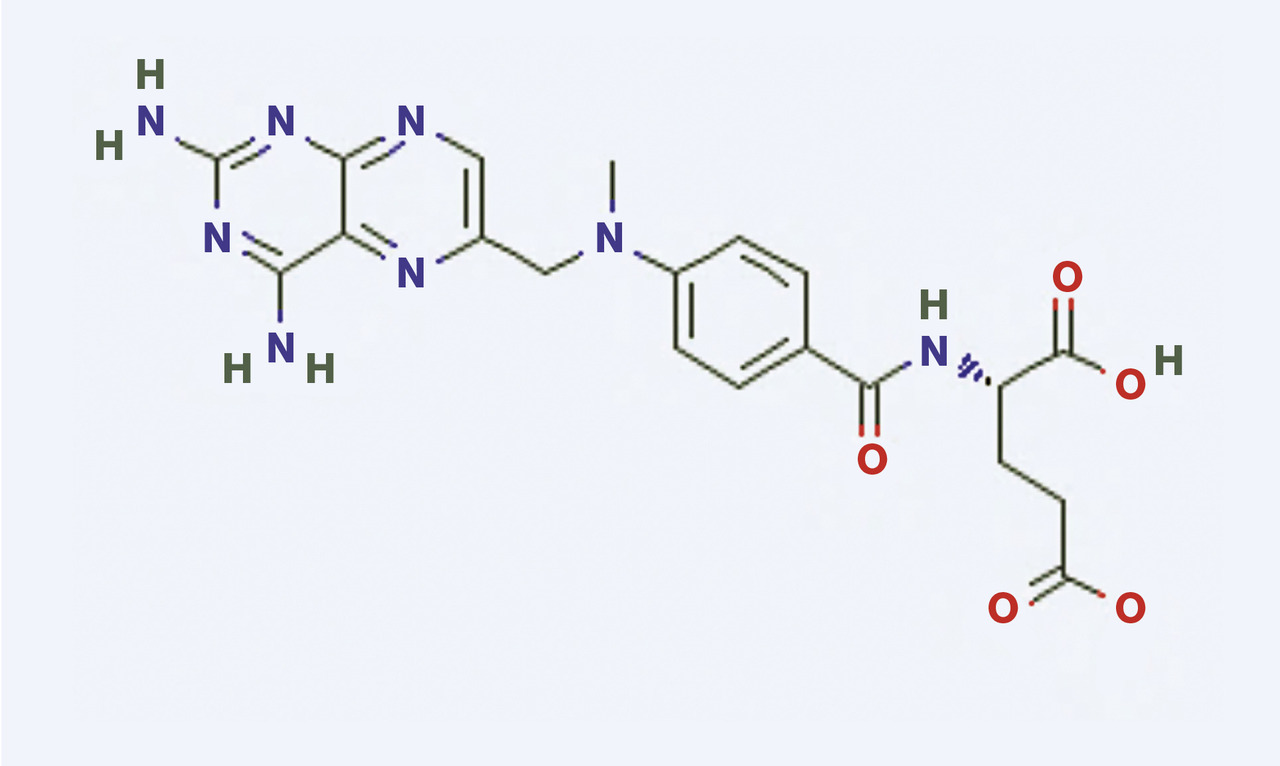
Le méthotrexate, ou acide 4-amino-10-méthylfolique, est un analogue de l’acide folique (figure) , cofacteur essentiel dans la synthèse des précurseurs de l’ADN et de l’ARN. Il inhibe de façon compétitive non spécifique la dihydrofolate réductase (DHFR), ce qui bloque la synthèse du thymidylate, interrompt la synthèse d’ADN et d’ARN et stoppe la prolifération cellulaire. Il est cycle-dépendant, et agit surtout au moment de la phase S du cycle cellulaire, donc principalement sur les tissus à haut renouvellement cellulaire (digestif, hématopoïétique, épithélium cutanéo-muqueux). Aux doses supérieures ou égales à 30 mg/m2, le méthotrexate agit aussi sur les cellules en phase G. Nombre d’effets anti-inflammatoires et certains effets secondaires du méthotrexate passent par l’accumulation intracellulaire d’adénosine et la fixation de celle-ci sur des récepteurs spécifiques.
Propriétés pharmacodynamiques
L’efficacité du méthotrexate à fortes doses dans les pathologies malignes est liée à ses propriétés antimétabolites. À faibles doses dans les maladies chroniques non malignes, son efficacité résulte plutôt d’une d’activité anti-inflammatoire (inhibition du chimiotactisme des polynucléaires) et/ou immunomodulatrice (inhibition dose-dépendante de la liaison de l’interleukine-1 avec son récepteur sur les lymphocytes T). Après absorption, 10 % du méthotrexate est converti en 17-hydroxyméthotrexate qui, avec le méthotrexate non converti, est majoritairement éliminé par voie rénale en 6 à 8 heures. Après pénétration intracellulaire, le méthotrexate est métabolisé en dérivés polyglutamates qui persistent plus longtemps dans les tissus avec une demi-vie d’élimination de 1 à 4 semaines. Le dosage de ces polyglutamates a été proposé pour évaluer l’observance mais n’est pas réalisé de façon courante.
Pharmacocinétique
La biodisponibilité du méthotrexate est bonne, quelle que soit la voie d’administration, mais avec de larges variations interindividuelles en termes de pic plasmatique et d’aire sous la courbe. Par voie orale, un effet de saturation de l’absorption apparaît à partir de 30 mg/m2, d’où une disponibilité de 60 % seulement.
Le méthotrexate est lié de 50 à 60 % aux protéines plasmatiques, principalement l’albumine. La fraction libre, seule active, est augmentée en cas d’hypoalbuminémie ou de compétition avec d’autres molécules, augmentant ainsi sa toxicité.
La diffusion tissulaire est bonne, mais le méthotrexate passe mal la barrière hémato-encéphalique. Chez les patients ayant un 3e secteur (ascite, épanchement pleural), il passe dans ces secteurs d’où il s’élimine très lentement, modifiant la demi-vie d’élimination finale, avec un risque accru de toxicité.
Le méthotrexate pénètre dans la cellule par une voie de transport actif des folates réduits et y subit une polyglutamatation enzymatique. Ces dérivés polyglutamates sont actifs sur la DHFR et la thymidylate synthétase et de longue persistance intracellulaire (plusieurs semaines dans le rein et plusieurs mois dans le foie), ce qui augmente la durée de l’effet cytotoxique.
Le méthotrexate est faiblement métabolisé au niveau hépatique, et l’élimination est principalement urinaire (60-90 %), sous forme inchangée. Le méthotrexate est indétectable dans le sérum 24 heures après une prise unique. L’élimination biliaire est faible (< 20 %), mais suivie d’un cycle entérohépatique qui explique une demi-vie d’élimination prolongée. L’élimination est diminuée en cas d’insuffisance rénale, d’où un risque de toxicité accrue.
Le dosage du méthotrexate, principalement par chromatographie liquide haute performance, est réservé à son usage à fortes doses dans les pathologies malignes.
Les interactions médicamenteuses sont nombreuses ; certaines, très dangereuses, sont à bien connaître (tableau 1 ).
Le méthotrexate est lié de 50 à 60 % aux protéines plasmatiques, principalement l’albumine. La fraction libre, seule active, est augmentée en cas d’hypoalbuminémie ou de compétition avec d’autres molécules, augmentant ainsi sa toxicité.
La diffusion tissulaire est bonne, mais le méthotrexate passe mal la barrière hémato-encéphalique. Chez les patients ayant un 3e secteur (ascite, épanchement pleural), il passe dans ces secteurs d’où il s’élimine très lentement, modifiant la demi-vie d’élimination finale, avec un risque accru de toxicité.
Le méthotrexate pénètre dans la cellule par une voie de transport actif des folates réduits et y subit une polyglutamatation enzymatique. Ces dérivés polyglutamates sont actifs sur la DHFR et la thymidylate synthétase et de longue persistance intracellulaire (plusieurs semaines dans le rein et plusieurs mois dans le foie), ce qui augmente la durée de l’effet cytotoxique.
Le méthotrexate est faiblement métabolisé au niveau hépatique, et l’élimination est principalement urinaire (60-90 %), sous forme inchangée. Le méthotrexate est indétectable dans le sérum 24 heures après une prise unique. L’élimination biliaire est faible (< 20 %), mais suivie d’un cycle entérohépatique qui explique une demi-vie d’élimination prolongée. L’élimination est diminuée en cas d’insuffisance rénale, d’où un risque de toxicité accrue.
Le dosage du méthotrexate, principalement par chromatographie liquide haute performance, est réservé à son usage à fortes doses dans les pathologies malignes.
Les interactions médicamenteuses sont nombreuses ; certaines, très dangereuses, sont à bien connaître (
Formes disponibles, posologie, voie et rythme d’administration
Le méthotrexate est commercialisé sous forme de comprimés à 2,5 mg (Méthotrexate Bellon, Novatrex) ou à 10 mg (Imeth), de solution injectable à 5, 25, 50 ou 100 mg (Méthotrexate Bellon, Ledertrexate) ou de solution injectable en seringue préremplie à 10 mg/mL (Metoject) ou entre 7,5 et 25 mg (Nordimet). Par voie orale, intramusculaire ou sous-cutanée, la posologie usuelle est de 10 à 15 mg/m2 en une prise par semaine, selon la pathologie.
Les doses maximales sont de 25 mg par semaine (formes orales et parentérales). Dans l’arthrite chronique juvénile, le protocole national de diagnostic et de soins (PNDS) de 2015 recommande une dose maximale de 15-20 mg/m2 de surface corporelle.*
Les doses maximales sont de 25 mg par semaine (formes orales et parentérales). Dans l’arthrite chronique juvénile, le protocole national de diagnostic et de soins (PNDS) de 2015 recommande une dose maximale de 15-20 mg/m2 de surface corporelle.*
Contre-indications et indications (hors pathologies malignes)
Le tableau 2 résume les principales contre-indications, absolues ou relatives, du méthotrexate. Le spectre d’utilisation du méthotrexate faible dose dépasse largement ses indications officielles (autorisations de mise sur le marché [AMM]) et couvre de nombreuses spécialités (tableau 3 ). Le délai d’obtention d’une réponse thérapeutique objectivable est généralement de 8 à 12 semaines ou même plus long, d’autant plus que l’on a procédé à une escalade de dose progressive, pour limiter l’intolérance. Les doses habituellement efficaces varient d’une pathologie à l’autre.
Dans la polyarthrite rhumatoïde, le méthotrexate est l’option recommandée en 1re ligne. En cas de réponse inadéquate sans problème d’intolérance, il peut être remplacé par le léflunomide ou la salazopyrine, en l’absence de facteur de mauvais pronostic ; en leur présence, on préfère introduire un anti-tumor necrosis factor alpha (anti-TNF).
Dans le psoriasis étendu résistant aux thérapeutiques classiques, la dose préconisée varie de 7,5 à 30 mg/semaine, le principe étant de chercher la dose minimale efficace.
Dans la maladie de Crohn évolutive, le méthotrexate est plus utile en traitement d’attaque qu’en entretien ; une rémission complète est obtenue dans 40 % des cas par une monothérapie parentérale (de 15 à 25 mg/semaine).
Le méthotrexate s’avère souvent efficace dans le traitement du lupus avec atteinte articulaire et/ou cutanée réfractaire aux antipaludéens de synthèse combinés à une corticothérapie orale (atteinte articulaire) ou topique (atteinte cutanée). Avant d’y recourir, il faut s’assurer de la bonne observance aux antipaludéens de synthèse et, chez la femme jeune, de l’absence de désir de grossesse, sinon lui prescrire une contraception efficace.
Dans la maladie de Still de l’adulte, le méthotrexate vient après échec des salicylés et en cas de dépendance marquée aux corticoïdes. Dans cette situation, certaines équipes préconisent plutôt une biothérapie de type anakinra (Kineret).
Dans les sclérodermies systémiques, les experts s’accordent à placer le méthotrexate en première ligne en cas d’atteinte cutanée extensive.
Dans l’artérite à cellules géantes (maladie de Horton) et la pseudopolyarthrite rhizomélique, le méthotrexate est ajouté en cas de trop forte dépendance aux corticoïdes et/ou d’effets indésirables inacceptables. La dose usuelle proposée est de 15 mg/semaine et ne doit pas dépasser 20 mg/semaine, compte tenu de l’âge des patients. Le tocilizumab, qui a obtenu récemment l’AMM pour le traitement de l’artérite à cellules géantes dans certaines situations, notamment de dépendance prolongée à une dose de prednisone supérieure ou égale à 7,5 mg/j, peut lui être préféré, malgré l’absence d’étude comparant les deux molécules face à face et de recul suffisant sur son utilisation.
Dans les uvéites postérieures chroniques, une dose de 25 mg/semaine s’avère un peu plus efficace que le mycophénolate mofétil à dose forte (3 g/j).
Dans la polyarthrite rhumatoïde, le méthotrexate est l’option recommandée en 1re ligne. En cas de réponse inadéquate sans problème d’intolérance, il peut être remplacé par le léflunomide ou la salazopyrine, en l’absence de facteur de mauvais pronostic ; en leur présence, on préfère introduire un anti-tumor necrosis factor alpha (anti-TNF).
Dans le psoriasis étendu résistant aux thérapeutiques classiques, la dose préconisée varie de 7,5 à 30 mg/semaine, le principe étant de chercher la dose minimale efficace.
Dans la maladie de Crohn évolutive, le méthotrexate est plus utile en traitement d’attaque qu’en entretien ; une rémission complète est obtenue dans 40 % des cas par une monothérapie parentérale (de 15 à 25 mg/semaine).
Le méthotrexate s’avère souvent efficace dans le traitement du lupus avec atteinte articulaire et/ou cutanée réfractaire aux antipaludéens de synthèse combinés à une corticothérapie orale (atteinte articulaire) ou topique (atteinte cutanée). Avant d’y recourir, il faut s’assurer de la bonne observance aux antipaludéens de synthèse et, chez la femme jeune, de l’absence de désir de grossesse, sinon lui prescrire une contraception efficace.
Dans la maladie de Still de l’adulte, le méthotrexate vient après échec des salicylés et en cas de dépendance marquée aux corticoïdes. Dans cette situation, certaines équipes préconisent plutôt une biothérapie de type anakinra (Kineret).
Dans les sclérodermies systémiques, les experts s’accordent à placer le méthotrexate en première ligne en cas d’atteinte cutanée extensive.
Dans l’artérite à cellules géantes (maladie de Horton) et la pseudopolyarthrite rhizomélique, le méthotrexate est ajouté en cas de trop forte dépendance aux corticoïdes et/ou d’effets indésirables inacceptables. La dose usuelle proposée est de 15 mg/semaine et ne doit pas dépasser 20 mg/semaine, compte tenu de l’âge des patients. Le tocilizumab, qui a obtenu récemment l’AMM pour le traitement de l’artérite à cellules géantes dans certaines situations, notamment de dépendance prolongée à une dose de prednisone supérieure ou égale à 7,5 mg/j, peut lui être préféré, malgré l’absence d’étude comparant les deux molécules face à face et de recul suffisant sur son utilisation.
Dans les uvéites postérieures chroniques, une dose de 25 mg/semaine s’avère un peu plus efficace que le mycophénolate mofétil à dose forte (3 g/j).
Surveillance du traitement
Dans les maladies chroniques, la prescription de méthotrexate est prolongée, habituellement au-delà d’un an, ce qui nécessite une surveillance clinique et biologique régulière pour s’assurer de sa bonne tolérance. Il est tout aussi essentiel de vérifier la qualité de rédaction de l’ordonnance et sa compréhension par le patient et/ou son infirmier(e). En effet, les cas d’accidents les plus graves non liés à une interférence thérapeutique majeure proviennent principalement d’une erreur de prise, la plus fréquente étant la prise quotidienne (au lieu d’hebdomadaire) du méthotrexate.
Quelle que soit la voie d’administration, orale ou sous-cutanée, la surveillance biologique doit comporter un contrôle des transaminases, de l’hémogramme et de la créatinine. Bien que la fréquence avec laquelle cette surveillance doit être réalisée n’ait fait l’objet d’aucun consensus, une surveillance bimensuelle, puis mensuelle durant les 3 premiers mois, puis toutes 6 à 12 semaines, a été suggérée pour la polyarthrite rhumatoïde. La fréquence des contrôles biologiques doit tenir compte des modifications thérapeutiques, en particulier une augmentation de posologie du méthotrexate ou l’introduction d’un traitement influençant la filtration glomérulaire ou la liaison à l’albumine, situations qui doivent conduire à un contrôle plus fréquent du bilan biologique. À l’inverse, la stabilité du traitement et de sa tolérance permet d’espacer ces contrôles à 8, voire 12 semaines.
Quelle que soit la voie d’administration, orale ou sous-cutanée, la surveillance biologique doit comporter un contrôle des transaminases, de l’hémogramme et de la créatinine. Bien que la fréquence avec laquelle cette surveillance doit être réalisée n’ait fait l’objet d’aucun consensus, une surveillance bimensuelle, puis mensuelle durant les 3 premiers mois, puis toutes 6 à 12 semaines, a été suggérée pour la polyarthrite rhumatoïde. La fréquence des contrôles biologiques doit tenir compte des modifications thérapeutiques, en particulier une augmentation de posologie du méthotrexate ou l’introduction d’un traitement influençant la filtration glomérulaire ou la liaison à l’albumine, situations qui doivent conduire à un contrôle plus fréquent du bilan biologique. À l’inverse, la stabilité du traitement et de sa tolérance permet d’espacer ces contrôles à 8, voire 12 semaines.
Surveillance hépatique
Sous méthotrexate, l’augmentation des transaminases est fréquente et le plus souvent transitoire. Cependant, une surveillance régulière des enzymes hépatiques (alanine et aspartate amino-transférases [ALAT et ASAT]) est indispensable et permet d’adapter la posologie.
Pour une élévation des ASAT et/ou ALAT entre 1,5 et 3 fois la limite supérieure de la normale, la poursuite du méthotrexate est autorisée, avec réduction posologique et poursuite d’une surveillance mensuelle. La normalisation du bilan peut amener à proposer un retour à la posologie initiale.
Si les transaminases restent supérieures à 3 fois la limite supérieure de la normale, le méthotrexate doit être interrompu et la surveillance rapprochée à une fois toutes les 2 semaines. Le méthotrexate pourra être repris à demi-dose après retour des transaminases en dessous de 3 fois la limite supérieure de la normale.
Si les transaminases persistent au-dessus de 3 fois la limite supérieure de la normale après arrêt du méthotrexate, l’arrêt est définitif. Un avis spécialisé et des explorations complémentaires sont nécessaires.
Pour une élévation des ASAT et/ou ALAT entre 1,5 et 3 fois la limite supérieure de la normale, la poursuite du méthotrexate est autorisée, avec réduction posologique et poursuite d’une surveillance mensuelle. La normalisation du bilan peut amener à proposer un retour à la posologie initiale.
Si les transaminases restent supérieures à 3 fois la limite supérieure de la normale, le méthotrexate doit être interrompu et la surveillance rapprochée à une fois toutes les 2 semaines. Le méthotrexate pourra être repris à demi-dose après retour des transaminases en dessous de 3 fois la limite supérieure de la normale.
Si les transaminases persistent au-dessus de 3 fois la limite supérieure de la normale après arrêt du méthotrexate, l’arrêt est définitif. Un avis spécialisé et des explorations complémentaires sont nécessaires.
Surveillance hématologique
La toxicité hématologique du méthotrexate est peu fréquente, de l’ordre de 5 % en monothérapie pour le traitement de fond des polyarthrites rhumatoïdes. La pancytopénie est rare (1 %), mais parfois très grave. Elle peut survenir tardivement, ce qui justifie le maintien au long cours d’une surveillance régulière de l’hémogramme, mensuelle au début, plus espacée par la suite. Quelques points essentiels sont à retenir :
– l’anémie macrocytaire est rare, contrairement à une macrocytose isolée, inconstante mais habituelle et anodine. Si l’anémie est isolée, il faut rechercher en priorité une carence vitaminique (folates, B12) ;
– la survenue d’une leucopénie inférieure à 3 000/mm3, d’une neutropénie inférieure à 1 500/mm3, ou d’une thrombopénie inférieure à 100 000/mm3 doit faire suspendre le traitement et renforcer la surveillance ;
– l’agranulocytose (polynucléaires neutrophiles < 500/mm3) fébrile, isolée ou intégrée à une pancytopénie, impose une hospitalisation immédiate ;
– après normalisation de l’hémogramme, le méthotrexate peut être repris à demi-dose, puis à pleine dose, avec une surveillance rapprochée ;
– devant toute cytopénie persistante, une enquête doit être menée. Il faut s’assurer qu’il n’y a pas eu : d’erreur de dose ou de prise ; d’absence de supplémentation en folates ; d’introduction d’un nouveau traitement ayant une interaction connue avec le méthotrexate, en particulier Bactrim, pénicilline et anti-inflammatoires non stéroïdiens (AINS) ; de dégradation récente de la fonction rénale ;
– si les anomalies hématologiques persistent après arrêt du méthotrexate, un avis spécialisé doit être pris, pour écarter d’autres causes (médicamenteuse, virale, syndrome d’activation macrophagique).
– l’anémie macrocytaire est rare, contrairement à une macrocytose isolée, inconstante mais habituelle et anodine. Si l’anémie est isolée, il faut rechercher en priorité une carence vitaminique (folates, B12) ;
– la survenue d’une leucopénie inférieure à 3 000/mm3, d’une neutropénie inférieure à 1 500/mm3, ou d’une thrombopénie inférieure à 100 000/mm3 doit faire suspendre le traitement et renforcer la surveillance ;
– l’agranulocytose (polynucléaires neutrophiles < 500/mm3) fébrile, isolée ou intégrée à une pancytopénie, impose une hospitalisation immédiate ;
– après normalisation de l’hémogramme, le méthotrexate peut être repris à demi-dose, puis à pleine dose, avec une surveillance rapprochée ;
– devant toute cytopénie persistante, une enquête doit être menée. Il faut s’assurer qu’il n’y a pas eu : d’erreur de dose ou de prise ; d’absence de supplémentation en folates ; d’introduction d’un nouveau traitement ayant une interaction connue avec le méthotrexate, en particulier Bactrim, pénicilline et anti-inflammatoires non stéroïdiens (AINS) ; de dégradation récente de la fonction rénale ;
– si les anomalies hématologiques persistent après arrêt du méthotrexate, un avis spécialisé doit être pris, pour écarter d’autres causes (médicamenteuse, virale, syndrome d’activation macrophagique).
Surveillance rénale
Le méthotrexate à faible dose est peu néphrotoxique, mais sa pharmacocinétique et sa toxicité générale sont largement influencées par les modifications du débit de filtration glomérulaire (DFG). Cela impose une surveillance systématique de l’urée et de la créatinine, même si la maladie chronique traitée ne comporte pas d’atteinte rénale. La toxicité directe se voit aux fortes doses, liée à la précipitation du méthotrexate ou du 17-OH-méthotrexate dans les tubules rénaux, surtout en cas d’alcalinisation insuffisante des urines.
Accident de surdosage grave en méthotrexate
Cette complication potentiellement fatale est beaucoup plus rare qu’aux fortes doses de méthotrexate. Ses causes principales sont l’erreur thérapeutique (prise quotidienne prolongée !), la survenue d’une insuffisance rénale aiguë, l’hypoalbuminémie sévère et l’interférence avec un médicament à haut risque. Les conséquences sont multiples, dominées par la pancytopénie et le sepsis. Le traitement repose sur l’hyperhydratation alcaline associée aux fortes doses de folinate de calcium intraveineux, à la carboxypeptidase G2 (effet antagoniste) et aux soins de support hautement spécialisés.
Autres effets indésirables
Le méthotrexate a de nombreux effets indésirables, dont la plupart sont bénins et transitoires. Cependant, en pratique rhumatologique, jusqu’à 30 % des patients arrêtent le produit pour raison d’intolérance à long terme. Le tableau 4 résume les principaux effets indésirables, classés par type, fréquence, gravité et conséquences sur la poursuite du traitement.
Le méthotrexate induit une immunosuppression d’autant plus importante que la dose hebdomadaire est élevée, qu’une corticothérapie est associée, et que le traitement est prolongé. Cela majore fortement les risques infectieux viraux, bactériens et fungiques. De ce fait, toute fièvre sérieuse sous méthotrexate est suspecte d’infection bactérienne, jusqu’à preuve du contraire. Après hémocultures, une antibiothérapie à spectre large doit être initiée sans délai, avec réévaluation à 48 heures et hospitalisation en cas de non-réponse et/ou signes de mauvaise tolérance.
Le méthotrexate induit une immunosuppression d’autant plus importante que la dose hebdomadaire est élevée, qu’une corticothérapie est associée, et que le traitement est prolongé. Cela majore fortement les risques infectieux viraux, bactériens et fungiques. De ce fait, toute fièvre sérieuse sous méthotrexate est suspecte d’infection bactérienne, jusqu’à preuve du contraire. Après hémocultures, une antibiothérapie à spectre large doit être initiée sans délai, avec réévaluation à 48 heures et hospitalisation en cas de non-réponse et/ou signes de mauvaise tolérance.
Facteurs influençant le risque de toxicité et d’interruption du méthotrexate
Un âge avancé, notamment par le biais d’une baisse du DFG. Chez les sujets âgés, l’augmentation posologique du méthotrexate doit être très progressive, sans dépasser la dose de 20 mg/semaine, et la surveillance clinique/biologique doit être très régulière.
L’obésité, le diabète et l’hépatite alcoolique ou virale augmentent le risque hépatique du méthotrexate. Chez ces patients à risque de fibrose et de cirrhose, la constatation d’anomalies répétées des tests hépatiques justifie un avis spécialisé et la réalisation d’un fibroscan (test élastométrique non invasif de détection de fibrose).
Une pathologie respiratoire préexistante, en particulier une pathologie interstitielle, constitue un facteur de risque de survenue d’une pneumonie interstitielle immuno-allergique (PIIA).
Une supplémentation régulière en folates, même faible, réduit la fréquence des événements gastro-intestinaux et hépatiques ainsi que des arrêts du méthotrexate au cours des traitements prolongés. L’apport systématique d’acide folique doit être d’au moins 5 mg/semaine (PNDS 2013) ; en pratique, 2 à 3 cp de 5 mg, le surlendemain du méthotrexate.
La posologie du méthotrexate : une dose initiale de 25 mg par semaine, une augmentation trop rapide des doses et une administration initiale par voie sous-cutanée sont des facteurs d’intolérance, notamment digestive. Les doses les plus fortes augmentent les risques hépatique et hématologique.
Les traitements associés : certaines interactions médicamenteuses peuvent augmenter la fréquence des effets indésirables. Une interaction entre méthotrexate et Bactrim est inhabituelle, aux faibles doses utilisées en prophylaxie de pneumocystose pulmonaire (800 mg 3 fois par semaine). Les AINS peuvent interagir indirectement avec le méthotrexate en altérant la fonction rénale ; leur utilisation doit rester très prudente et impose de resserrer la surveillance clinique et biologique.
L’insuffisance rénale modérée (clairance de la créatinine < 60 mL/min) augmente de façon significative le risque de toxicité hépatique et respiratoire. L’utilisation des AINS ou de toute autre prescription pouvant retentir éventuellement sur la clairance rénale peut favoriser la survenue d’une toxicité hépatique. Il est donc nécessaire de surveiller l’évolution de la créatinine même si le méthotrexate en lui-même n’a pas de toxicité rénale.
L’hypoalbuminémie augmente le risque de toxicité pulmonaire, hépatique et hématologique.
L’existence d’un espace de distribution supplémentaire (ascite, épanchement pleural) allonge de façon notable la demi-vie du méthotrexate, du fait de son entrée aisée suivie d’un relargage lent.
L’obésité, le diabète et l’hépatite alcoolique ou virale augmentent le risque hépatique du méthotrexate. Chez ces patients à risque de fibrose et de cirrhose, la constatation d’anomalies répétées des tests hépatiques justifie un avis spécialisé et la réalisation d’un fibroscan (test élastométrique non invasif de détection de fibrose).
Une pathologie respiratoire préexistante, en particulier une pathologie interstitielle, constitue un facteur de risque de survenue d’une pneumonie interstitielle immuno-allergique (PIIA).
Une supplémentation régulière en folates, même faible, réduit la fréquence des événements gastro-intestinaux et hépatiques ainsi que des arrêts du méthotrexate au cours des traitements prolongés. L’apport systématique d’acide folique doit être d’au moins 5 mg/semaine (PNDS 2013) ; en pratique, 2 à 3 cp de 5 mg, le surlendemain du méthotrexate.
La posologie du méthotrexate : une dose initiale de 25 mg par semaine, une augmentation trop rapide des doses et une administration initiale par voie sous-cutanée sont des facteurs d’intolérance, notamment digestive. Les doses les plus fortes augmentent les risques hépatique et hématologique.
Les traitements associés : certaines interactions médicamenteuses peuvent augmenter la fréquence des effets indésirables. Une interaction entre méthotrexate et Bactrim est inhabituelle, aux faibles doses utilisées en prophylaxie de pneumocystose pulmonaire (800 mg 3 fois par semaine). Les AINS peuvent interagir indirectement avec le méthotrexate en altérant la fonction rénale ; leur utilisation doit rester très prudente et impose de resserrer la surveillance clinique et biologique.
L’insuffisance rénale modérée (clairance de la créatinine < 60 mL/min) augmente de façon significative le risque de toxicité hépatique et respiratoire. L’utilisation des AINS ou de toute autre prescription pouvant retentir éventuellement sur la clairance rénale peut favoriser la survenue d’une toxicité hépatique. Il est donc nécessaire de surveiller l’évolution de la créatinine même si le méthotrexate en lui-même n’a pas de toxicité rénale.
L’hypoalbuminémie augmente le risque de toxicité pulmonaire, hépatique et hématologique.
L’existence d’un espace de distribution supplémentaire (ascite, épanchement pleural) allonge de façon notable la demi-vie du méthotrexate, du fait de son entrée aisée suivie d’un relargage lent.
Risque sur la procréation
Le méthotrexate est embryotoxique, exposant à des risques de malformations crâniofaciales et du système nerveux central (anencéphalie, hydrocéphalie), de malformations de membres, de retard de croissance intra-utérin et staturopondéral. Toute femme sous méthotrexate en âge de procréer doit avoir une contraception efficace et doit être avertie des risques du traitement. Compte tenu de la demi-vie d’élimination du médicament, une conception est possible dès l’arrêt du traitement. En cas de découverte d’une grossesse sous méthotrexate, celui-ci doit être arrêté immédiatement, et la conduite à tenir (interruption thérapeutique de grossesse) dépend de la dose et de la durée d’exposition. L’utilisation du méthotrexate à doses immunosuppressives ne diminue pas la fertilité ultérieure des patientes.
Méthotrexate et chirurgie
En cas de chirurgie orthopédique, il est n’est pas recommandé de stopper le méthotrexate en période périopératoire. Il en est de même dans les chirurgies non orthopédiques programmées à faible risque septique. En cas de chirurgie en urgence à haut risque septique, le méthotrexate doit être stoppé et ne sera repris qu’après cicatrisation complète.
Optimiser l’observance thérapeutique
L’observance est un élément important intervenant dans l’efficacité du traitement de toute pathologie chronique. Au cours de la polyarthrite rhumatoïde, elle est évaluée entre 59 et 100 %. L’évaluation précise de l’observance au méthotrexate est impossible, en l’absence de dosage du produit ou de certains métabolites d’élimination lente (polyglutamates), en pratique courante. L’absence de macrocytose n’écarte en rien une bonne observance au méthotrexate, dont l’évaluation repose essentiellement sur l’interrogatoire du patient. Toute mesure prise en amont pour améliorer la tolérance est garante d’un usage aussi observant et prolongé que nécessaire. Certaines règles hygiénodiététiques simples sont utiles pour limiter les effets secondaires buccopharyngés et digestifs, qui comptent parmi les plus fréquents (tableau 5 ).
Attention au surdosage
Le méthotrexate est largement prescrit, mais de maniement délicat. Il appartient au médecin traitant, tout autant qu’au spécialiste, avec qui une communication facilitée est capitale, de vérifier la bonne compréhension du patient vis-à-vis de son ordonnance, de son observance scrupuleuse de la prise conjointe d’acide folique, d’expliciter et de dépister les diverses formes d’intolérance et de toxicité du méthotrexate. Il lui revient en particulier de savoir reconnaître le rare mais potentiellement gravissime accident de surdosage, et d’orienter sans délai son patient vers le service d’urgences d’un grand centre hospitalier.
*Dose optimisée : 0,3 mg/kg/semaine (dose d’usage maximale).
Références
1. Lagarce L, Zenut M, Lainé-Cessac P. Pharmacologie du méthotrexate. J Gynecol Obstet Biol Reprod 2015;44:203-11.
2. Chan ESL, Cronstein BN. Mechanisms of action of methotrexate. Bull Hosp J Dis 2013;71 (suppl 1): S5-8.
3. Lebrun-Vignes B, Bachelez H, Chosidow 0. Le méthotrexate en dermatologie : pharmacologie, indications, utilisation et précautions d’emploi. Rev Med Int 1999;20 (suppl 3):384-92.
4. Kuhn A, Ruland V, Patsinakidis N, Luger TA. Use of methotrexate in patients with psoriasis. Clin Exp Rheumatol 2010;28 (5suppl 61):S138-44.
5. Daien C, Hua C, Gaujoux-Viala C, et al. Update of French society for rheumatology recommandations for managing rheumatoid arthritis. J Bone Spine 2019;86:135-50.
6. Shah R, Nwannunu CE, Limmer AL, Patel RR, Mui UN, Tyring SK. Brief update on dermatologic uses of methotrexate. Skin Therapy Lett 2019;24:5-8.
7. Sakthiswary R, Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus 2014;23:225-35.
8. Lucas CJ, Dimmit SB, Martin JH. Optimizing low-dose methotrexate for rheumatoid arthritis – A review. Br J Clin Pharmacol 2019;85:2228-34.
9. Mazaud C, Fardet L. Relative risk of and determinants for adverse events of methotrexate prescribed at low dose: a systematic review and meta-analysis of randomized placebo-controlled trials. Br J Dermatol 2017;177:978-86.
10. Kivity S, Zafrir Y, Loebvstein R, Pauzner R, Mouallem M, Mayan H. Clinical characteristics and risk factors for low dose methotrexate toxicity: a cohort of 28 patients. Autoimmun Rev 2014;13:1109-13.
11. Weber-Schoendorfer C, Chambers C, Wacker E, et al. Pregnancy outcome after methotrexate treatment for rheumatic disease prior to or during early pregnancy. Arthritis Rheum 2014;66:1101-10.
2. Chan ESL, Cronstein BN. Mechanisms of action of methotrexate. Bull Hosp J Dis 2013;71 (suppl 1): S5-8.
3. Lebrun-Vignes B, Bachelez H, Chosidow 0. Le méthotrexate en dermatologie : pharmacologie, indications, utilisation et précautions d’emploi. Rev Med Int 1999;20 (suppl 3):384-92.
4. Kuhn A, Ruland V, Patsinakidis N, Luger TA. Use of methotrexate in patients with psoriasis. Clin Exp Rheumatol 2010;28 (5suppl 61):S138-44.
5. Daien C, Hua C, Gaujoux-Viala C, et al. Update of French society for rheumatology recommandations for managing rheumatoid arthritis. J Bone Spine 2019;86:135-50.
6. Shah R, Nwannunu CE, Limmer AL, Patel RR, Mui UN, Tyring SK. Brief update on dermatologic uses of methotrexate. Skin Therapy Lett 2019;24:5-8.
7. Sakthiswary R, Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus 2014;23:225-35.
8. Lucas CJ, Dimmit SB, Martin JH. Optimizing low-dose methotrexate for rheumatoid arthritis – A review. Br J Clin Pharmacol 2019;85:2228-34.
9. Mazaud C, Fardet L. Relative risk of and determinants for adverse events of methotrexate prescribed at low dose: a systematic review and meta-analysis of randomized placebo-controlled trials. Br J Dermatol 2017;177:978-86.
10. Kivity S, Zafrir Y, Loebvstein R, Pauzner R, Mouallem M, Mayan H. Clinical characteristics and risk factors for low dose methotrexate toxicity: a cohort of 28 patients. Autoimmun Rev 2014;13:1109-13.
11. Weber-Schoendorfer C, Chambers C, Wacker E, et al. Pregnancy outcome after methotrexate treatment for rheumatic disease prior to or during early pregnancy. Arthritis Rheum 2014;66:1101-10.
Dans cet article
- Structure et mécanisme d’action
- Propriétés pharmacodynamiques
- Pharmacocinétique
- Formes disponibles, posologie, voie et rythme d’administration
- Contre-indications et indications (hors pathologies malignes)
- Surveillance du traitement
- Risque sur la procréation
- Méthotrexate et chirurgie
- Optimiser l’observance thérapeutique
- Attention au surdosage