La périménopause est une période de transition avant la ménopause pendant laquelle apparaissent des symptômes dont la prise en charge est parfois complexe. Les métrorragies, en particulier, sont un motif fréquent de consultation à cette phase ; elles peuvent avoir un retentissement sur la qualité de vie des femmes et être révélatrices d’une pathologie organique sous-jacente parfois grave (carcinome, hyperplasie atypique complexe, etc.). Il s’agit donc de systématiquement trouver la cause de ces saignements et de les prendre en charge de la façon la plus adaptée.
Une période propice aux métrorragies
La périménopause est une période de changements physiologiques : déclin de la fonction ovarienne et changements hormonaux systémiques responsables d’une irrégularité menstruelle, puis d’une aménorrhée (d’une durée minimale de 1 an pour signer la ménopause).1 La durée de la périménopause est variable, avec une médiane de quatre ans.1 L’âge moyen d’entrée dans cette période est de 47,5 ans.
Classiquement, le stade précoce de la périménopause se caractérise par des cycles courts (moins de 21 jours) plus fréquents et par une interruption occasionnelle des cycles.
Dans un second temps, l’irrégularité menstruelle s’installe, avec des périodes d’aménorrhées plus prolongées (durant plus de 60 jours).1
Tout au long de cette période, les femmes sont susceptibles de connaître une augmentation du nombre de jours de saignements : dans une étude de Paramsothy2, 77 % d’entre elles décrivent au moins trois épisodes de saignements ayant duré dix jours et plus. Une autre étude révèle que, parmi les patientes consultant pour métrorragies, plus de 70 % sont en période de périménopause ou de ménopause.3
Évaluer pour s’orienter
Interrogatoire et examen clinique
L’interrogatoire doit analyser les antécédents menstruels, l’histoire des saignements, leur fréquence et leur importance. La prise de médicaments, l’oubli de contraception, la consommation de tabac, les antécédents personnels et familiaux (notamment de cancers gynécologiques), les antécédents de dysfonction endocrinienne et de troubles de la coagulation doivent également être recherchés.
Cliniquement, il faut associer à l’examen général un calcul de l’indice de masse corporelle, un examen gynécologique vulvaire et au spéculum (pour exclure une origine vaginale ou cervicale des saignements). Le toucher vaginal, éventuellement bimanuel, permet de rechercher une masse ou une adhérence.4
Bilan complémentaire
Le bilan sanguin est ajusté en fonction des données de l’interrogatoire et de l’examen clinique : hémogramme, bilan martial, bilan de coagulation, dosage quantitatif des bêta-hCG plasmatiques, recherche d’une dysfonction thyroïdienne, etc.
L’échographie pelvienne sus-pubienne et endovaginale est l’imagerie de choix en première intention.5 Elle doit être réalisée de préférence immédiatement à la fin de la période des saignements, lorsque l’endomètre est le plus fin.
Une hystéroscopie avec biopsies endométriales est recommandée en cas de facteurs de risque de cancer de l’endomètre (surpoids, obésité, diabète, antécédents familiaux de cancers gynécologiques, syndrome de Lynch, longue durée d’exposition aux œstrogènes), d’anomalies à l’examen clinique ou à l’échographie, de saignements persistants. Elle permet d’éliminer une pathologie intracavitaire.
Identifier une cause
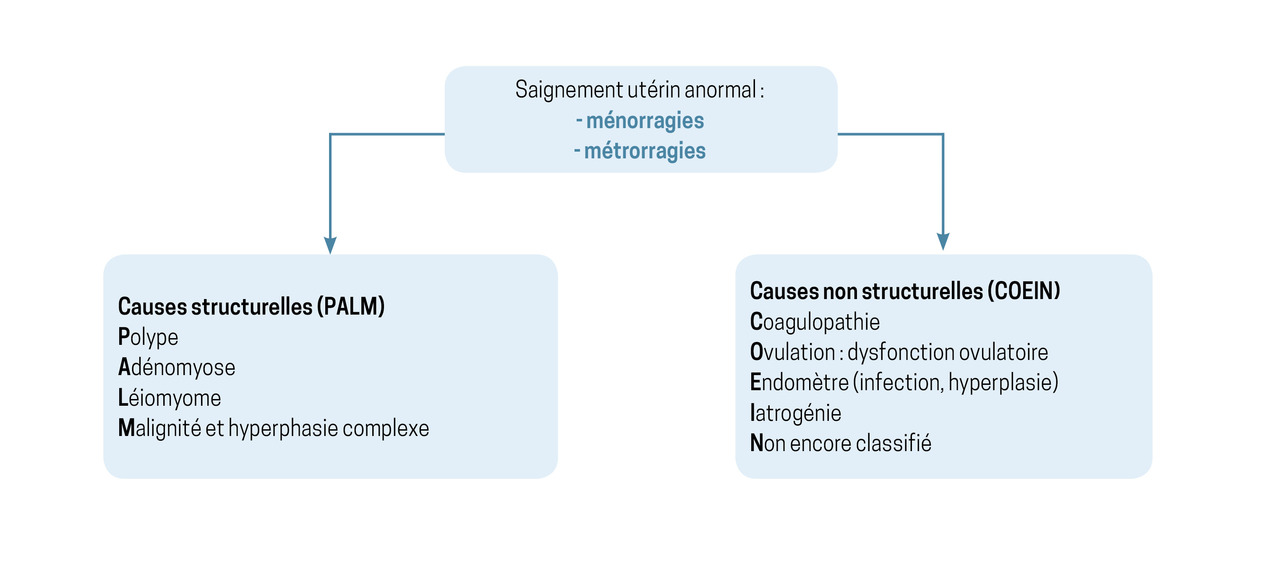
Les causes de saignements utérins anormaux peuvent être classées en deux grandes catégories : structurelles ou non structurelles (classification FIGO 2011,
Les métrorragies fonctionnelles par anovulation sont les plus fréquentes : elles représentent près de 80 % des causes de métrorragies en périménopause.6
Les causes iatrogènes doivent toujours être recherchées : traitement contenant des œstrogènes et/ou progestatifs, agonistes de la gonadolibérine (GnRH), inhibiteurs de l’aromatase, traitement modulateur sélectif des récepteurs aux œstrogènes (SERM) et plus rarement modulateur sélectif des récepteurs de la progestérone (SPRM) par action directe sur l’endomètre, utilisation d’un dispositif intra-utérin (DIU), anticoagulants et antiagrégants plaquettaires surdosés, etc.
Prise en charge des métrorragies de causes structurelles
Polypes endométriaux
Les polypes endométriaux sont des protrusions nodulaires à la surface de l’endomètre constituées de glandes endométriales et de stroma. Dans la majorité des cas, ces polypes sont bénins. Le risque de malignité est de l’ordre de 0,5 % en population générale.7 Les polypes endométriaux sont fréquents, surtout en période de périménopause : ils concernent environ 20 % des femmes de plus de 35 ans et 40 % des femmes de plus de 50 ans. Ils peuvent être révélés par des métrorragies. L’échographie-doppler sus-pubienne et endovaginale est l’examen diagnostique de première intention. Une exploration hystéroscopique avec biopsies dirigées est ensuite recommandée afin d’en préciser l’aspect lésionnel, la taille, le nombre, la topographie, la vascularisation et l’aspect de l’endomètre adjacent. La résection hystéroscopique est le traitement de référence. L’analyse histologique permet d’éliminer une tumeur maligne.
Adénomyose
L’adénomyose se caractérise par le développement d’une muqueuse endométriale normale dans le myomètre. Elle est souvent associée à des saignements, une dysménorrhée, voire des dyspareunies. Une prise en charge médicamenteuse peut être proposée en première intention et lorsqu’il existe un désir de maintien de la fertilité. Les traitements utilisés sont alors ceux des métrorragies fonctionnelles (
Léiomyome (ou fibrome utérin)
Le léiomyome est la cause des métrorragies pour 25 % des femmes en âge de procréer. Le choix du traitement dépend de la symptomatologie et de la topographie des fibromes, ainsi que du choix de la patiente.
Un traitement médical peut être initialement proposé.
L’acide tranexamique, bien qu’il n’ait pas montré son efficacité, est souvent utilisé en traitement symptomatique dans le cadre des fibromes de petite taille.8
Le DIU au lévonorgestrel a montré son efficacité en termes de diminution de l’incidence des saignements. Cependant, le taux d’expulsion dans les trois ans est plus élevé en présence de fibrome (15,8 versus 9,6 %).8
Les agonistes de la GnRH sont utilisés avant intervention chirurgicale. Ils entraînent une aménorrhée et une diminution de la taille des fibromes. Leur utilisation à long terme est controversée du fait du risque de déminéralisation osseuse et de symptômes vasomoteurs.
L’ acétate d’ulipristal (UPA), modulateur sélectif des récepteurs aux œstrogènes, était autrefois utilisé dans la prise en charge préchirurgicale des fibromes. Sa prescription n’est plus recommandée actuellement, du fait de son hépatotoxicité.9
Enfin, aucune étude ne permet de conclure à l’intérêt des anti-inflammatoires non stéroïdiens dans le traitement des fibromes.
Le traitement chirurgical par myomectomie et hystérectomie est le traitement de référence.
La radiologie interventionnelle avec embolisation des artères utérines peut être une alternative efficace et sûre, selon la Cochrane.6
Hyperplasie endométriale et cancer de l’endomètre
En France, le cancer de l’endomètre est le 4e plus fréquent des cancers de la femme. En 2019, on notait 8 220 nouveaux cas confirmés. Il survient le plus souvent après la ménopause. Chez des patientes porteuses du syndrome HNPCC (hereditary non-polyposis colorectal cancer), il peut cependant apparaître plus tôt (âge moyen au diagnostic : 46-48 ans), avec un risque plus élevé (correspondant à 4 à 11 % des patientes).
Quatre types histologiques principaux sont décrits : adénocarcinome endométrioïde, adénocarcinome mucineux, adénocarcinome séreux, carcinome à cellules claires.7
Le traitement du cancer de l’endomètre varie en fonction de son stade. Le bilan préopératoire doit donc être rigoureux afin de déterminer quel type de chirurgie est le plus adapté, en fonction de la classification des lésions. L’étude anatomopathologique finale oriente ensuite les modalités du traitement adjuvant : surveillance simple, radiothérapie, curiethérapie ou chimiothérapie.7
Prise en charge des métrorragies d’origine fonctionnelle
Le diagnostic de métrorragies fonctionnelles par anovulation (80 % des métrorragies de la périménopause) n’est posé qu’après avoir éliminé toutes les autres causes possibles.
Traitement médical
Un traitement hormonal peut être utilisé pour amender les saignements.
Les contraceptifs œstroprogestatifs (contraception orale combinée, patch, anneau) ne sont à envisager qu’après avoir considéré le risque cardiovasculaire de la patiente.8 Un faible dosage en éthinylestradiol est recommandé en première intention.
Une contraception hormonale progestative (contraception orale, implant sous-cutané, DIU hormonal) peut être également indiquée. Le DIU hormonal offre l’avantage d’entraîner presque toujours une aménorrhée, souvent recherchée en cas de métrorragies fonctionnelles (le DIU au lévonorgestrel entraîne une aménorrhée dans 20 à 80 % des cas).10 L’utilisation de progestatifs de longue durée d’action en implant sous-cutané provoque également une aménorrhée (obtenue en 12 mois dans 30 à 40 % des cas).
L’acétate de médroxyprogestérone injectable permet une aménorrhée dans 90 % des cas, mais les antécédents thromboemboliques veineux ou artériels en contre-indiquent l’utilisation.
Certaines études montrent que l’acide tranexamique peut permettre, de manière ponctuelle, de diminuer la quantité des saignements.7 Cependant, il est également contre-indiqué en cas de risque thromboembolique.
Traitement chirurgical
La résection endométriale est une alternative peu invasive au traitement des métrorragies fonctionnelles de la périménopause. Elle est généralement réservée aux patientes réfractaires au traitement médical qui n’ont pas de désir de fertilité future mais ne souhaitent pas de traitement radical par hystérectomie. Bien que moins invasive que l’hystérectomie, elle expose à un risque (faible) d’effets secondaires (hémorragie, perforation, infection). Dans 38 % des cas, une seconde intervention est nécessaire dans les quatre ans.7
1. Delamater L, Santoro N. Management of the Perimenopause. Clin Obstet Gynecol 2018;61(3):419-32.
2. Paramsothy P, Harlow SD, Greendale GA, et al. Bleeding patterns during the menopausal transition in the multi-ethnic Study of Women’s Health Across the Nation (SWAN): a prospective cohortstudy. BJOG 2014;121(12):1564-73.
3. Goldstein SR, Lumsden MA. Abnormal uterine bleeding in perimenopause. Climacteric 2017;20(5):414-20.
4. Lethaby A, Farquhar C, Cooke I. Antifibrinolytics for heavy menstrual bleeding. Cochrane Database Syst Rev 2000;(4):CD000249.
5. Lethaby A, Shepperd S, Cooke I, et al. Endometrial resection and ablation versus hysterectomy for heavy menstrual bleeding. Cochrane Database Syst Rev 2000;(2):CD000329.
6. Hale GE, Robertson DM, Burger HG. The perimenopausal woman: endocrinology and management. J Steroid Biochem Mol Biol 2014;142:121-31.
7. Sharma J, Tiwari S. Hysteroscopy in Abnormal Uterine Bleeding vs Ultrasonography and Histopathology Report in Perimenopausal and Postmenopausal Women. J Nepal Med Assoc 2016;55(203):26-8.
8. Querleu D, Darai E, Lecuru F, et al. Prise en charge primaire des cancers de l’endomètre : recommandations SFOG-CNGOF. Gynécologie Obstétrique Fertilité & Sénologie 2017;45(12):715-25.
9. Long ME, Faubion SS, MacLaughlin KL, et al. Contraception and hormonal management in the perimenopause. J Womens Health (Larchmt) 2015;24(1):3-10.
10. Plu-Bureau G, Sabbagh E, Hugon-Rodin J. Contraception hormonale et risque vasculaire. RPC Contraception CNGOF. Gynécologie Obstétrique Fertilité & Sénologie 2018;46(12):823-33.