Le microbiote cutané, qui est stable au cours du temps, interagit physiologiquement et favorablement avec le système immunitaire de l’hôte. Son altération, chez des sujets génétiquement prédisposés, pourrait être à l’origine des maladies inflammatoires cutanées.
D’une surface d’environ 2 m2, la peau est une interface majeure entre l’homme et son environnement. Le microbiote cutané est constitué par l’ensemble des micro-organismes vivant sur la peau et au sein des annexes cutanées : principalement des bactéries (plus de 1 000 espèces différentes) mais aussi des archéobactéries, des levures, des champignons et des acariens. L’épiderme constitue la barrière protectrice des structures sous-jacentes : le derme et l’hypoderme. Sa structure particulière et ses capacités de régénération lui confèrent une capacité exceptionnelle de protection vis-à-vis des agressions quotidiennes que subit la peau, traumatiques, chimiques et infectieuses. La couche cornée constitue un milieu hostile à la colonisation par de nombreux micro-organismes. Les kératinocytes produisent des peptides antimicrobiens, et la desquamation limite la densité microbienne. Les glandes eccrines, ou sudoripares, produisent des électrolytes et maintiennent des conditions physico- chimiques acide et salée. Les glan- des sébacées appendues aux follicules pileux produisent des lipides qui lubrifient l’épiderme et ont une activité antibactérienne et fongicide. D’une manière générale, les conditions environnementales de la surface cutanée sont un pH acide (de 4 à 5), une relative sécheresse et une température située entre la température corporelle et celle de l’environnement.
Moyens d’étude
L’étude précise des microbiotes a été rendue possible grâce au développement des technologies de séquen-çage à haut débit. Le microbiote cu-tané a principalement été étudié par amplification de parties variables du gène codant l’ARN ribosomal 16S bactérien, ou par exemple de la région ITS1 pour les champignons et levures. Si cette technologie a quelques limites, comme l’impossibilité de savoir si les micro-organismes identifiés sont vivants ou morts et de ne fournir des informations qu’au niveau du genre bactérien le plus souvent, elle permet néanmoins une bonne appréciation de la composition des microbiotes. Des études de métagénomique globale ont permis d’étendre ces données aux autres composantes microbiennes du microbiote cutané.
Composition et facteurs influençant le microbiote cutané
Le microbiote cutané est acquis à la naissance et dépend donc du mode d’accouchement. Par voie basse, il s’agit de la flore vaginale, alors que par césarienne, c’est la flore cutanée maternelle. Chez l’adulte, les bacilles à Gram positif lipophiles des genres Cutibacterium et Corynebacterium prédominent, associées aux staphylocoques à coagulase négative. Le microbiote cutané varie de manière importante selon le site anatomique.2C. acnes est l’espèce prédominante dans les zones lipidiques (tête, cou et dos). Les zones sèches et exposées (faces d’extension des bras et des jambes) sont majoritairement colonisées par les staphylocoques à coagulase négative, l’espèce la plus abondante étant Staphylococcus epidermidis, et par des bacilles à Gram négatif environnementaux du phylum des Proteobacteria (
Malgré le fait que la peau soit constamment exposée à nombreux facteurs environnementaux, le microbiote cutané bactérien est globalement stable au cours du temps, sauf au niveau des zones sèches, qui sont plus exposées à l’environnement.3
Le microbiote cutané fungique est peu diversifié sauf au niveau des pieds, le genre Malassezia, un champignon lipophile, étant le plus abondant.4 On observe une variation des trois espèces prédominantes (M. restricta, M. globosa et M. sympodialis) selon le site, ce qui témoigne là encore probablement d’une adaptation aux constantes physico-chimiques des différentes aires cutanées.
Le microbiote viral est moins bien connu. Il est constitué en grande majorité par des phages bactériens. Les acariens du genre Demodex (D. folliculorum et D. brevis) font partie du microbiote du follicule pileux du visage.
Rôle du microbiote cutané dans la défense contre les agents pathogènes
Voir la
Activité propre
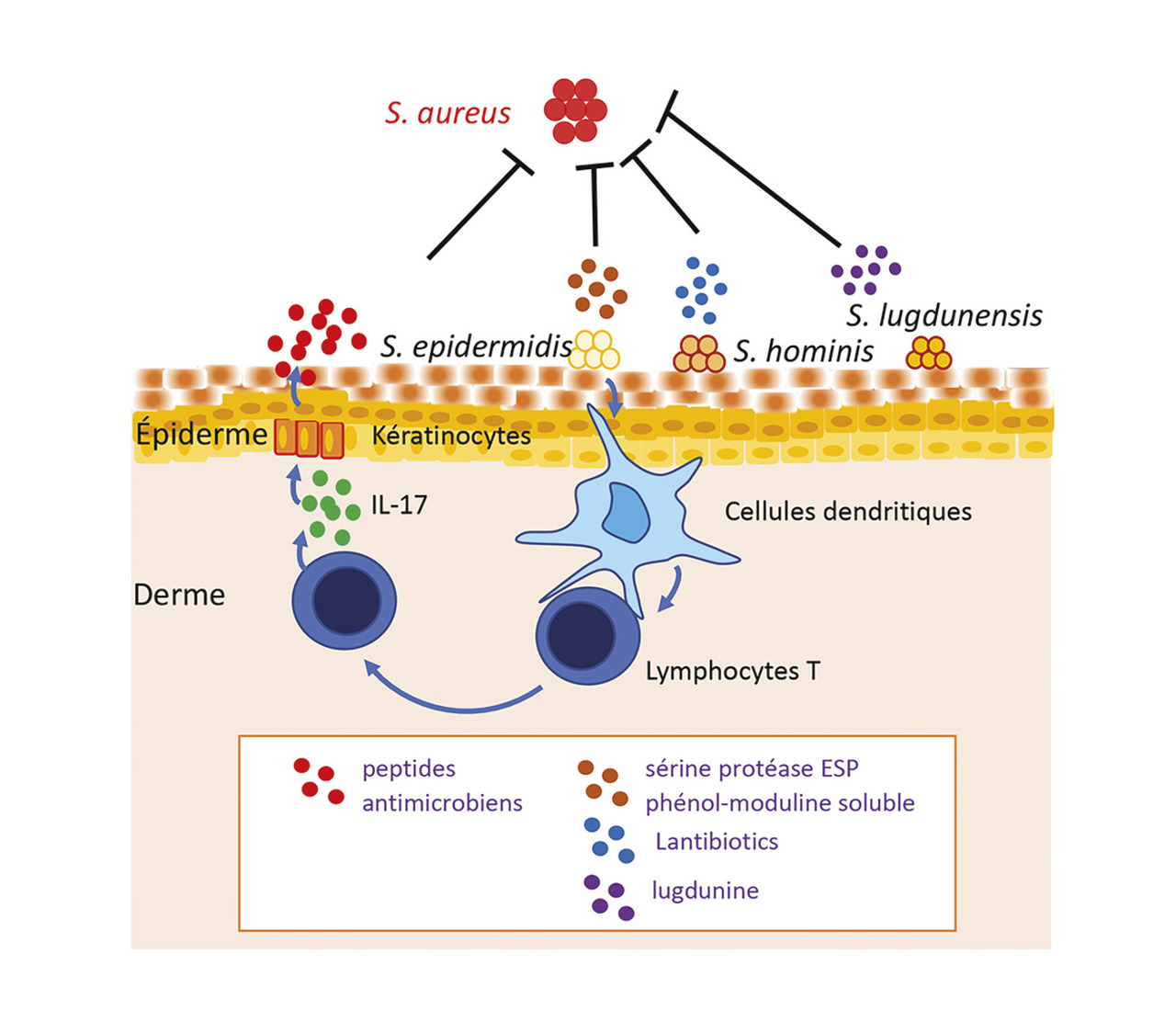
Le rôle barrière du microbiote cutané a été particulièrement étudié chez les staphylocoques à coagulase négative. Certaines souches de Staphylococcus epidermidis produisent des molécules antibiotiques dirigées notamment contre S. aureus : la sérine protéase ESP et la phénolmoduline soluble ESP. La phénolmoduline soluble cible également un autre agent pathogène majeur, le streptocoque bêta hémolytique du groupe A. D’autres molécules antibiotiques ont été identifiées chez S. hominis (producteur de Lantibiotiques) et chez S. lugdunensis (producteur de lugdunine).
Synergie avec le système immunitaire
Mais les staphylocoques à coagulase négative peuvent également interagir directement avec le système immunitaire pour activer la production de peptides antimicrobiens par les kératinocytes. L’interaction entre S. epidermidis et les cellules dendritiques dermiques aboutit à une activation lymphocytaire qui produisent de l’interleukine 17, cette dernière activant la production de peptides antimicrobiens par les kératinocytes.5 Les molécules antibiotiques produites par les staphylocoques à coagulase négative agissent de manière synergique avec les peptides antimicrobiens humains.
L’effet barrière du microbiote cutané contre les agents pathogènes résulte donc de plusieurs mécanismes synergiques : interaction bactéries-bactéries à la surface cutanée, interactions bactéries-système immunitaire et synergie des effecteurs finaux à activité antibactérienne.
Microbiote cutané et maladies inflammatoires de la peau
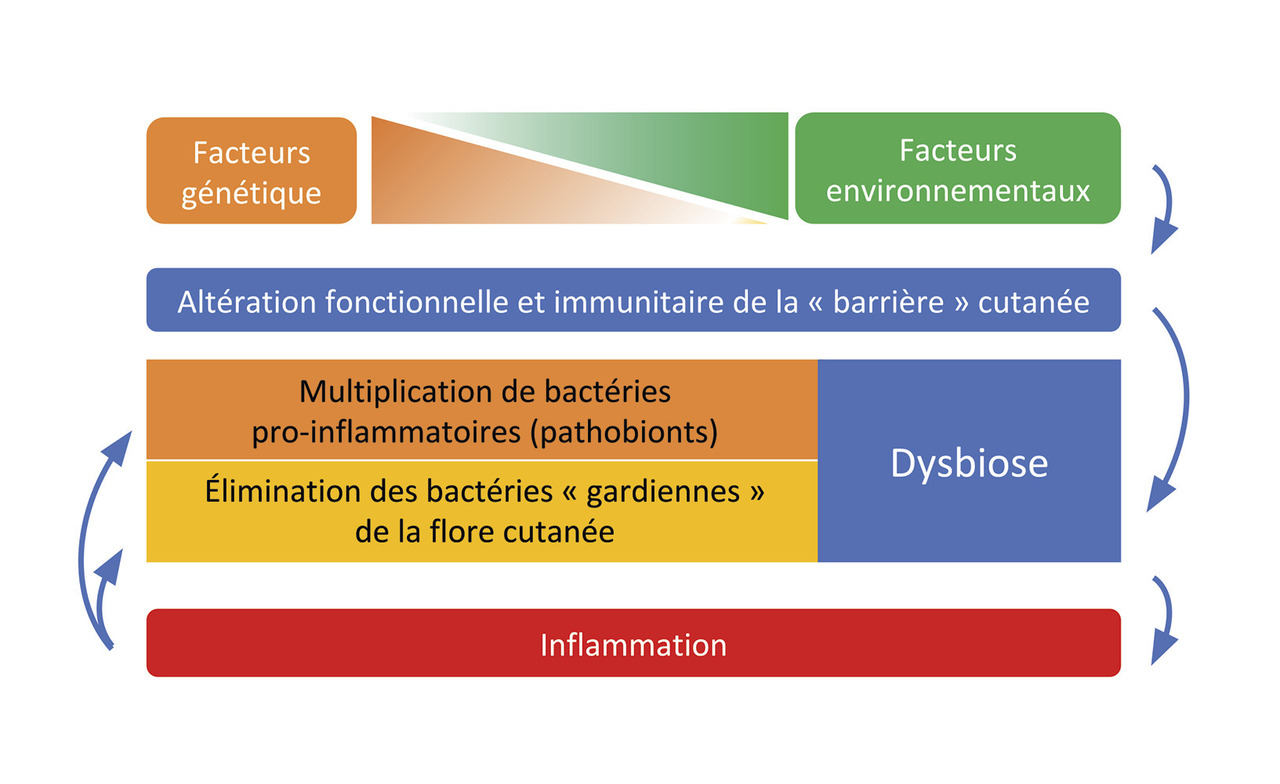
Les données ci-dessus démontrent que la composition du microbiote cutané est contrôlée par l’hôte et qu’il interagit physiologiquement avec le système immunitaire dans le cadre d’une relation mutualiste, bénéfique pour les deux partenaires.6 Les maladies inflammatoires cutanées pourraient donc résulter, chez des sujets génétiquement prédisposés, d’une altération de la composition bactérienne du microbiote cutané ou dysbiose, et/ou d’une altération qualitative du microbiote cutané (
Acné
L’acné est une maladie inflammatoire du follicule pileux qui touche principalement les adolescents et adultes jeunes. Elle associe une hyperkératinisation à une hyperséborrhée, qui aboutissent à une occlusion folliculaire et à la formation de comédons. Les lésions d’acné sont typiquement localisées au niveau des zones lipidiques du corps humain ou prédomine C. acnes. Les antibiotiques, les antiseptiques cutanées comme le peroxyde de benzoyle et les rétinoïdes ont une activité dans l’acné via une activité antibactérienne directe ou indirecte, par diminution de la production de sébum. Le microbiote des lésions d’acné n’est pas différent du microbiote de surface de zones saines. Il ne s’agit donc pas d’une dysbiose au sens strict. Cependant, il a été montré que l’acné est associé à une perte de la diversité clonale des souches de C. acnes présentes à la surface cutanée, et à une prédominance du clone pro-inflammatoire de phylotype IA1.7
Dermatite atopique
La dermatite atopique, ou eczéma, associe des anomalies structurelles de la barrière cutanée (incluant le déficit en filaggrine) et une réaction inflammatoire de type allergique. Le microbiote lésionnel des lésions de dermatite atopique est caractérisé par une perte de la diversité bactérienne avec une prédominance de Staphylococcus aureus. Cette dominance précède les poussées de la maladie et est d’autant plus importante que les lésions sont sévères. Contrairement à ce qui est observé dans l’acné, les souches de S. aureus associées à la dermatite atopique appartiennent à divers complexes clonaux, chaque patient ayant sa propre souche. Des études expérimentales chez la souris ont montré que ces souches induisent une réponse inflammatoire de type allergique,8 suggérant qu’elles participent à la physiopathologie de la maladie.
Maladie de Verneuil ou hidradénite suppurée
La maladie de Verneuil (1 % de la population générale) est une maladie inflammatoire du follicule pileux principalement localisée aux grands plis du corps (aisselles, plis inguinaux et périnéaux). Comme dans l’acné, on y retrouve un trouble de la kératinisation des annexes des follicules pileux mais aussi des anomalies de l’immunité innée. Familiale dans 30 % des cas, elle se caractérise par des nodules, abcès récidivants, la forme sévère étant caractérisée par des lésions suppurées chroniques. Elle est associée à une dysbiose qui varie selon la sévérité clinique de la maladie, avec une majorité de flores anaérobies, les germes prédominants étant des bacilles à Gram négatif (Prevotella, Porphyromonas, Fusobacterium) mais aussi des streptocoques du groupe milleri et des Actinomycetes anaérobies.9, 10 Les antibiotiques permettent d’obtenir des rémissions cliniques prolongées de la maladie, ce qui suggère que la dysbiose de l’hidradénite suppurée pourrait être un déclencheur inflammatoire de la maladie.11, 12
Nouvelles stratégies thérapeutiques ?
Le microbiote cutané joue un rôle majeur dans les défenses immunitaires de la peau et est altéré au cours des maladies cutanées inflammatoires. Des travaux sont nécessaires pour mieux comprendre le rôle de ces dysbioses. L’identification des mécanismes moléculaires impliqués devrait permettre de développer de nouvelles stratégies thérapeutiques préventives et curatives innovantes de ces maladies.
1. Byrd AL, Belkaid Y, Segre JA. The human skin microbiome. Nat Rev Microbiol 2018;16:143-55.
2. Grice EA, Kong HH, Conlan S, et al. Topographical and temporal diversity of the human skin microbiome. Science 2009;324:1190-2.
3. Oh J, Byrd AL, Park M, Program NCS, Kong HH, Segre JA. Temporal stability of the human skin microbiome. Cell 2016;165:854-66.
4. Findley K, Oh J, Yang J, et al. Topographic diversity of fungal and bacterial communities in human skin. Nature 2013;498:367-70.
5. Naik S, Bouladoux N, Linehan JL, et al. Commensal-dendritic-cell interaction specifies a unique protective skin immune signature. Nature 2015;520:104-8.
6. Belkaid Y, Tamoutounour S. The influence of skin microorganisms on cutaneous immunity. Nat Rev Immunol 2016;16:353-66.
7. Dagnelie MA, Corvec S, Saint-Jean M, Nguyen JM, Khammari A, Dreno B. Cutibacterium acnes phylotypes diversity loss: a trigger for skin inflammatory process. J Eur Acad Dermatol Venereol 2019;33:2340-8.
8. Nakatsuji T, Gallo RL. The role of the skin microbiome in atopic dermatitis. Ann Allergy Asthma Immunol 2019;122:263-9.
9. Guet-Revillet H, Jais JP, Ungeheuer MN, et al. the microbiological landscape of anaerobic infections in hidradenitis suppurativa: a prospective metagenomic study. Clin Infect Dis 2017;65:282-91.
10. Ring HC, Thorsen J, Saunte DM, et al. The follicular skin microbiome in patients with hidradenitis suppurativa and healthy controls. JAMA Dermatol 2017;153:897-905.
11. Delage M, Jais JP, Lam T, et al. Rifampin-moxifloxacin-metronidazole combination therapy for severe Hurley stage 1 hidradenitis suppurativa: prospective short-term trial and one-year follow-up in 28 consecutive patients. J Am Acad Dermatol 2020 Jan 10;S0190-9622(20)30049-9.
12. Join-Lambert O, Coignard-Biehler H, Jais JP, et al. Efficacy of ertapenem in severe hidradenitis suppurativa: a pilot study in a cohort of 30 consecutive patients. J Antimicrob Chemother 2016;71:513-20.