Le diagnostic doit être fait idéalement avant 6 mois.
Verge de petite taille, sa longueur est 2,5 déviations standard en dessous de la moyenne pour l’âge, mais sa morphologie est normale, avec un méat urétral apical. Prévalence : environ 1,5 sur 10 000 naissances. Un défaut de sécrétion ou d’action de la testostérone est souvent en cause, mais dans un tiers des cas, aucune étiologie n’est retrouvée.
Diagnostic
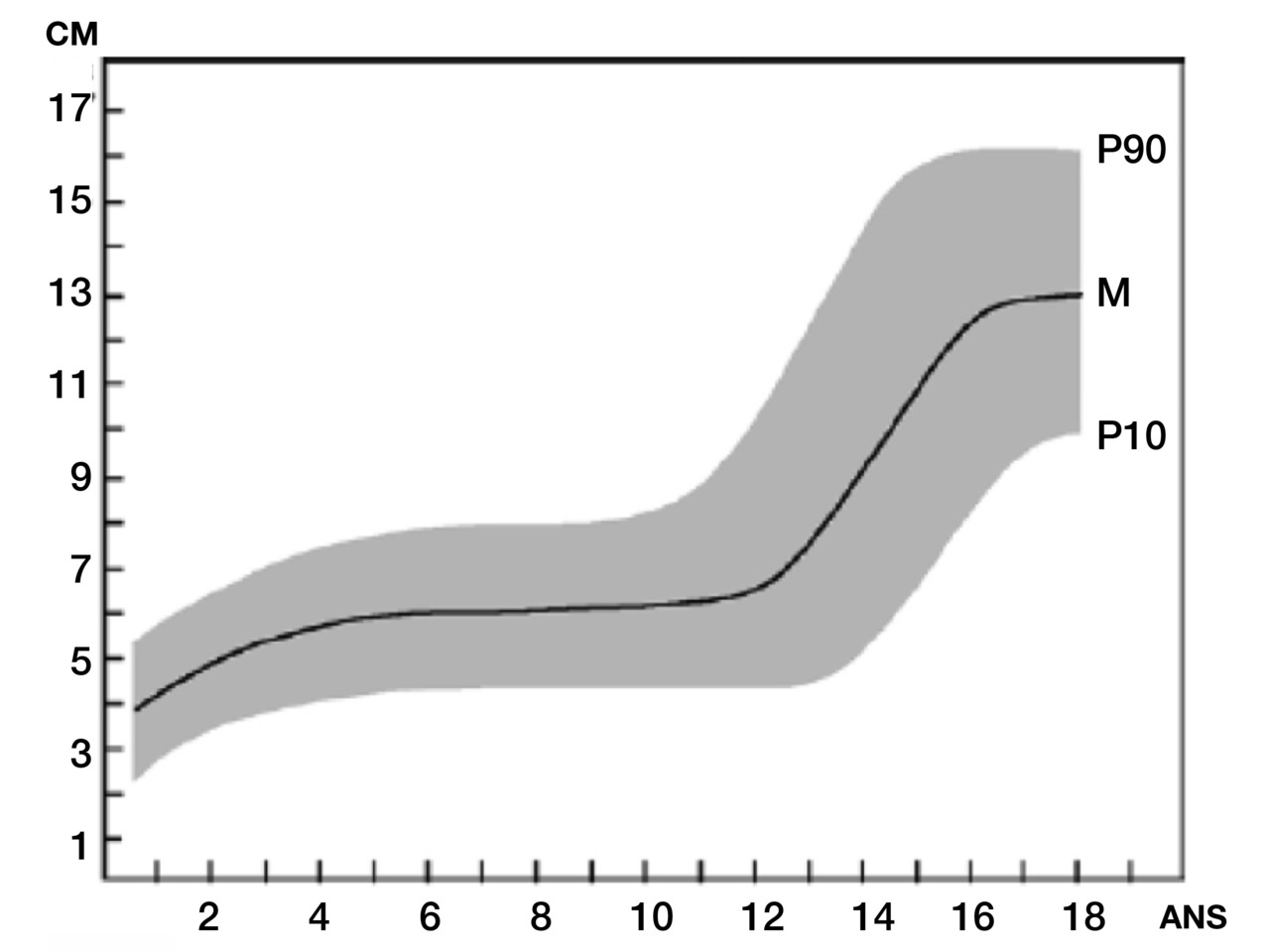
La mesure est faite sur une verge en traction légère (en prenant le gland entre le pouce et l’index et en tirant jusqu’à sentir un début de résistance), en dégageant bien les corps caverneux de la graisse sus-pubienne. Elle est réalisée sur la face dorsale du pénis, de la base à l’extrémité distale du gland dégagé, avec au mieux une règle dure (fig. 1).1 La palpation et la mesure de l’épaisseur permettent d’évaluer sa trophicité et de rechercher une hypoplasie des corps caverneux. On examine le scrotum et les testicules pour en définir la position et la taille. Le micropénis est une verge de taille < 2,5 cm à la naissance (enfant à terme), < 3-3,5 cm à 2-6 ans, < 4 cm à 6-11 ans, < 9 cm à l’âge adulte (1res normes établies par Schonfeld, et al.2 ; fig. 2). Le plus souvent, le patient a un caryotype 46 XY, avec un méat urétral apical, un scrotum normal et des testicules en place ou cryptorchides, de dimension normale ou petite.
Le diagnostic est souvent posé à tort chez les patients obèses, la verge étant enfouie dans la graisse sus-pubienne.
Physiopathologie
La formation d’une verge de morphologie et de taille normales nécessite, durant la vie embryonnaire : une synthèse suffisante de testostérone, stimulée par l’HCG placentaire puis par la LH hypophysaire fœtale ; des récepteurs aux androgènes fonctionnels ; la sécrétion de DHT via la 5-a réductase (encadré 1). L’hormone de croissance (GH) joue également un rôle en stimulant cette enzyme et les récepteurs aux androgènes.
Le micropénis est lié à une anomalie de la cascade hormonale survenant après la 12e-14e semaine de grossesse.
À la naissance, un pic de LH et de testostérone survient entre la 12e et la 36e heure de vie, puis l’axe gonadotrope se réactive à partir du 1er mois et jusqu’à 6 mois chez le garçon, période communément appelée mini-puberté, pendant laquelle les explorations sont les plus pertinentes. Il se met ensuite au repos jusqu’à l’âge pubertaire (environ 12 ans).
Étiologies (encadré 2)
Défaut de synthèse de la testostérone
Insuffisance hypophysaire (hypogonadisme hypogonadotrope). Le déficit en LH et FSH peut être isolé ou associé à une agénésie des bulbes olfactifs et à une anosmie (syndrome de Kallmann) ou combiné à d’autres anomalies (déficit hypophysaire multiple) : défaut en GH, en ACTH, qui contrôle la sécrétion de cortisol) et en TSH.
Les carences en GH et en cortisol mettent en péril le pronostic vital des nouveau-nés, par la survenue d’hypoglycémies ou de collapsus. Le diagnostic est donc une urgence.
Insuffisance testiculaire (hypogonadisme hypergonadotrope). Elle est due à une régression des 2 testicules (anorchidie, pathologie rare) ou à une dysgénésie gonadique souvent associée à une ectopie testiculaire, en lien ou non avec un syndrome (en particulier : Klinefelter 47, XXY).
Défaut d’action de la testostérone
Une insensibilité partielle aux androgènes due à une anomalie du récepteur est une cause très rare de micropénis isolé (sans hypospade) comme le déficit en 5-a réductase, responsable d’un défaut de synthèse de la DHT (peu fréquent).
Explorations
Pour être interprétables, elles doivent être faites au mieux entre les premières 12 à 36 heures de vie chez un nouveau-né, pendant la mini-puberté (entre 1 et 6 mois mais essentiellement les 3 premiers mois) et à l’âge pubertaire.
On évalue la sécrétion de testostérone et, le cas échéant, l’origine de son déficit. Les taux de FSH et de LH sont accrus en cas d’insuffisance testiculaire, normaux mais inadaptés à un taux de testostérone abaissé en cas de déficit gonadotrope (absence de réponse hypophysaire au rétrocontrôle de la testostérone). Les taux d’AMH et d’inhibine B permettent d’évaluer la fonction sertolienne du testicule (normes en fonction de l’âge).
À la puberté, la production d’AMH étant inhibée par la testostérone, le dosage de l’inhibine B est plus adéquat.
Si le micropénis est constaté à la naissance, il faut rechercher des hypogly-cémies et des anomalies de la fonction hypo- physaire (dosage de l’IGF-1 ou Insulin-like Growth Factor-1, hormones thyroïdiennes, cortisol de base ; quantification de cortisol et de GH durant les hypoglycémies). En cas d’insuffisance hypophysaire multiple, l’IRM cérébrale montre le plus souvent une malformation de la région hypothalamo-hypophysaire (hypoplasie de l’antéhypophyse ou syndrome d’interruption de tige avec une post-hypophyse ectopique).
En cas de cryptorchidie ou de testicule de petite taille (suspicion d’insuffisance testiculaire), il faut réaliser un caryotype.
Traitement
Il repose sur l’administration de testo-stérone énantate par voie injectable (Androtardyl) dans l’enfance. Les doses et pratiques diffèrent d’un centre à l’autre. On préconise 1 à 4 administrations intramusculaires à 100 mg/m2/injection tous les 15 jours. Chez le nouveau-né, elles sont faites vers 4-6 mois, après exploration de la fonction testiculaire pendant la mini-puberté. Selon la taille de la verge, évaluée 1 mois après la fin du traitement, d’autres injections peuvent être nécessaires.4
En cas de déficit gonadotrope diagnostiqué en période néonatale, certaines équipes proposent une supplémentation en LH et FSH en sous-cutané par pompe.5
En cas de résistance aux androgènes ou de déficit en 5-a réductase, l’androstanolone (dihydrotestostérone, Andractim gel) est indiqué. On applique 1 noisette sur le pénis tous les jours pendant 2 mois ; l’efficacité est évaluée 1 mois après, et une 2e cure est prescrite si le développement du pénis est jugé insuffisant (protocole non consensuel). Il faut éviter d’appliquer le gel sur la peau autour de la verge pour limiter l’apparition de pilosité pubienne.
Si un micropénis est découvert en début de puberté (augmentation du volume testiculaire de plus de 30 mm), il est possible de prescrire 2 à 3 injections d’Androtardyl à 100 mg/m2 à 15 jours d’intervalle.
L’efficacité du traitement est corrélée à l’âge : l’administration de testostérone en fin de puberté ou à l’âge adulte n’a pas d’effet.
1. Quelques rappels sur la fonction testiculaire
Le testicule est formé de cellules de Leydig synthétisant la testostérone (stimulées par la LH hypophysaire), de cellules de Sertoli sécrétant de l’AMH (hormone antimüllérienne) et de l’inhibine B (sous l’action de la FSH hypophysaire) et de cellules germinales. La testostérone exerce un rétrocontrôle négatif sur la sécrétion de LH et FSH.
Durant le développement embryonnaire, après la différenciation de la gonade en testicule, l’hormone chorionique gonadotrope (HCG) placentaire favorise la synthèse de testostérone par les cellules de Leydig dès la 8e semaine de grossesse. À partir du 2e trimestre, cette sécrétion est stimulée par la LH hypophysaire fœtale.
La testostérone induit le développement du sinus urogénital et la formation de l’urètre masculin qui s’abouche à l’extrémité distale de la verge. Cette différenciation s’achève à la 14e semaine de grossesse. Parallèlement, la dihydrotestostérone (DHT), métabolite actif de la testostérone, formée sous l’action de la 5-a réductase, entraîne la croissance de la verge et la fusion des bourrelets génitaux, formant le scrotum.
Défaut de synthèse de la testostérone
– Hypogonadisme hypogonadotrope (insuffisance hypophysaire)
• Isolé, associé ou non à une anosmie (syndrome de Kallmann)
• Associé à d’autres déficits hypophysaires
• Syndrome de Prader-Willi, de Laurence-Moon, de Bardet-Biedl
– Hypogonadisme hypergonadotrope (insuffisance testiculaire)
• Anorchidie
• Syndrome de Klinefelter et autres syndromes poly-X
• Dysgénésie gonadique (forme partielle)
• Anomalies du récepteur de la LH (forme partielle)
• Trisomie 21, syndrome de Noonan, de Bardet-Biedl, de Laurence-Moon
Défaut d’action de la testostérone
– Déficit en hormone de croissance
– Insensibilité partielle aux androgènes
– Déficit en 5-α réductase (forme partielle)
Anomalies du développement
Aphallie, exstrophie cloacale
Associé à d’autres malformations congénitales
1. Hatipoglu N, Kurtoglu S. Micropenis: etiology, diagnosis and treatment approaches. J Clin Res Pediatr Endocrinol 2013;5:217-23.
2. Schonfeld WA, Beebe GW. Normal growth and variation in the male genitalia from birth to maturity. J Urol 1942;48:759-77.
3. Bin-Abbas B, Conte FA, Grumbach MM, Kaplan SL. Congenital hypogonadotropic hypogonadism and micropenis: effect of testosterone treatment on adult penile size why sex reversal is not indicated. J Pediatr 1999;134:579-83.
4. Ishii T, Sasaki G, Hasagawa T, Sato S, Matsuo N, Ogata T. Testosterone enanthate therapy is effective and independent of SRD5A2 and AR gene polymorphisms in boys with micropenis. J Urol 2004;172:319-23.
5. Tsang S. When size matters: a clinical review of pathological micropenis. J Pediatr Health Care 2010;24:231-40.

 Encadrés
Encadrés