Clinique aspécifique, biologie peu contributive, traitement souvent probabiliste.
Mycoplasma pneumoniae (MP) est le mycoplasme dominant en pathologie humaine. Il est responsable de rhinopharyngites, trachéobronchites et d’un grand nombre de pneumonies.
Ces atteintes sont le plus souvent d’évolution favorable, mais la bactérie est aussi impliquée dans des affections extrapulmonaires plus sévères, notamment cutanées (syndrome de Stevens-Johnson), neuro-logiques (encéphalites avant tout), mais aussi hématologiques, gastro-intestinales, articulaires, cardiaques ou rénales.
Les infections à MP surviennent par épidémies. La transmission, interhumaine, se fait par gouttelettes de salive et nécessite un contact étroit et prolongé d’où une contagiosité faible. Le germe peut persister dans les voies respiratoires plusieurs semaines après l’infection. L’immunité induite est courte, les réinfections fréquentes.
L’absence de paroi bactérienne explique son insensibilité totale aux bêtalactamines. Sa résistance aux macrolides est en augmentation depuis les années 2000, avec des taux documentés chez l’enfant de l’ordre de 10 % en France et de 8 % aux États-Unis.
Dans les formes extrapulmonaires, la physiopathologie serait double : atteinte inflammatoire directe par invasion bactérienne (associée aux manifestations précoces après le début de l’infection) ; indirecte par auto-immunité (reliée plutôt aux manifestations tardives).
Ces atteintes sont le plus souvent d’évolution favorable, mais la bactérie est aussi impliquée dans des affections extrapulmonaires plus sévères, notamment cutanées (syndrome de Stevens-Johnson), neuro-logiques (encéphalites avant tout), mais aussi hématologiques, gastro-intestinales, articulaires, cardiaques ou rénales.
Les infections à MP surviennent par épidémies. La transmission, interhumaine, se fait par gouttelettes de salive et nécessite un contact étroit et prolongé d’où une contagiosité faible. Le germe peut persister dans les voies respiratoires plusieurs semaines après l’infection. L’immunité induite est courte, les réinfections fréquentes.
L’absence de paroi bactérienne explique son insensibilité totale aux bêtalactamines. Sa résistance aux macrolides est en augmentation depuis les années 2000, avec des taux documentés chez l’enfant de l’ordre de 10 % en France et de 8 % aux États-Unis.
Dans les formes extrapulmonaires, la physiopathologie serait double : atteinte inflammatoire directe par invasion bactérienne (associée aux manifestations précoces après le début de l’infection) ; indirecte par auto-immunité (reliée plutôt aux manifestations tardives).
Clinique et imagerie peu spécifiques
Pneumonie
Il est classique d’évoquer MP à partir de l’âge de 3 ans devant un début progressif et des signes infectieux modérés. Toutefois, aucun élément clinique n’est spécifique.1 En pratique, c’est souvent l’échec d’un traitement par bêtalactamines bien conduit après 48-72 heures qui fait suspecter MP.
Les images radiologiques sont également polymorphes, allant du classique syndrome interstitiel à la pneumpathie systématisée ; plus rarement, un épanchement pleural ou une cavité nécrosante.
Les images radiologiques sont également polymorphes, allant du classique syndrome interstitiel à la pneumpathie systématisée ; plus rarement, un épanchement pleural ou une cavité nécrosante.
Formes extrapulmonaires
L’association temporelle entre une éruption cutanée ou des signes neurologiques et une infection respiratoire (rhinopharyngite, bronchite, pneumonie) oriente le diag- nostic vers MP. Mais elle est inconstante (50 % des cas).
Confirmation diagnostique difficile
Les examens sérologiques à 2 semaines d’intervalle, test biologique de référence, donnent un diagnostic rétrospectif et ont ainsi peu d’intérêt face à une situation aiguë, le plus souvent peu sévère et d’évolution favorable.
La détection de l’ADN bactérien par PCRau niveau du nasopharynx dans les 7 jours qui suivent le début des signes est plus rapide. La méthode multiplex (détection simultanée de plusieurs bactéries atypiques virus respiratoires) se développe. Toutefois, une PCR positive ne permet pas de différencier un simple portage d’une infection en cours.
Pour le groupe de recherche sur les avancées en pneumopédiatrie (GRAPP), le diagnostic d’infection respiratoire basse à MP repose principalement sur l’évaluation clinique et la réponse au traitement probabiliste, les examens complémentaires n’étant habituellement pas nécessaires.2 En pratique, ceux-ci ne seraient indiqués que dans les formes respiratoires avec signes de gravité (hospitalisées) et/ou les atteintes extrapulmonaires (souvent sévères).
L’approche optimale consisterait alors à associer PCR nasopharyngée et sérologie prélevée au plus tôt 7 jours après le début des signes pour éviter les faux négatifs. Chez l’enfant, des IgM signent le plus souvent une infection aiguë et un second prélèvement n’est habituellement pas nécessaire. En l’absence d’IgM à la première sérologie, une deuxième (dosant IgM et IgG) doit être réalisée 2 à 3 semaines plus tard.2 Chez l’adulte, on observe volontiers des réinfections avec augmentation des titres IgG sans réponse IgM.
Une étude observationnelle néerlandaise a analysé les sérologies et les PCR nasopharyngées dans une population d’enfants âgés de 3 mois à 16 ans avec ou sans signes d’infection respiratoire basse.3 La PCR MP était positive chez 16,2 % des enfants symptomatiques contre 21,12 % des asymptomatiques. Dans les 2 groupes, cette positivité a persisté 1 à 3 mois au cours du suivi. Les IgM MP étaient positives chez 9,2 % des sujets symptomatiques versus 12,6 % des individus sains. Le praticien doit ainsi systématiquement moduler l’impact d’un résultat biologique positif sur sa démarche diagnostique en fonction de sa conviction clinique.
La détection de l’ADN bactérien par PCRau niveau du nasopharynx dans les 7 jours qui suivent le début des signes est plus rapide. La méthode multiplex (détection simultanée de plusieurs bactéries atypiques virus respiratoires) se développe. Toutefois, une PCR positive ne permet pas de différencier un simple portage d’une infection en cours.
Pour le groupe de recherche sur les avancées en pneumopédiatrie (GRAPP), le diagnostic d’infection respiratoire basse à MP repose principalement sur l’évaluation clinique et la réponse au traitement probabiliste, les examens complémentaires n’étant habituellement pas nécessaires.2 En pratique, ceux-ci ne seraient indiqués que dans les formes respiratoires avec signes de gravité (hospitalisées) et/ou les atteintes extrapulmonaires (souvent sévères).
L’approche optimale consisterait alors à associer PCR nasopharyngée et sérologie prélevée au plus tôt 7 jours après le début des signes pour éviter les faux négatifs. Chez l’enfant, des IgM signent le plus souvent une infection aiguë et un second prélèvement n’est habituellement pas nécessaire. En l’absence d’IgM à la première sérologie, une deuxième (dosant IgM et IgG) doit être réalisée 2 à 3 semaines plus tard.2 Chez l’adulte, on observe volontiers des réinfections avec augmentation des titres IgG sans réponse IgM.
Une étude observationnelle néerlandaise a analysé les sérologies et les PCR nasopharyngées dans une population d’enfants âgés de 3 mois à 16 ans avec ou sans signes d’infection respiratoire basse.3 La PCR MP était positive chez 16,2 % des enfants symptomatiques contre 21,12 % des asymptomatiques. Dans les 2 groupes, cette positivité a persisté 1 à 3 mois au cours du suivi. Les IgM MP étaient positives chez 9,2 % des sujets symptomatiques versus 12,6 % des individus sains. Le praticien doit ainsi systématiquement moduler l’impact d’un résultat biologique positif sur sa démarche diagnostique en fonction de sa conviction clinique.
Thérapeutique probabiliste
L’évolution des infections respiratoires à MP est le plus souvent favorable. Une revue Cochrane de 2012 conclut même à l’absence de données suffisantes pour affirmer l’efficacité des macrolides : les sujets avaient une évolution comparable, qu’ils aient ou non été traités.4 Cela questionne toutefois la validité du diagnostic d’infection à MP dans ces études (faux positifs possibles) et le moment de l’inclusion des patients par rapport au début des symptômes (évolution spontanément favorable en cas d’inclusion tardive).
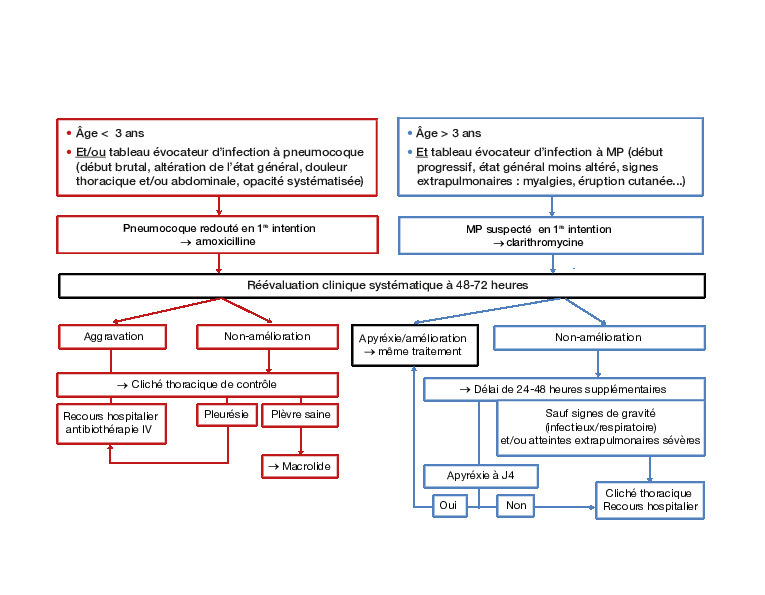
L’Afssaps a précisé en 2005 la démarche thérapeutique face à une pneumonie chez l’enfant (figure ). Avant 3 ans et/ou si le tableau évoque un pneumocoque, l’amoxicilline doit être débutée. Un échec à 48-72 heures doit faire suspecter MP, après avoir écarté une mauvaise observance et/ou une complication (nouveau cliché thoracique). En l’absence de pleurésie, on peut lui substituer un macrolide. À noter que les recommandations anglo-saxonnes ne mentionnent pas d’antibiothérapie probabiliste systématique pour une pneumonie chez l’enfant préscolaire en dehors de signes de gravité, les virus étant alors principalement en cause.
Un tableau évocateur de pneumonie atypique après 3 ans justifie la prescription d’un macrolide d’emblée, en monothérapie s’il n’y a pas de terrain à risque. Lors de la réévaluation clinique (systématique) à 48-72 heures, l’absence d’amélioration ne remet pas en cause l’hypothèse d’un mycoplasme : le délai d’apyrexie est plus long qu’avec le pneumocoque. On peut attendre à nouveau 48 heures en dehors de tout signe d’aggravation. Une étiologie virale est aussi possible.
Dans les autres cas (aspécificité clinique, aggravation), l’adjonction d’amoxicilline en bithérapie est licite après contrôle radio-logique, sous surveillance hospitalière éventuellement.
Depuis 2016, d’après le groupe de pathologie infectieuse pédiatrique (GPIP), la molécule de première intention en cas de pneumonie atypique est la clarithromycine à 15 mg/kg/j en 2 prises per os pendant 10 jours.5 En cas d’allergie : josamycine 50 mg/kg/j en 2 prises per os 14 jours, ou azithromycine (uniquement si le pneumocoque est exclu) à 20 mg/kg/j en 1 prise per os durant 3 jours, l’allergie croisée étant rare entre macrolides ; voire pristinamycine, 50 mg/kg/j en 2 prises par voie orale pendant 10 jours (après 6 ans).
Dans les infections extrapulmonaires, un macrolide est recommandé pour lutter contre l’invasion bactérienne et/ou à visée anti-inflammatoire. En cas d’atteinte neuro-logique grave (méningo-encéphalite, poly- radiculonévrite…), les fluoroquinolones (ciprofloxacine) ont une meilleure concentration dans le tissu cérébral. Il n’y a pas d’accord sur les posologies. Selon les cas, on peut ajouter une corticothérapie à forte dose, des immunoglobulines polyvalentes IV, voire des échanges plasmatiques.
L’Afssaps a précisé en 2005 la démarche thérapeutique face à une pneumonie chez l’enfant (
Un tableau évocateur de pneumonie atypique après 3 ans justifie la prescription d’un macrolide d’emblée, en monothérapie s’il n’y a pas de terrain à risque. Lors de la réévaluation clinique (systématique) à 48-72 heures, l’absence d’amélioration ne remet pas en cause l’hypothèse d’un mycoplasme : le délai d’apyrexie est plus long qu’avec le pneumocoque. On peut attendre à nouveau 48 heures en dehors de tout signe d’aggravation. Une étiologie virale est aussi possible.
Dans les autres cas (aspécificité clinique, aggravation), l’adjonction d’amoxicilline en bithérapie est licite après contrôle radio-logique, sous surveillance hospitalière éventuellement.
Depuis 2016, d’après le groupe de pathologie infectieuse pédiatrique (GPIP), la molécule de première intention en cas de pneumonie atypique est la clarithromycine à 15 mg/kg/j en 2 prises per os pendant 10 jours.5 En cas d’allergie : josamycine 50 mg/kg/j en 2 prises per os 14 jours, ou azithromycine (uniquement si le pneumocoque est exclu) à 20 mg/kg/j en 1 prise per os durant 3 jours, l’allergie croisée étant rare entre macrolides ; voire pristinamycine, 50 mg/kg/j en 2 prises par voie orale pendant 10 jours (après 6 ans).
Dans les infections extrapulmonaires, un macrolide est recommandé pour lutter contre l’invasion bactérienne et/ou à visée anti-inflammatoire. En cas d’atteinte neuro-logique grave (méningo-encéphalite, poly- radiculonévrite…), les fluoroquinolones (ciprofloxacine) ont une meilleure concentration dans le tissu cérébral. Il n’y a pas d’accord sur les posologies. Selon les cas, on peut ajouter une corticothérapie à forte dose, des immunoglobulines polyvalentes IV, voire des échanges plasmatiques.
références
1. Wang K, et al. Clinical symptoms and signs for the diagnosis of Mycoplasma pneumoniae in children and adolescents with community-acquired pneumonia (review). Cochrane Database Syst Rev 2012;10:CD009175.
2. Houdoin V, et al.; GRAPP. Recommandations sur l’utilisation des nouveaux outils diagnostiques étiologiques pour les infections respiratoires basses de l’enfant de plus de 3 mois. Arch Ped 2014;21:418-23.
3. Spuesens EB, et al. Carriage of Mycoplasma pneumoniae in the upper respiratoiry tract of symptomatic and asymptomatic children: an observational study. Plos Med 2013;10:e1001444.
4. Mulholland S, et al. Antibiotics for community-acquired lower respiratory tract infections secondary to Mycoplasma pneumoniae in children. Cochrane Database Syst Rev 2012; 9:CD004875.
5. Antibiothérapie des infections respiratoires basses. In: GPIP. Guide de prescription d’antibiotique en pédiatrie. Arch Ped 2016;23(HS3):S16-19.
2. Houdoin V, et al.; GRAPP. Recommandations sur l’utilisation des nouveaux outils diagnostiques étiologiques pour les infections respiratoires basses de l’enfant de plus de 3 mois. Arch Ped 2014;21:418-23.
3. Spuesens EB, et al. Carriage of Mycoplasma pneumoniae in the upper respiratoiry tract of symptomatic and asymptomatic children: an observational study. Plos Med 2013;10:e1001444.
4. Mulholland S, et al. Antibiotics for community-acquired lower respiratory tract infections secondary to Mycoplasma pneumoniae in children. Cochrane Database Syst Rev 2012; 9:CD004875.
5. Antibiothérapie des infections respiratoires basses. In: GPIP. Guide de prescription d’antibiotique en pédiatrie. Arch Ped 2016;23(HS3):S16-19.