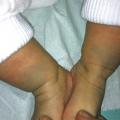
Ils sont fréquents : bien que la prévalence ne soit pas connue précisément, elle est estimée entre 1 et 3 % des nouveau-nés.1 La plupart sont de petite taille. L’incidence des NC larges ou géants est plus faible, comprise entre 1/20 000 et 1/500 000 naissances.
Il est établi que les NC sont liés à des anomalies génétiques en mosaïque non héréditaires (
Caractéristiques cliniques
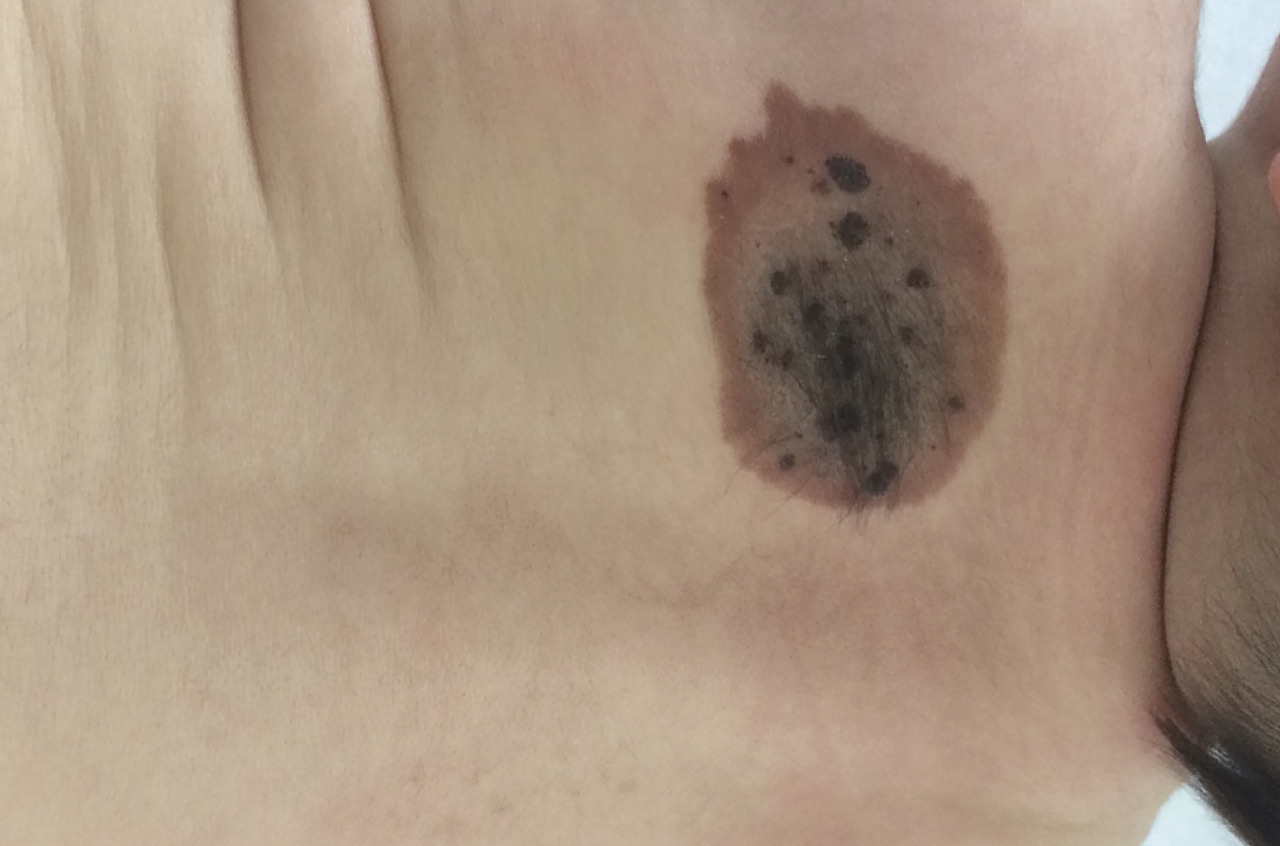
Outre l’augmentation de taille (avec la croissance), des modifications peuvent apparaître au cours du temps. La pilosité peut s’accroître (hypertrichose dans 75 % des cas, dont on peut couper les poils aux ciseaux ou à la tondeuse), ils peuvent se surélever ; leur surface devient granuleuse, verruqueuse voire cérébriforme.
De même, la coloration n’est pas définitive. D’après une étude récente, la couleur finale du nævus est corrélée au phototype de l’enfant, ce qui explique le pâlissement de certaines lésions au cours du temps (chez les enfants à phototype clair).2
D’autres signes fonctionnels sont parfois associés, surtout aux NC larges et géants, comme le prurit et, plus rarement, l’hyposudation.
Les NC peuvent siéger sur toutes les parties du corps. Ils s’accompagnent parfois de « satellites » : NC de plus petite taille répartis sur l’ensemble du tégument associés à un nævus de plus grande taille, généralement large ou géant.
La prolifération mélanocytaire est souvent profonde. Certaines caractéristiques histologiques les distinguent des nævus acquis : cellules mélano- cytaires dans les deux tiers inférieurs du derme et les tissus sous-cutanés, s’étendant entre les fibres de collagène du derme réticulaire et dans les annexes : glandes sébacées, sudorales eccrines et apocrines, follicules pileux, nerfs.
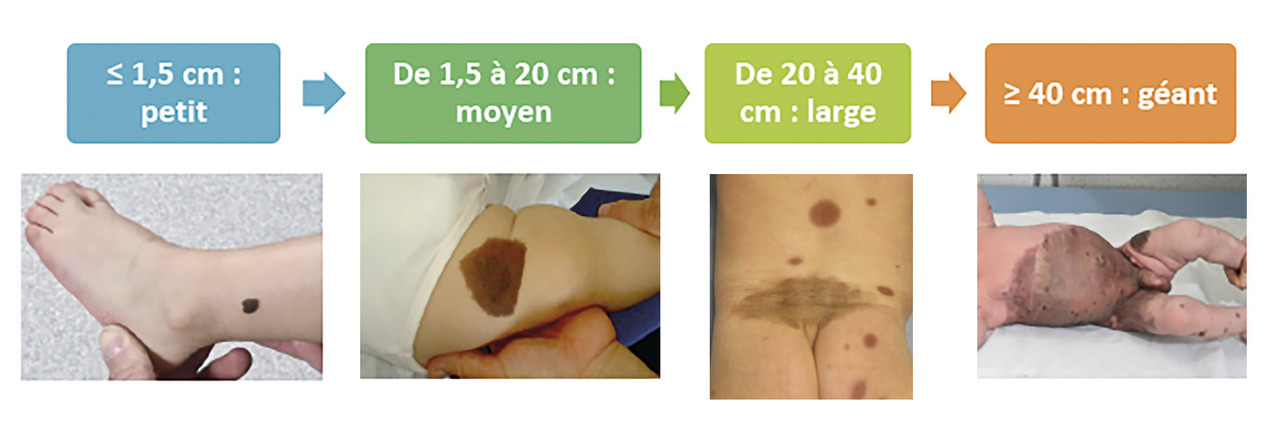
Parmi les diverses classifications, on recommande celle de Krengel,3 qui tient compte de la dimension que le nævus aura à l’âge adulte. Grâce à des abaques, on peut calculer la taille projetée adulte (TPA) attendue en fonction de l’âge de l’enfant et de la localisation.
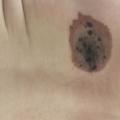
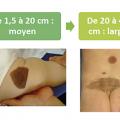
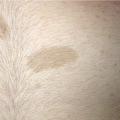
Les NC sont considérés petits lorsque leur TPA est < 1,5 cm (S), moyens si elle est comprise entre 1,5 et 20 cm (M1 1,5-10 et M2 10-20), larges entre 20 et 40 cm (L1 20-30 et L2 30-40) et enfin géants si > 40 cm (G1 40-60 et G2 > 60) [
D’autres caractéristiques cliniques interviennent dans cette classification : topographie, nombre de nævus satellites à l’âge de 1 an, degré de rugosité, hétérogénéité de couleur, hypertrichose, et présents surtout à la surface des NC larges et géants, nodules de prolifération (
Diagnostics différentiels
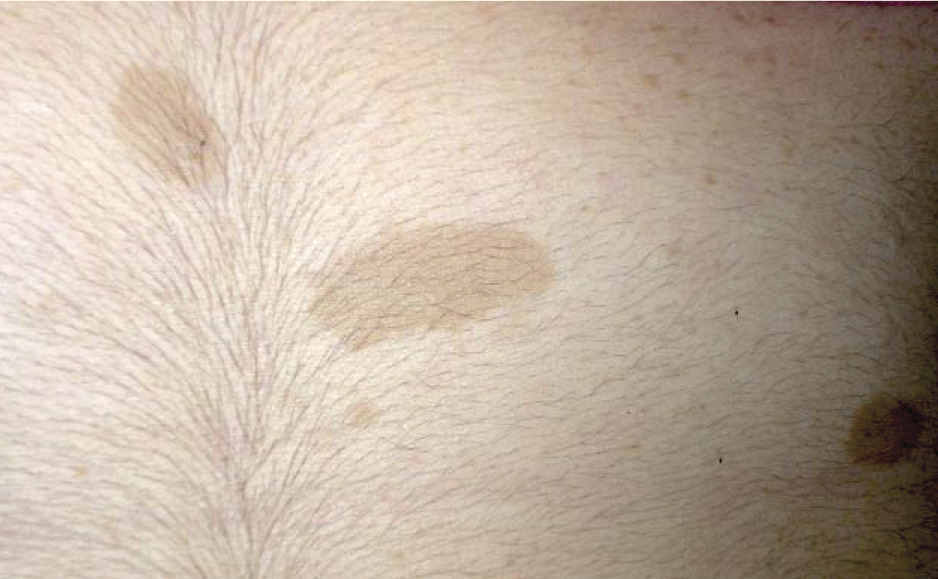
Les taches café au lait (TCL) sont des formations congénitales dues à une augmentation de l’activité de synthèse mélanique (hypermélaninose) par les mélanocytes, mais le nombre de ces derniers reste normal (
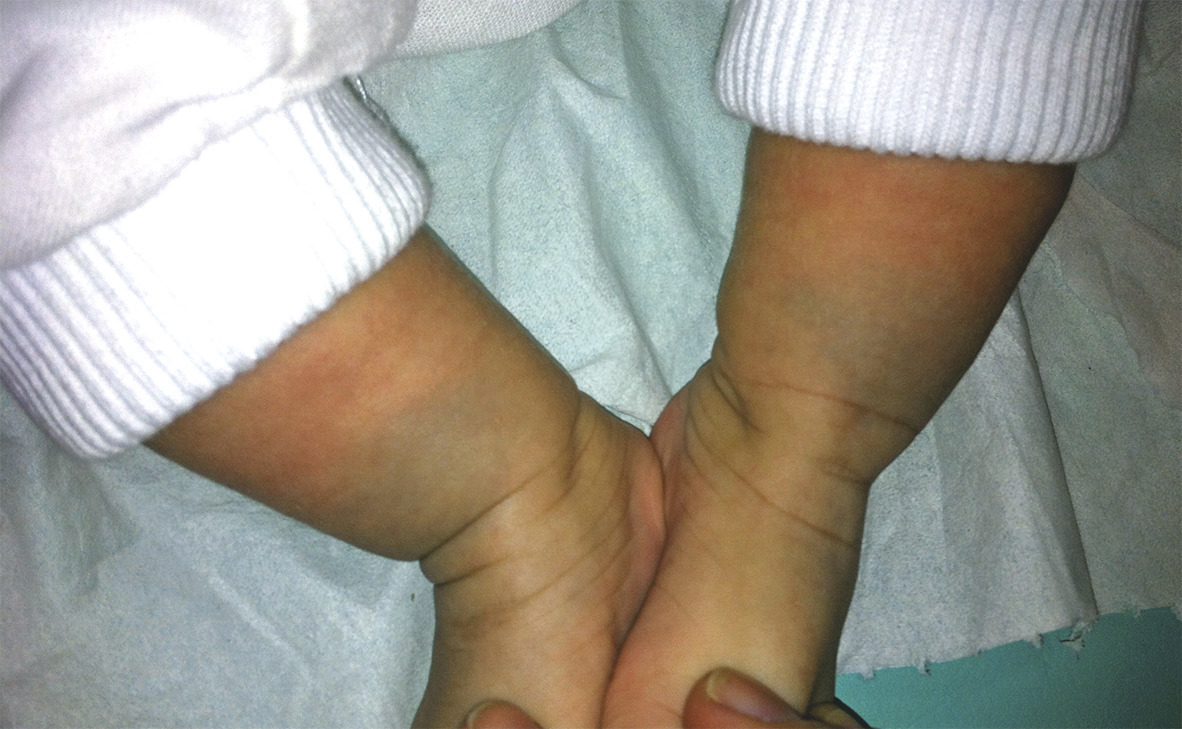
Les taches ardoisées ou mongoloïdes (
Manifestations neurologiques
La mélanose neurocutanée est caractérisée par la prolifération anormale de mélanocytes dans le système nerveux central (mélanomatose leptoméningée).
Elle peut être asymptomatique ou s’accompagner de lésions neurologiques, parfois léthales. D’autres atteintes neurologiques sont liées aux NC multiples et géants : lésions intraparenchymateuses, syringomyélie, hydrocéphalie, tumeurs (épendymome, méningiome, astrocytome, papillome du plexus choroïde) et malformations cérébrales de Dandy-Walker et Arnold-Chiari.
Le risque d’anomalie neurologique croît avec le nombre de NC et la taille du plus grand. L’évolution varie selon le type d’anomalie. La mélanose neurocutanée avec atteinte méningée est de mauvais pronostic lorsqu’elle est symptomatique (risque de mélanome à point de départ neurologique).
L’indication d’une IRM cérébrale et rachidienne n’est pas consensuelle. Certaines équipes la recommandent à partir de 2 NC.7 Comme le résultat n’a pas d’impact sur la prise en charge thérapeutique en l’absence de signe neurologique, cette attitude est discutable. D’autres équipes ne la proposent qu’en présence de symptômes neurologiques évocateurs. Dans ce cas, le taux de mortalité est élevé, en lien avec le développement d’un mélanome primitif du système nerveux central ou avec le retentissement fonctionnel de la prolifération mélanocytaire bénigne (obstacle à la circulation du LCR et hydrocéphalie ou prolifération cellulaire, épilepsie).
Risque de survenue d’un mélanome
Enfin, sur le plan moléculaire, on sait maintenant que les NC multiples (ou le syndrome du NC) sont associés à une mutation hétérozygote activatrice du gène NRAS en mosaïque, la survenue d’un mélanome requiert l’apparition d’une autre anomalie génétique au sein du mélanocyte.5
Quelle surveillance ?
En cas de NC petits et moyens, il n’y a pas de recommandation précise à l’heure actuelle.
La surveillance dans l’enfance est probablement peu utile, en raison du risque faible de mélanome. En revanche, un suivi à l’âge adulte peut être recommandé.
Impact psychosocial : important
Selon une étude incluant 29 NC larges, 25 % des patients ont des problèmes sociaux et 30 % de troubles du comportement, qui ne semblent pas liés à la visibilité de la lésion, ni à son traitement chirurgical ni à l’âge de l’enfant, reflétant plutôt un mal être général.12
Selon un autre travail, 55 % des parents éprouvent un sentiment de rejet, et 26 % n’ont pas de photos de leur enfant avant la chirurgie.13
Option thérapeutiques
La dermabrasion a montré de bons résultats dans certaines publications lorsqu’elle est réalisée très précocement. Les inconvénients sont liés aux complications de la chirurgie (douleur, infection) et à la repigmentation, fréquente.
Le laser pigmentaire (Q-Switched ou normal mode Nd-YAG) ou ablatif (CO2 fractionné) est une autre option. Principaux effets secondaires : cicatrices hypertrophiques et repigmentation. La fréquence élevée de cette dernière s’explique par la localisation en profondeur des mélanocytes dans les NC, qui ne sont pas accessibles au laser.
Actuellement, seule la chirurgie est recommandée. Les autres techniques sont très peu réalisées en pratique.
Chirurgie : quel impact ?
Concernant les NC petits et moyens, il n’y a pas de données à ce jour évaluant l’impact de la chirurgie sur le risque de dégénérescence. Ce dernier étant très faible, on suppose que l’excision complète permet de le diminuer franchement voir de l’annuler. Ici encore, il faut tenir compte de l’impact psychosocial de la lésion.
La plupart des parents (et des enfants) ayant un NC> 20 cm préfèrent une cicatrice secondaire au traitement au NC lui-même, la satisfaction étant plus importante pour la prise en charge des nævus de petite taille de la tête et du cou. L’impact psychologique de la tache serait supérieur à celui de la cicatrice.13
Les résultats sont meilleurs chez les nourrissons en raison de leur laxité cutanée. Il n’est pas rare que des enfants âgés d’une dizaine d’années souhaitent une intervention nécessitant une exérèse en plusieurs temps voire une greffe ou une expansion, alors qu’elle aurait pu être réalisée en un seul temps dans la petite enfance. Ce raisonnement n’est pas applicable aux NC de petite taille qui sont retirés aisément sous anesthésie locale. Ainsi, en cas de NC moyen, large ou géant, une évaluation spécialisée et si possible une concertation dermatologue/chirurgien sont souhaitables, afin de déterminer l’intérêt et le déroulement d’un programme chirurgical adapté et de donner une information claire aux parents.
Autres traitements
Par ailleurs, des cas de régression spontanée sont actuellement étudiés pour comprendre les mécanismes impliqués.
Éducation thérapeutique, thérapie cognitivo- comportementale et soutien psychologique sont bénéfiques pour aider les jeunes patients à vivre au quotidien avec leur NC et à mieux gérer le regard de l’autre (programme d’éducation thérapeutique « É… change de regard »,
Prise en charge, en pratique
En pratique, on tient compte de 2 constats (
– le risque de dégénérescence des NC de petite taille n’est probablement pas supérieur à celui d’un nævus acquis ;
– la chirurgie des NC géants ne modifie probablement pas le risque de mélanome ; elle doit être motivée essentiellement par l’impact psychosocial.
Pour les NC de petite taille, pas d’évaluation spécialisée dans l’enfance (elle peut être faite à l’adolescence ou chez l’adulte jeune).
En cas de NC de taille moyenne, les avis d’un dermatologue et d’un chirurgien sont souhaitables dans les premières années de vie (idéalement dans la première). L’objectif est de donner une information claire aux parents et de déterminer l’intérêt d’une chirurgie précoce afin d’obtenir le meilleur résultat esthétique. La surveillance dans l’enfance ne semble pas nécessaire, mais doit être annuelle à l’âge adulte.
Pour les NC larges et géants, une consultation spécialisée s’impose dans les 6 mois afin d’informer les parents, d’évaluer la nécessité d’examens complémentaires (IRM), et de discuter une prise en charge chirurgicale.
Dans tous les cas, toute modification du NC requiert un avis dermatologique rapide.
1. Physiopathologie des nævus congénitaux
Des études récentes montrent des mutations des gènes NRAS ou BRAF dans la plupart des cas, avec une plus nette prédominance des premières dans les NC moyens à géants.5 La mutation BRAF semble associée aux NC multiples et au phénotype multinodulaire. D’autres gènes semblent impliqués, mais avec une prévalence plus anecdotique : TP53, GNAQ et MC1R.
Dans une publication de 2018, les auteurs proposent une hypothèse explicative des différents patterns cliniques impliqués dans ces lésions :
– « segmentaire » : à partir de mélanocytes dérivés de la crête neurale, le long des feuillets ectodermiques avec atteintes des épithéliums ;
– « non-segmentaire » (le plus fréquent) : diffusion symétrique à partir de la ligne médiane, avec possibilité de satellites, et migration des mélanocytes mésodermiques.6
2. Risque de mélanome : probablement surestimé
Dans la revue de Krengel, et al.,8 l’analyse de 14 essais portant sur 6 571 patients retrouve un risque global de mélanome de 0,7 %, un âge médian de survenue de 7 ans. Le risque est plus élevé dans les études de plus faible effectif, suggérant un biais de sélection.
La revue systématique de Vourc’h-Jourdain, et al. de 2013 9, à propos de 14 études, rapporte 52 mélanomes chez 2 578 patients au total, soit un risque de 2 %, un âge de survenue entre 0 et 58 ans, avec une médiane à 12,6 ans. Sept mélanomes étaient de site primitif viscéral. La taille du NC était connue pour 38 d’entre eux : 74 % avaient une TPA ≥ 40 cm, 94 % avaient des satellites. Le risque de mélanome était de 12 % pour les NC géants en maillot avec TPA > 60 cm. Pour les larges, l’incidence était de 2,3 pour 1 000 patients-années (calculée à partir de 2 études prospectives incluant 347 patients).
Dans une autre étude rétrospective, à partir d’une cohorte de 448 patients suivis 25 ans,10 on compte 10 mélanomes survenus exclusivement chez des enfants avec NC multiples ou avec TPA > 60 cm, avec une incidence de 8 % pour ces derniers et 1 % pour les autres (12 % en cas d’anomalie neurologique associée). Sept des 10 mélanomes étaient à point de départ neurologique. L’âge de décès de ces 10 patients était en moyenne de 3,9 ans.
2. Polubothu S, Kinsler VA. Final congenital melanocytic naevi colour is determined by normal skin colour and unaltered by superficial removal techniques: a longitudinal study. Br J Dermatol 2020;182:721‑8.
3. Krengel S, Scope A, Dusza SW, Vonthein R, Marghoob AA. New recommendations for the categorization of cutaneous features of congenital melanocytic nevi. J Am Acad Dermatol 2013;68:441‑51.
4. Vergier B, Laharanne E, Prochazkova-Carlotti M, et al. Proliferative Nodules vs Melanoma Arising in Giant Congenital Melanocytic Nevi During Childhood. JAMA Dermatol 2016;152:1147‑51.
5. Kinsler VA, Thomas AC, Ishida M, et al. Multiple congenital melanocytic nevi and neurocutaneous melanosis are caused by postzygotic mutations in codon 61 of NRAS. J Invest Dermatol 2013;133:2229‑36.
6. Kinsler VA, Larue L. The patterns of birthmarks suggest a novel population of melanocyte precursors arising around the time of gastrulation. Pigment Cell Melanoma Res 2018;31:95‑109.
7. Waelchli R, Aylett SE, Atherton D, Thompson DJ, Chong WK, Kinsler VA. Classification of neurological abnormalities in children with congenital melanocytic naevus syndrome identifies magnetic resonance imaging as the best predictor of clinical outcome. Br J Dermatol 2015;173:739‑50.
8. Krengel S, Hauschild A, Schäfer T. Melanoma risk in congenital melanocytic naevi: a systematic review. Br J Dermatol 2006;155:1‑8.
9. Vourc’h-Jourdain M, Martin L, Barbarot S, aRED. Large congenital melanocytic nevi: Therapeutic management and melanoma risk: a systematic review. J Am Acad Dermatol 2013;68:493‑8.e14.
10. Kinsler VA, O’Hare P, Bulstrode N, et al. Melanoma in congenital melanocytic naevi. Br J Dermatol 2017;176:1131‑43.
11. Strauss RM, Newton Bishop JA. Spontaneous involution of congenital melanocytic nevi of the scalp. J Am Acad Dermatol 2008;58:508‑11.
12. Koot HM, de Waard-van der Spek F, Peer CD, Mulder PG, Oranje AP. Psychosocial sequelae in 29 children with giant congenital melanocytic naevi. Clin Exp Dermatol 2000;25:589‑93.
13. Bellier-Waast F, Perrot P, Duteille F, Stalder JF, Barbarot S, Pannier M. [Surgical treatment for giant congenital nevi: what are the psychosocial consequences for the child and family?]. Ann Chir Plast Esthet 2008;53:408‑14.
14. Pawlikowski JS, Brock C, Chen SC, et al. Acute Inhibition of MEK Suppresses Congenital Melanocytic Nevus Syndrome in a Murine Model Driven by Activated NRAS and Wnt Signaling. J Invest Dermatol 2015;135:2902.
15. Kinsler VA, O’Hare P, Jacques T, Hargrave D, Slater O. MEK inhibition appears to improve symptom control in primary NRAS-driven CNS melanoma in children. Br J Cancer 2017;116:990‑3.

 Encadrés
Encadrés