NAFLD et NASH
La NASH (NonAlcoholic SteatoHepatitis ; stéatohépatite métabolique) est définie, en plus de la stéatose, par la présence d’une infiltration de cellules inflammatoires et de signes de souffrance hépatocytaire (ballonisation).
Concernant environ 20 % des patients NAFLD, c’est la forme agressive de la maladie qui favorise l’accumulation de fibrose dans le parenchyme hépatique et ainsi l’évolution vers la cirrhose et le carcinome hépatocellulaire (CHC). La mortalité des patients NASH est augmentée (progression vers la cirrhose 2 fois plus rapide qu’en cas de stéatose) par rapport à la population générale.
Si l’on considère toutes les lésions hépatiques de la NAFLD (stéatose, infiltrat inflammatoire, ballonisation…), seule la fibrose est associée au pronostic de la maladie.
On en décrit 5 stades : de F0 (absence de fibrose) à F4 (cirrhose). Elle est dite « avancée » à partir du stade F3, où la mortalité est très significativement augmentée.1
Parmi les maladies chroniques du foie, le cancer primitif ou CHC se développe surtout au cours de la cirrhose. En cas de NAFLD, le CHC survient sur un foie non cirrhotique dans environ 30 % des cas, sans qu’on connaisse les facteurs prédictifs de ce phénomène.
Quels mécanismes ?
De manière simplifiée, elle résulte en partie d’un apport alimentaire inadapté associant un excès calorique et des déséquilibres nutritionnels. S’y ajoutent un défaut d’activité physique et une sédentarité excessive, à l’origine d’un stockage des apports caloriques dans le tissu adipeux. Or, ce dernier ne peut s’étendre à l’infini. À partir d’un certain seuil (variable d’un individu à l’autre), il s’enflamme et relargue des acides gras (lipolyse) et des molécules inflammatoires (cytokines) dans le foie.
Au niveau de cet organe, un apport massif d’acides gras provenant directement de l’intestin par l’alimentation, du tissu adipeux (la lipolyse) et du foie lui-même (à partir du glucose) est alors stocké (stéatose hépatique) ou excrété dans la circulation sanguine sous forme de very low density lipoprotein (VLDL). À partir d’un certain seuil, le foie n’est plus capable de stocker les lipides, ce qui produit un stress pour l’hépatocyte et l’apparition d’une lipotoxicité (toxicité des lipides). L’hépatocyte en souffrance libère des molécules inflammatoires (les cytokines) et meurt (apoptose). Dans le foie, ces cytokines (produites par cet organe mais aussi par le tissu adipeux et l’intestin) attirent des cellules inflammatoires, comme les macrophages ou les lymphocytes (la NASH). Ces signaux activent les cellules stellaires du foie, créant les conditions d’une fibrose, puis d’une cirrhose.
Modalités diagnostiques
L’absence de terrain métabolique, une cytolyse > 5 fois la normale, une élévation de la phosphatase alcaline > 1,5 fois la normale, une hyperferritinémie > 1 000 µg/L ou un coefficient de saturation de la transferrine > 45 % sont inhabituels. Ils doivent donc faire rechercher une autre maladie.
En théorie, le diagnostic de NAFLD nécessite une biopsie hépatique pour mettre en évidence les lésions caractéristiques (stéatose, infiltration inflammatoire, ballonisation hépatocytaire, fibrose). Cependant, il n’est pas envisageable de la réaliser chez tous les individus à risque parce que cela reviendrait à proposer à des millions de patients une procédure invasive. En pratique, c’est donc un diagnostic d’élimination, posé dans un contexte métabolique et d’insulinorésistance, une fois écartées les autres causes de maladies chroniques du foie (
Principaux diagnostics différentiels : maladie alcoolique du foie, hépatite virale chronique (B ou C), hémochromatose ou hépatite auto-immune. Du fait de sa prévalence élevée, la NAFLD peut coexister avec d’autres maladies chroniques du foie et agir comme cofacteur aggravant. D’où l’intérêt de les rechercher systématiquement. La NAFLD étant associée à l’insulinorésistance, la recherche de chaque paramètre du syndrome métabolique est systématique.6
Quels tests de fibrose ?
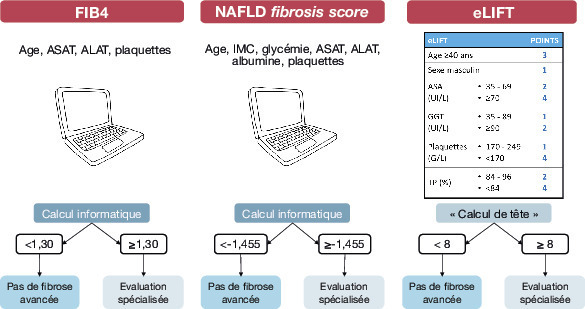
Les tests simples sanguins reposent sur des paramètres usuels et sont accessibles gratuitement(applications smartphones, internet). Les plus utilisés sont le FIB-4 (score fibrosis-4 ; medicalcul.free.fr/fib4.html) et le NAFLD fibrosis score (nafldscore.com/). L’eLIFT, easy LIver Fibrosis Test, score français, est calculable de tête. Ils ont une très bonne valeur prédictive négative : un résultat négatif (NFS < - 1,455 ; FIB4 < 1,30 ou eLIFT < 8) permet à lui seul d’affirmer l’absence de fibrose hépatique avancée dans la NAFLD (
Les tests spécialisés (appareils d’élastométrie ou tests sanguins) utilisant des marqueurs plus coûteux et dont le calcul est payant, sont plus performants mais ne sont pas disponibles en soins primaires.
De façon pragmatique, on commence par un test simple. Négatif, il permet d’éliminer une fibrose avancée. En revanche, s’il est positif, une évaluation spécialisée est recommandée.
Quelle prise en charge ?
Augmentation de l’activité physique et lutte contre la sédentarité sont essentielles. Le patient est invité à limiter le temps devant les écrans et à accroître celui de l’activité physique, qui peut s’intégrer dans la vie quotidienne (prendre les escaliers, faire ses courses à pied...), mais un temps spécifique doit aussi lui être alloué régulièrement. L’OMS préconise de cumuler 150 minutes par semaine d’activité physique modérément intense (être essoufflé à la fin de l’effort) ou 25 minutes d’activité vigoureuse 3 fois par semaine.
Chez certains patients avec des pathologies chroniques entraînant des handicaps physiques, cognitifs, sensoriels ou douloureux, ces recommandations sont difficiles à appliquer.
Depuis 2017, la Sécurité sociale rembourse l’« activité physique adaptée » (APA). Celle-ci doit être prescrite par le médecin référent d’un sujet en affection de longue durée (comme les diabétiques, très nombreux chez les patients NAFLD). L’APA est réalisée par un kinésithérapeute ou un physiothérapeute (diplômé de la filière sport STAPS, mention APA). Des informations sont disponibles sur le site de la Société française des professionnels en APA (www.sfp-apa.fr/).
Chez les patients en surpoids ou obèses, une alimentation équilibrée et modérément hypocalorique est recommandée pour obtenir une perte de 5 à 10 % du poids initial en 6 mois, puis la maintenir dans le temps.
Le régime méditerranéen a de nombreux effets bénéfiques pour la santé et doit être privilégié (
Un suivi par une diététicienne peut être utile.
En cas d’échec des mesures hygiénodiététiques, la chirurgie bariatrique a fait la preuve de son efficacité sur la perte de poids, la résolution de la NAFLD et des autres paramètres du syndrome métaboliques. Celle-ci n’est indiquée qu’en cas d’obésité sévère (IMC ≥ 35 kg/m2) avec NASH, ou d’obésité morbide (IMC ≥ 40 kg/m2).
Il faut également contrôler les facteurs de risque cardiovasculaire, première cause de mortalité en l’absence de fibrose avancée :
– arrêt du tabac ;
– contrôle de la PA ;
–traitement d’une dyslipidémie par statines en première intention ;
– équilibre d’un diabète de type 2 (l’utilisation de la metformine est possible ; s’ils sont indiqués, les analogues du GLP-1 pourraient être envisagés. En effet, des études très préliminaires ont suggéré leur efficacité sur les lésions de NASH) ;
– dépistage d’un syndrome d’apnées obstructives du sommeil.
Le surpoids et l’obésité sont également des facteurs de risque de cancer. La NAFLD a été associée à un surrisque de cancer du sein chez la femme et du côlon chez l’homme. Le dépistage est donc particulièrement recommandé dans cette population.
Enfin, en cas de cirrhose, un dépistage semestriel des carcinome hépatocellulaires par une échographie abdominale, est préconisé (sa bonne observance améliore la survie selon plusieurs études). En effet, deux tiers de ces derniers sont découverts à un stade avancé et sont alors grevés d’un pronostic sombre.
1. Un Français sur six
La prévalence de la NAFLD serait de 25 % de la population adulte mondiale et de 24 % en Europe.2 En France, selon des chiffres récents, elle est estimée à 18 %. Les patients les plus à risque sont les diabétiques et les obèses, avec une prévalence de 63 % et 80 % respectivement. La NASH, forme agressive de la maladie, atteint 3-5 % de la population générale. Parmi les patients ayant une NAFLD, on estime qu’environ 3 % ont une fibrose hépatique avancée.
2. NAFLD : Régime alimentaire
Privilégier
• glucides complets (pain ou féculents) à chaque repas
• eau : seule boisson indispensable
• fruits : 2/jour, toujours à la fin du repas
• légumes cuits et crudités : 3/jour
• volaille (sans la peau) : 2 x/semaine
• poissons gras (saumon, maquereau) : 2 x/semaine
• produits laitiers nature (yaourt, fromage blanc...) : 2/jour
• café
À consommer avec modération
• fromage : 1 part par jour (30 g = 1/8 camembert)
• charcuterie : 1 x/semaine
• fritures : 1 x/ semaine (frites, viandes panées...)
• viennoiserie : 1 x/semaine
• vin : max 1 verre par jour
• beurre : 10 g par jour, huile 1 c à soupe par repas
• viande rouge : 1 x/semaine
• crèmes desserts, yaourts aux fruits : 1 x/semaine
• confiture : 1 fois tous les 15 jours
• pâtisseries : 1 x/semaine
À proscrire
• sodas
• confiseries, céréales raffinées
2. Younossi Z, Tacke F, Arrese M, et al. Global Perspectives on Nonalcoholic Fatty Liver Disease and Non alcoholic Steatohepatitis. Hepatology 2019;69: 2672-82.
3. Diehl AM, Day C. Cause, Pathogenesis, and Treatment of Nonalcoholic Steatohepatitis. N Engl J Med 2017;377:2063-72.
4. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016;64:1388-402.
5. Romero-Gómez M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol 2017;67:829-46.
6. Alberti KG, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009;120:1640-5.

 Encadrés
Encadrés