Sa prévalence, suivant celle du diabète, ne cesse d’augmenter en Occident.
Chaque année, environ 11 000 pa-tients débutent un traitement de suppléance rénale (dialyse ou transplantation) pour insuffisance terminale selon le rapport REIN. Plus de 40 % sont diabétiques et 25 % sont arrivés à ce stade à cause d’une néphropathie diabétique (ND). Celle-ci, avec la néphropathie vasculaire du sujet âgé, représente environ la moitié des causes d’insuffisance rénale chronique (IRC) terminale.
En France, près de 30 % des diabétiques ont une IRC et au moins 18 % une forme avancée ( stade 3).
Leur mortalité lorsqu’il y a une atteinte rénale est 20 à 200 fois plus élevée qu’en population générale. En outre, la mortalité globale des IRC terminale (ajustée à l’âge et aux comorbidités) est plus importante chez les diabétiques.
En France, près de 30 % des diabétiques ont une IRC et au moins 18 % une forme avancée ( stade 3).
Leur mortalité lorsqu’il y a une atteinte rénale est 20 à 200 fois plus élevée qu’en population générale. En outre, la mortalité globale des IRC terminale (ajustée à l’âge et aux comorbidités) est plus importante chez les diabétiques.
Évolution
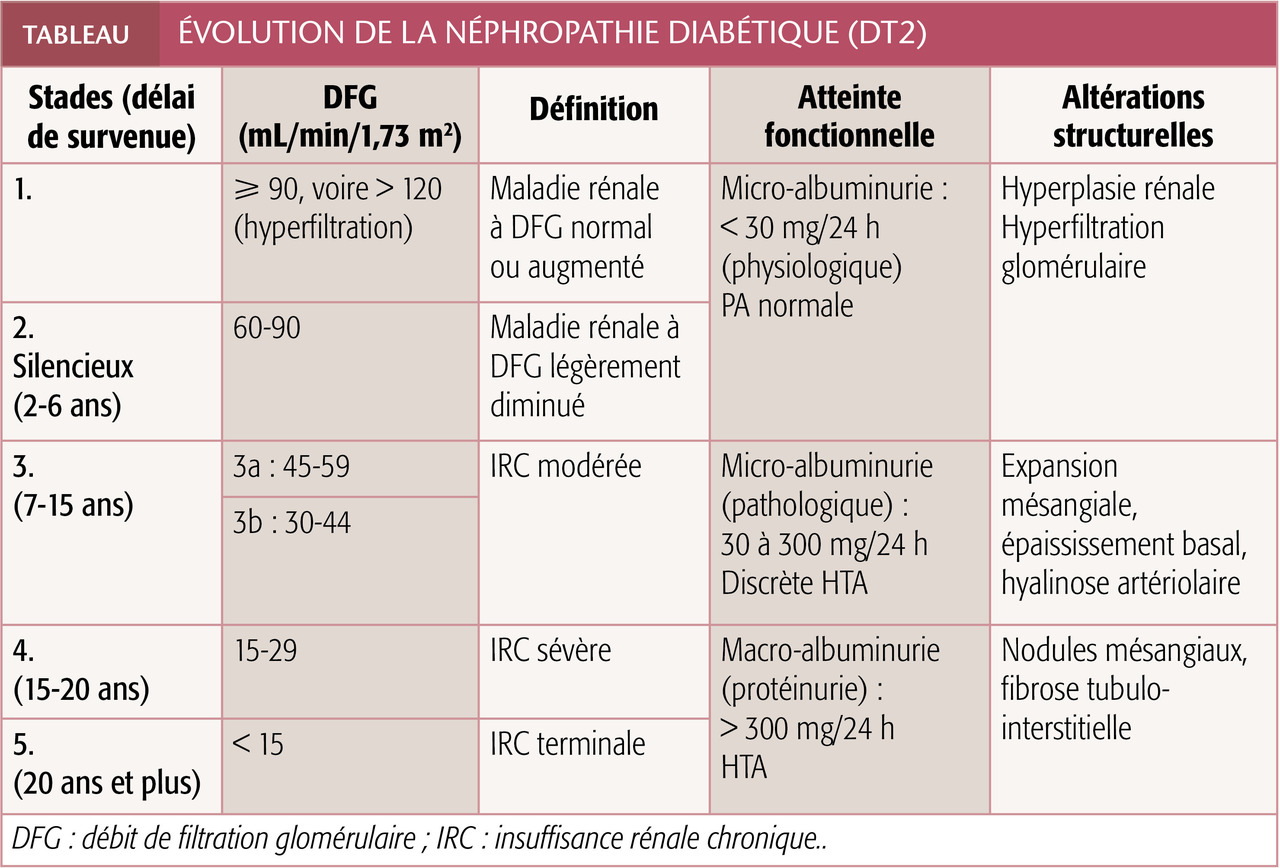
Modélisée dans le diabète de type 1 (DT1) (tableau ), la ND progresse en 5 stades évolutifs.
L’atteinte initiale correspond à une élévation du débit de filtration glomérulaire (DFG) avec augmentation de la taille des reins. Le stade 2 est appelé ND incipiens ou silencieuse. Au niveau suivant, la micro-albuminurie atteint 30 à 300 mg/j, mais la fonction rénale reste normale. Au stade 4, la protéinurie (ou macro-albuminurie) est supérieure à 300 mg/j et l’IR installée. La phase 5 est celle de l’IRC terminale.
Certains patients développent une ND avec IRC sans protéinurie (stade 1 ou 2) : 13 à 50 % des diabétiques insuffisants rénaux sont normo-albuminuriques. La progression de la maladie rénale est alors plus lente.
Dans une étude française récente, les diabétiques de type 2 protéinuriques ont, à 2 ans, un surrisque de décès de 8,2 % et de 16,2 % d’événements rénaux (aggravation fonctionnelle, insuffisance termi- nale).
Les accès d’insuffisance aiguë émaillant la ND sont des facteurs de risque indépendants de dégradation rapide.
Les diabétiques de type 1 ayant un apparenté diabétique avec une ND ont un risque de 83 % de développer à leur tour une néphropathie. Des études génomiques ont identifié des polymorphismes associés à sa survenue.
Les facteurs environnementaux jouent un rôle majeur, en particulier le régime alimentaire (apports glucidiques et protéiques surtout).
Bien contrôler l’albuminurie, la glycémie et la pression artérielle est crucial.
L’atteinte initiale correspond à une élévation du débit de filtration glomérulaire (DFG) avec augmentation de la taille des reins. Le stade 2 est appelé ND incipiens ou silencieuse. Au niveau suivant, la micro-albuminurie atteint 30 à 300 mg/j, mais la fonction rénale reste normale. Au stade 4, la protéinurie (ou macro-albuminurie) est supérieure à 300 mg/j et l’IR installée. La phase 5 est celle de l’IRC terminale.
Certains patients développent une ND avec IRC sans protéinurie (stade 1 ou 2) : 13 à 50 % des diabétiques insuffisants rénaux sont normo-albuminuriques. La progression de la maladie rénale est alors plus lente.
Dans une étude française récente, les diabétiques de type 2 protéinuriques ont, à 2 ans, un surrisque de décès de 8,2 % et de 16,2 % d’événements rénaux (aggravation fonctionnelle, insuffisance termi- nale).
Les accès d’insuffisance aiguë émaillant la ND sont des facteurs de risque indépendants de dégradation rapide.
Les diabétiques de type 1 ayant un apparenté diabétique avec une ND ont un risque de 83 % de développer à leur tour une néphropathie. Des études génomiques ont identifié des polymorphismes associés à sa survenue.
Les facteurs environnementaux jouent un rôle majeur, en particulier le régime alimentaire (apports glucidiques et protéiques surtout).
Bien contrôler l’albuminurie, la glycémie et la pression artérielle est crucial.
Dépistage et évaluation
Il faut rechercher la ND dès la découverte d’un DT2 et pour tout DT1 après 5 ans d’évolution.
Créatinine plasmatique avec estimation du débit de filtration glomérulaire par les méthodes MDRD ou CKD-EPI.
Albuminurie des 24 heures, au mieux à 2 reprises en dehors de toute infection urinaire. Elle révèle une micro-albuminurie ou une macro-albuminurie en l’absence de facteur confondant (infection urinaire, fièvre, exercice physique, hématurie d’origine urologique, hypertension sévère ou maligne, décompensation acidocétosique, autre néphropathie).
Il existe toujours à l’état physiologique une faible excrétion d’albumine. C’est une micro-albuminurie au-delà de 30 mg/24 h ; ou bien lorsque le rapport albuminurie/créatininurie (A/C) est supérieur à 30 mg/g. Dans un échantillon matinal (< 24 heures), elle est définie par une valeur entre 20 et 200 mg/L ; ou bien par un A/C entre 20 à 200 mg/g.
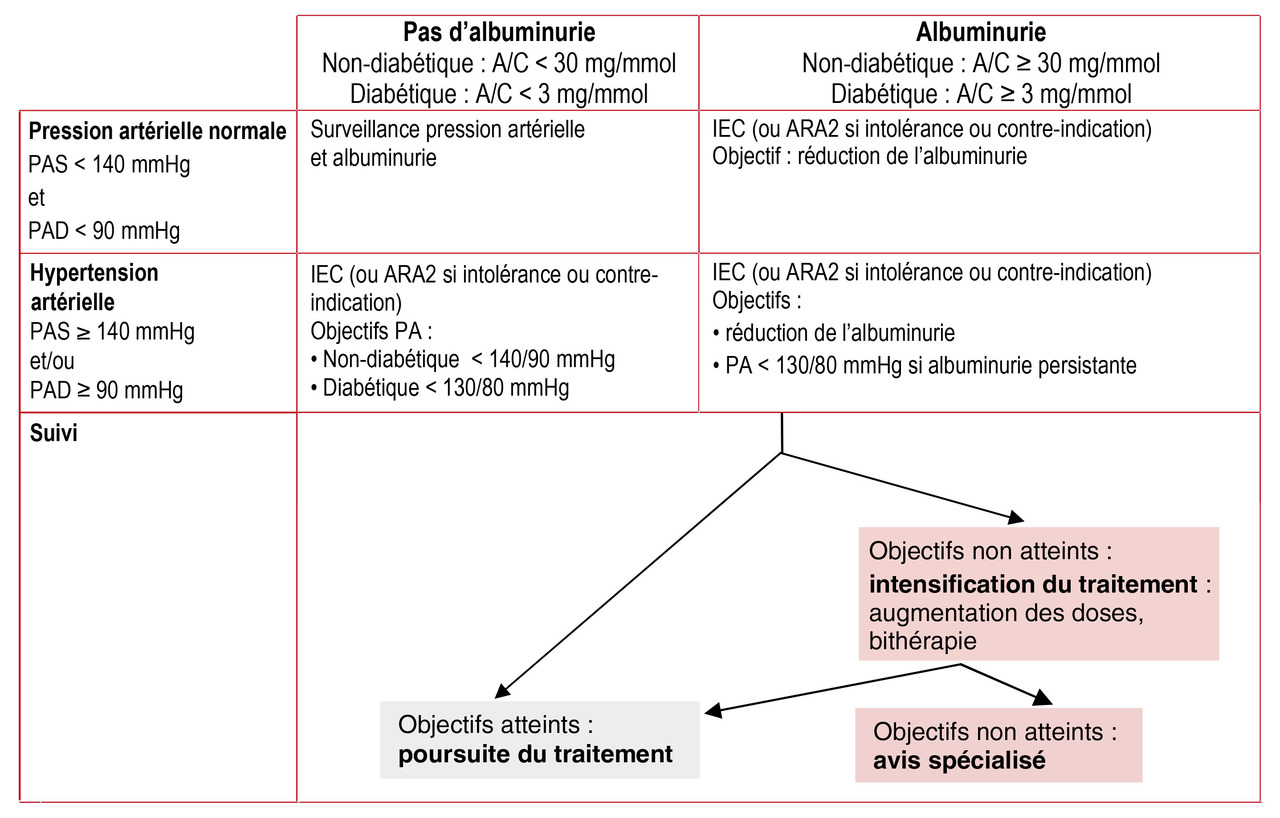
Micro-albuminurie et macro-albuminurie sont, dans le DT2, le plus important fac- teur prédictif de décès cardiovasculaires (figure ).
La natriurèse renseigne sur l’apport sodé (100 mmol de Na+ équivalent à environ 6 g de sel) et l’urée urinaire reflète l’apport protéique en g/kg/j (urée urinaire/poids x 5).
Pression artérielle (PA) couchée et debout. Lors du diagnostic d’un DT2, 80 % des patients sont hypertendus. En cas de PA élevée, la MAPA (surtout) ou l’automesure confirment l’HTA. Elles sont utiles pour dépister une élévation masquée (ambulatoire isolée) chez les patients ayant une néphropathie mais normotendus en consultation. Cette éventualité est particulièrement fréquente en cas de DT2.
En outre, l’hypotension orthostatique, complication classique de la neuropathie diabétique, est fréquente : chute de plus de 20 mmHg de la pression artérielle systolique (PAS) et/ou de plus de 10 mmHg de la pression artérielle diastolique (PAD).
Examen ophtalmologique annuel : impératif. L’atteinte microvasculaire, notamment la rétinopathie, est quasi constante dans le DT1 et touche 50-60 % des DT2 avec protéinurie.
L’échographie rénale mesure la taille des reins, recherche une éventuelle cause vasculaire ou obstructive à l’insuffisance rénale (associée ou diagnostic diffé- rentiel).
Créatinine plasmatique avec estimation du débit de filtration glomérulaire par les méthodes MDRD ou CKD-EPI.
Albuminurie des 24 heures, au mieux à 2 reprises en dehors de toute infection urinaire. Elle révèle une micro-albuminurie ou une macro-albuminurie en l’absence de facteur confondant (infection urinaire, fièvre, exercice physique, hématurie d’origine urologique, hypertension sévère ou maligne, décompensation acidocétosique, autre néphropathie).
Il existe toujours à l’état physiologique une faible excrétion d’albumine. C’est une micro-albuminurie au-delà de 30 mg/24 h ; ou bien lorsque le rapport albuminurie/créatininurie (A/C) est supérieur à 30 mg/g. Dans un échantillon matinal (< 24 heures), elle est définie par une valeur entre 20 et 200 mg/L ; ou bien par un A/C entre 20 à 200 mg/g.
Micro-albuminurie et macro-albuminurie sont, dans le DT2, le plus important fac- teur prédictif de décès cardiovasculaires (
La natriurèse renseigne sur l’apport sodé (100 mmol de Na+ équivalent à environ 6 g de sel) et l’urée urinaire reflète l’apport protéique en g/kg/j (urée urinaire/poids x 5).
Pression artérielle (PA) couchée et debout. Lors du diagnostic d’un DT2, 80 % des patients sont hypertendus. En cas de PA élevée, la MAPA (surtout) ou l’automesure confirment l’HTA. Elles sont utiles pour dépister une élévation masquée (ambulatoire isolée) chez les patients ayant une néphropathie mais normotendus en consultation. Cette éventualité est particulièrement fréquente en cas de DT2.
En outre, l’hypotension orthostatique, complication classique de la neuropathie diabétique, est fréquente : chute de plus de 20 mmHg de la pression artérielle systolique (PAS) et/ou de plus de 10 mmHg de la pression artérielle diastolique (PAD).
Examen ophtalmologique annuel : impératif. L’atteinte microvasculaire, notamment la rétinopathie, est quasi constante dans le DT1 et touche 50-60 % des DT2 avec protéinurie.
L’échographie rénale mesure la taille des reins, recherche une éventuelle cause vasculaire ou obstructive à l’insuffisance rénale (associée ou diagnostic diffé- rentiel).
Quand faire une biopsie rénale ?
Discutée avec le néphrologue au cas par cas, elle recherche une autre cause (que le diabète) à la dégradation rénale, qui nécessiterait une prise en charge spécifique. Exceptionnellement nécessaire, elle est envisagée dans les cas suivants :
– DT1 avec insuffisance rénale et/ou protéinurie sans rétinopathie ;
– évolution rapide de la protéinurie et/ou de l’insuffisance rénale (> 10 mL/min/an) ou si le diabète récent et peu sévère n’explique pas l’atteinte constatée ;
– hématurie confirmée au moins à deux reprises ;
– insuffisance rénale sans protéinurie ;
– anomalies immunes, gammapathie monoclonale ou maladie générale associée.
– DT1 avec insuffisance rénale et/ou protéinurie sans rétinopathie ;
– évolution rapide de la protéinurie et/ou de l’insuffisance rénale (> 10 mL/min/an) ou si le diabète récent et peu sévère n’explique pas l’atteinte constatée ;
– hématurie confirmée au moins à deux reprises ;
– insuffisance rénale sans protéinurie ;
– anomalies immunes, gammapathie monoclonale ou maladie générale associée.
Traitement médicamenteux
Il vise le contrôle des 3 facteurs aggra- vant la protéinurie : hyperglycémie, HTA (figure ) et tabac.
Un bon équilibre glycémique freine l’évolution vers la macro-albuminurie et pourrait stabiliser les lésions gloméru-laires. L’intensité du traitement est à mettre en balance avec l’âge, l’ancienneté du diabète, la comorbidité cardiovasculaire et le risque d’hypoglycémie lié aux molécules.1 Celui-ci est plus élevé à partir du stade 3 du fait de la diminution de la clairance de l’insuline et des antidia-bétiques oraux, et de la réduction de la glucogenèse rénale.
Les recommandations de la KDOQI (Kidney Disease Outcomes Quality Initiative) sont une HbA1c inférieure à 7 %, si le patient est jeune, le diabète récent et sans complication cardiovasculaire, pour une prévention optimale de la ND (pas au-delà du stade 3). Une cible de 8 % est admise dans les autres cas et les stades 4 et 5. Attention, l’HbA1c est perturbée en cas d’IRC : faussement élevée en cas d’acidose, faussement diminuée en cas d’hémolyse ou de carence martiale.
Chez les patients ayant une PAS supérieure à 140 mmHg, le traitement anti-hypertenseur réduit la mortalité globale et cardiovasculaire. Cette HTA est quasi toujours présente s’il y a une atteinte rénale significative (stade 3 et plus). Recom-mandations de la HAS : une PA inférieure à 130/80 mmHg lorsque l’albuminurie est supérieure à 30 mg/24 h. Cette cible est discutée. Pour la SFHTA (Société française d’hypertension artérielle, 2013), la PAS doit se situer entre 130 et 139 mmHg et la PAD sous 90 mmHg. Pour l’ESC (European Society of Cardiology 2013), l’objectif est inférieur à 140/85 mmHg chez les diabétiques. L’accord professionnel est d’individualiser la cible selon les caractéristiques du patient. L’option basse semble licite (130/80), notamment chez les plus jeunes.
Les bloqueurs du système rénine-angiotensine sont privilégiés puisqu’ils traitent l’HTA et diminuent aussi la micro-albuminurie. Leur association aux autres anti-hypertenseurs est possible en bi- ou trithérapie : avec les diurétiques d’abord (thiazidique ou de l’anse) en raison de leur impact sur la rétention sodée,2 ou bien avec un inhibiteur calcique ou un bêta- bloquant en fonction de la comorbidité. Le double blocage par IEC + ARA2 n’améliore pas le pronostic mais accroît les effets indésirables : il est abandonné.
Dans tous les cas, il faut s’assurer d’un con-trôle en vie réelle hors du cabinet médical.
Réduction de la protéinurie. Les IEC (périndopril) et les ARA 2 (losartan et irbésartan) ont montré leur efficacité en diminuant la protéinurie et retardant la dégradation rénale des DT1 et 2.2, 3 Ils sont indiqués dès le stade micro-albuminurique, indépendamment de la PA. L’association de 2 bloqueurs du système rénine-angiotensine n’est pas recommandée. Une élévation de la créatinine plasmatique de plus de 30 % après introduction médicamenteuse doit faire suspendre le traitement. Une bithérapie est possible avec : diurétiques thiazidiques, anti-aldo-stérone, inhibiteurs calciques, bêta- bloquants.
Chez les patients hypertendus normo-albuminuriques mais insuffisants rénaux, la stratégie n’est pas codifiée : il n’est pas sûr que le blocage du système rénine-angiotensine soit efficace. Cependant, si cette HTA nécessite au moins une bithérapie, une association bloqueur du système rénine + inhibiteur calcique est probablement un bon choix ; alors qu’en cas de micro-albuminurie ou de macro-albuminurie, on préfère bloqueur du système rénine + diurétique.
Diminuer la protéinurie passe aussi par une normalisation de l’apport sodé (6 g/j) et une réduction modérée de l’alimentation protéique (1 à 1,2 g/kg/j sauf chez le sujet âgé ou fragile chez qui il faut être prudent), un amaigrissement en cas de surpoids, l’exercice physique et l’arrêt du tabac.
Traitement d’une dyslipidémie en fonction du risque cardiovasculaire global. Les recommandations sont un LDL-cholestérol inférieur à 2,57 mmol/L (1 g/L) chez les diabétiques en général et en dessous de 1,81 mmol/L (0,7 g/L) si comorbidité cardiaque.
Un bon équilibre glycémique freine l’évolution vers la macro-albuminurie et pourrait stabiliser les lésions gloméru-laires. L’intensité du traitement est à mettre en balance avec l’âge, l’ancienneté du diabète, la comorbidité cardiovasculaire et le risque d’hypoglycémie lié aux molécules.1 Celui-ci est plus élevé à partir du stade 3 du fait de la diminution de la clairance de l’insuline et des antidia-bétiques oraux, et de la réduction de la glucogenèse rénale.
Les recommandations de la KDOQI (Kidney Disease Outcomes Quality Initiative) sont une HbA1c inférieure à 7 %, si le patient est jeune, le diabète récent et sans complication cardiovasculaire, pour une prévention optimale de la ND (pas au-delà du stade 3). Une cible de 8 % est admise dans les autres cas et les stades 4 et 5. Attention, l’HbA1c est perturbée en cas d’IRC : faussement élevée en cas d’acidose, faussement diminuée en cas d’hémolyse ou de carence martiale.
Chez les patients ayant une PAS supérieure à 140 mmHg, le traitement anti-hypertenseur réduit la mortalité globale et cardiovasculaire. Cette HTA est quasi toujours présente s’il y a une atteinte rénale significative (stade 3 et plus). Recom-mandations de la HAS : une PA inférieure à 130/80 mmHg lorsque l’albuminurie est supérieure à 30 mg/24 h. Cette cible est discutée. Pour la SFHTA (Société française d’hypertension artérielle, 2013), la PAS doit se situer entre 130 et 139 mmHg et la PAD sous 90 mmHg. Pour l’ESC (European Society of Cardiology 2013), l’objectif est inférieur à 140/85 mmHg chez les diabétiques. L’accord professionnel est d’individualiser la cible selon les caractéristiques du patient. L’option basse semble licite (130/80), notamment chez les plus jeunes.
Les bloqueurs du système rénine-angiotensine sont privilégiés puisqu’ils traitent l’HTA et diminuent aussi la micro-albuminurie. Leur association aux autres anti-hypertenseurs est possible en bi- ou trithérapie : avec les diurétiques d’abord (thiazidique ou de l’anse) en raison de leur impact sur la rétention sodée,2 ou bien avec un inhibiteur calcique ou un bêta- bloquant en fonction de la comorbidité. Le double blocage par IEC + ARA2 n’améliore pas le pronostic mais accroît les effets indésirables : il est abandonné.
Dans tous les cas, il faut s’assurer d’un con-trôle en vie réelle hors du cabinet médical.
Réduction de la protéinurie. Les IEC (périndopril) et les ARA 2 (losartan et irbésartan) ont montré leur efficacité en diminuant la protéinurie et retardant la dégradation rénale des DT1 et 2.2, 3 Ils sont indiqués dès le stade micro-albuminurique, indépendamment de la PA. L’association de 2 bloqueurs du système rénine-angiotensine n’est pas recommandée. Une élévation de la créatinine plasmatique de plus de 30 % après introduction médicamenteuse doit faire suspendre le traitement. Une bithérapie est possible avec : diurétiques thiazidiques, anti-aldo-stérone, inhibiteurs calciques, bêta- bloquants.
Chez les patients hypertendus normo-albuminuriques mais insuffisants rénaux, la stratégie n’est pas codifiée : il n’est pas sûr que le blocage du système rénine-angiotensine soit efficace. Cependant, si cette HTA nécessite au moins une bithérapie, une association bloqueur du système rénine + inhibiteur calcique est probablement un bon choix ; alors qu’en cas de micro-albuminurie ou de macro-albuminurie, on préfère bloqueur du système rénine + diurétique.
Diminuer la protéinurie passe aussi par une normalisation de l’apport sodé (6 g/j) et une réduction modérée de l’alimentation protéique (1 à 1,2 g/kg/j sauf chez le sujet âgé ou fragile chez qui il faut être prudent), un amaigrissement en cas de surpoids, l’exercice physique et l’arrêt du tabac.
Traitement d’une dyslipidémie en fonction du risque cardiovasculaire global. Les recommandations sont un LDL-cholestérol inférieur à 2,57 mmol/L (1 g/L) chez les diabétiques en général et en dessous de 1,81 mmol/L (0,7 g/L) si comorbidité cardiaque.
Recours au néphrologue
Il est nécessaire en cas d’insuffisance rénale déclarée (DFG < 45 mL/min/1,73 m2) ou lors d’une atypie clinique pouvant indiquer une biopsie rénale : protéinurie absente ou au contraire très importante, évolution rapide de l’insuffisance rénale, doute diagnostique.
Ce suivi spécialisé permet de limiter la dégradation rénale (voire de la stabiliser) et d’anticiper l’éventuel recours à une suppléance : information et préparation à la dialyse (hémodialyse ou dialyse péritonéale) et à la greffe. Dans ce cas, on veille à préserver le capital veineux, on met en place une fistule artérioveineuse ou un cathéter de dialyse péritonéale. En l’absence de contre-indication à la transplantation, le néphrologue donne les informations utiles et débute le bilan pré-greffe.
Sont aussi réalisés un bilan sanguin à la recherche d’une anémie et une éventuelle supplémentation martiale. L’érythro-poïétine est envisagée si l’hémoglobine est inférieure à 100 g/L (insuffisance rénale avancée).
Ce suivi spécialisé permet de limiter la dégradation rénale (voire de la stabiliser) et d’anticiper l’éventuel recours à une suppléance : information et préparation à la dialyse (hémodialyse ou dialyse péritonéale) et à la greffe. Dans ce cas, on veille à préserver le capital veineux, on met en place une fistule artérioveineuse ou un cathéter de dialyse péritonéale. En l’absence de contre-indication à la transplantation, le néphrologue donne les informations utiles et débute le bilan pré-greffe.
Sont aussi réalisés un bilan sanguin à la recherche d’une anémie et une éventuelle supplémentation martiale. L’érythro-poïétine est envisagée si l’hémoglobine est inférieure à 100 g/L (insuffisance rénale avancée).
Perspectives thérapeutiques
De nouveaux traitements font leur apparition. Récemment, l’empagliflozine, bloqueur du transporteur 2 du sodium-glucose rénal (SGLT2, nouvelle classe d’antidia-bétique), a montré son efficacité contre placebo : elle ralentit la progression de la ND chez les patients DT2. Plus récemment, chez ce même type de malades, la canagliflozine (autre SGLT2) a réduit le risque rénal et d’événements cardiovasculaires par rapport au placebo, avec toutefois un risque augmenté d’ischémie des membres inférieurs.
Encadre
En cause : toxicité du glucose
L’hyperglycémie entraîne une vasodilatation de l’artériole afférente et une vasoconstriction de l’efférente favorisant l’augmentation du débit de filtration glomérulaire. Cette hyperfiltration, associée à une augmentation de la pression capillaire locale, induit une prolifération mésangiale et un épaississement de la membrane basale. Les IEC ou ARA2 contrecarrent ce phénomène par vasodilatation efférente et baisse de pression glomérulaire ; ils freinent ainsi la progression des lésions.
En cas d’hyperglycémie prolongée, les produits de glycation avancée (AGE, advanced glycation end products) provoquent la synthèse de cytokines inflammatoires et entraînent une prolifération suivie d’une apoptose des cellules β pancréatiques.
références
1. ADVANCE Collaborative group; Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-72.
2. Barnett AH, Bain SC, Bouter P, et al. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med 2004;351:1952-61.
3. ACCORD Study Group, Cushman WC, Evans GW, Byington RP, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010;362:1575-85.
4. HAS. Guide du parcours de soins. Maladie rénale chronique de l’adulte. Février 2012.
2. Barnett AH, Bain SC, Bouter P, et al. Angiotensin-receptor blockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy. N Engl J Med 2004;351:1952-61.
3. ACCORD Study Group, Cushman WC, Evans GW, Byington RP, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010;362:1575-85.
4. HAS. Guide du parcours de soins. Maladie rénale chronique de l’adulte. Février 2012.

 Encadrés
Encadrés