Diagnostiquer une néphroangiosclérose, une sténose de l’artère rénale, une microangiopathie thrombotique, une maladie des emboles de cristaux de cholestérol.
Néphroangiosclérose « bénigne »
Définition
Épidémiologie
Diagnostic
Clinique
Il s’agit d’un diagnostic d’exclusion qui repose sur un faisceau d’arguments :- hypertension artérielle ancienne (primitive ou secondaire) mal équilibrée évoluant depuis au moins 5 ans ;
- complications vasculaires des autres microcirculations (myocardiopathie hypertensive, rétinopathie hypertensive, démence vasculaire) ou des vaisseaux de plus gros calibre (cardiopathie ischémique, accidents vasculaires cérébraux [AVC], artériopathie des membres inférieurs) ;
- hypertrophie ventriculaire gauche ;
- absence de signes extrarénaux évoquant une autre étiologie.
Biologie et histologie
La néphroangiosclérose se traduit biologiquement par un débit de filtration glomérulaire évalué (DFGe) < 60 mL/min/1,73 m². La protéinurie est inconstante (nulle, microalbuminurie, ou protéinurie habituellement < 1 g/24 h ou 100 mg/mmol de créatininurie). En règle générale, il n’y a ni hématurie glomérulaire ni leucocyturie aseptique.Au plan histologique, les lésions d’endartérite fibreuse conduisent à une oblitération progressive des petits vaisseaux.
Imagerie
L’échographie rénale retrouve 2 reins de taille normale ou diminuée selon le degré d’insuffisance rénale, de contours réguliers. Une asymétrie de taille devra faire rechercher une sténose d’une ou des artères rénales.Évolution
Traitement
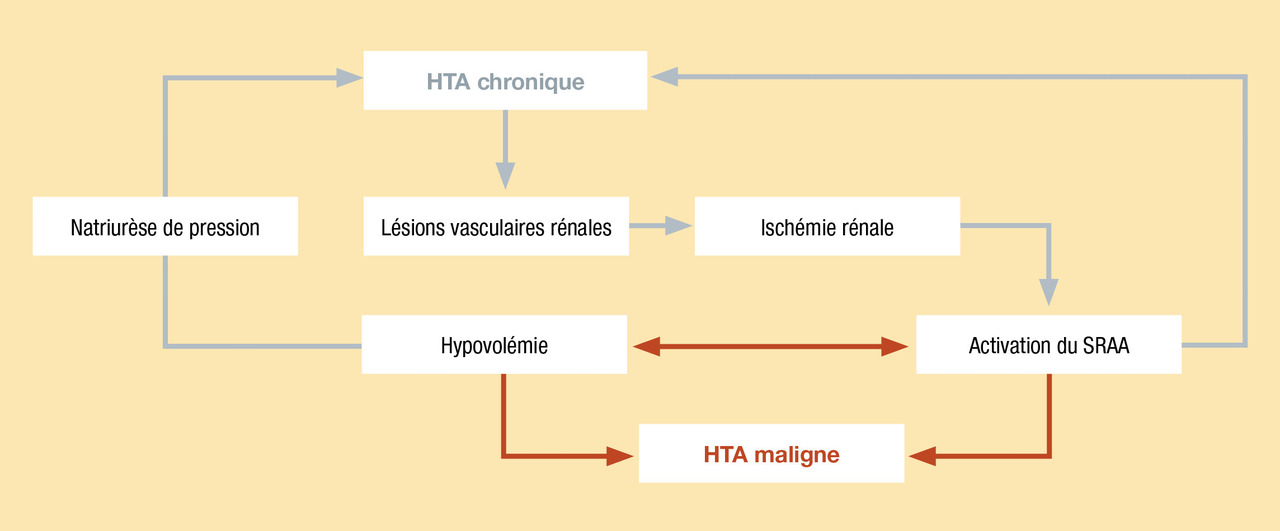
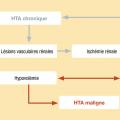
Néphroangiosclérose « maligne »
Définition
- microangiopathie, avec coagulation intravasculaire disséminée ;
- encéphalopathie hypertensive (dans environ 15 % des cas) ;
- insuffisance cardiaque aiguë ;
- détérioration aiguë de la fonction rénale caractérisant la néphroangiosclérose maligne.
Épidémiologie
Une hypertension artérielle maligne peut émailler l’évolution d’une hypertension artérielle essentielle non diagnostiquée ou insuffisamment contrôlée (deux tiers des cas). Elle peut aussi être le mode de découverte d’une hypertension artérielle secondaire (un tiers des cas).
Physiopathologie
Signes cliniques
- généraux (asthénie) ;
- liés à la sévérité de l’hypertension artérielle (céphalées, phosphènes, acouphènes, vertiges, épistaxis) ;
- liés à la déshydratation extracellulaire (perte de poids, syndrome polyuro-polydipsique).
L’examen clinique doit rechercher des signes liés aux atteintes organiques :
- cardiaques : dyspnée, angor ;
- neurologiques :
. signes d’accident vasculaire cérébral, souvent hémorragique ;
- oculaires : flou visuel.
Biologie
- une anémie hémolytique mécanique avec schizocytes au frottis ;
- une protéinurie pouvant dépasser 3 g/L ;
- une hypokaliémie ;
- une rénine et une aldostérone plasmatiques très élevées (non dosées en pratique).
Ponction-biopsie rénale
Les lésions siègent principalement au niveau des artérioles et comprennent :
- une obstruction totale ou partielle de la lumière des vaisseaux par une prolifération myo-intimale (aspect en « bulbe d’oignon ») ;
- des lésions de nécrose fibrinoïde artériolaire typique ;
- des glomérules ischémiques ;
- des lésions de microangiopathie thrombotique ;
- une prolifération cellulaire avec obstruction de certains vaisseaux.
Traitement
Le traitement initial est intraveineux (en première intention labétalol ou nicardipine et nitroprussiate de sodium ou urapidil en seconde intention). Une réhydratation avec supplémentation en potassium prudente permet de compenser l’hypovolémie et l’hypokaliémie. Une fois la volémie restaurée, le traitement oral avec des bloqueurs du système rénine-angiotensine ou des bêtabloquants est très efficace pour bloquer l’hyperactivation du système rénine-angiotensine-aldostérone. Des doses initiales faibles doivent être utilisées car ces patients peuvent être très sensibles à ces agents pharmacologiques. Les diurétiques doivent être évités sauf en cas de décompensation cardiaque où ils deviennent parfois nécessaires.
Évolution
Au niveau néphrologique, la baisse initiale de la pression artérielle s’accompagne d’une augmentation initiale de la créatininémie pouvant rendre nécessaires des séances d’hémodialyse. À moyen terme, la fonction rénale s’améliore, mais une insuffisance rénale chronique persiste souvent.
Sténose de l’artère rénale
Épidémiologie et physiopathologie
La sténose de l’artère rénale athéromateuse est une complication athéromateuse touchant l’intima et la média de l’artère rénale. Dans 90 % des cas, la localisation de la sténose de l’artère rénale athéromateuse touche l’ostium et le tiers proximal de l’artère rénale.
La sténose de l’artère rénale par fibrodysplasie touche 4 personnes sur 1 000, les femmes étant plus fréquemment atteintes (environ 4 femmes pour 1 homme). La fibrodysplasie est une anomalie de la paroi de certaines artères (à 85 % la média) qui peut entraîner des rétrécissements localisés du diamètre des artères atteintes (sténoses) et, plus rarement, des dilatations (anévrismes) ou une déchirure de la paroi (dissection artérielle). La maladie atteint principalement les artères rénales et du cou (artères carotides et artères vertébrales). Elle atteint plus rarement les artères digestives, les artères des membres inférieurs et les artères intracrâniennes. Elle atteint exceptionnellement les coronaires. Son étiologie est inconnue. Elle est congénitale et le plus souvent non héréditaire.
Diagnostic
Terrain
Sténose de l’artère rénale athéromateuse :- âge supérieur à 50 ans ;
- facteurs de risque cardiovasculaire (hypertension artérielle, diabète, tabagisme, dyslipidémie) et autres atteintes athéromateuses (coronaires, carotides, aorte, iliaques, fémorales).
- âge inférieur à 40 ans, 4 femmes pour 1 homme ;
- hypertension artérielle isolée ;
- pas ou peu de facteurs de risque cardiovasculaire.
Signes cliniques
Les sténoses de l’artère rénale sont fréquemment asymptomatiques.Les manifestations suivantes sont possibles :
- hypertension artérielle d’apparition récente, brutale, sévère ou résistante à une trithérapie ;
- souffle vasculaire para-ombilical (inconstant) ;
- asymétrie de taille rénale (petit rein du côté de la sténose) ;
- œdème pulmonaire flash (détresse respiratoire d’apparition brutale liée à un œdème pulmonaire hémodynamique) ;
- dégradation de la fonction rénale sous inhibiteurs de l’enzyme de conversion (IEC) ou antagonistes des récepteurs de type 1 de l’angiotensine II (ARA2) ;
- insuffisance rénale chronique ;
- plus rarement, hypokaliémie, voire alcalose métabolique (conséquences de l’hyperaldostéronisme secondaire).
Examens complémentaires diagnostiques
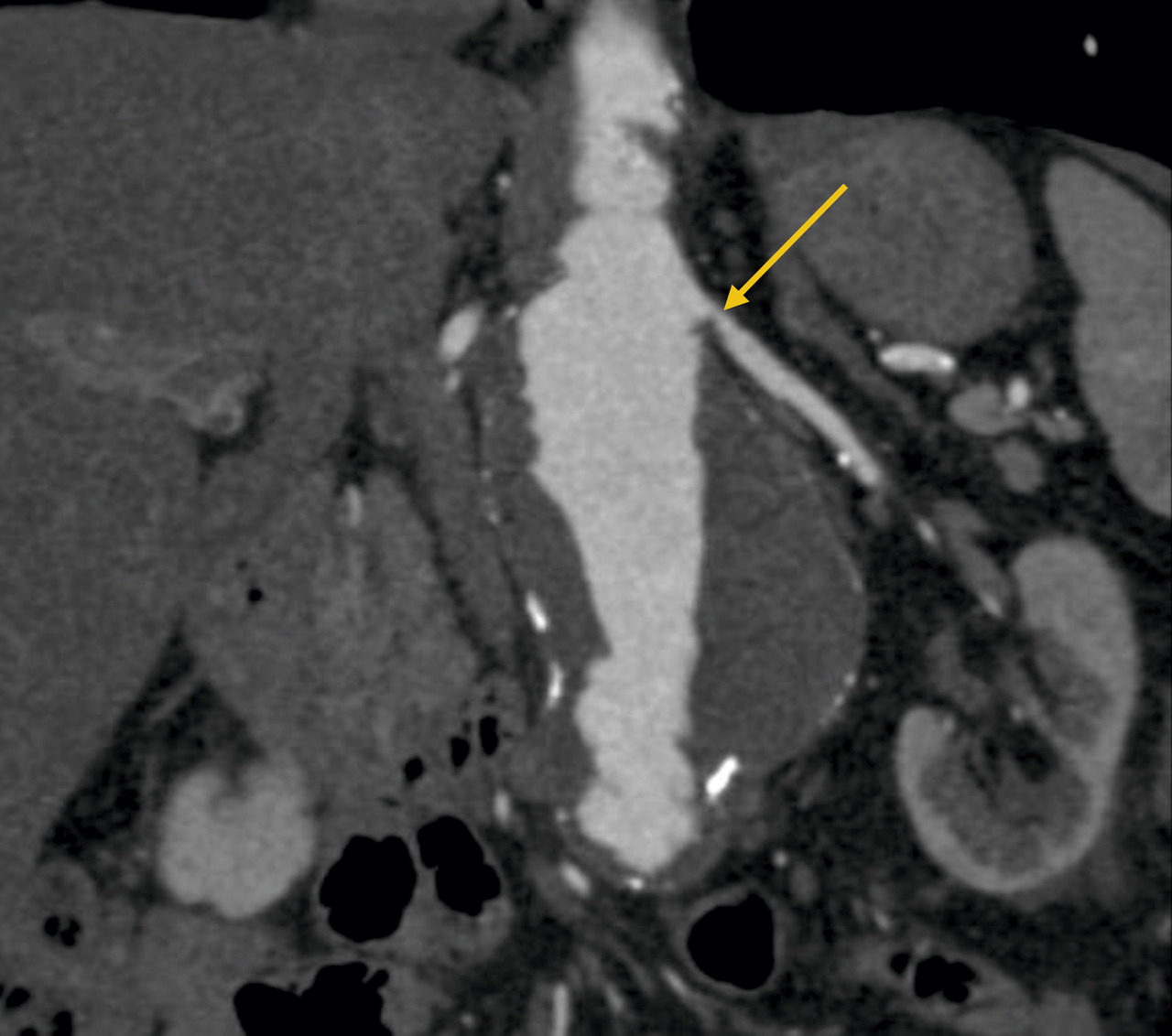
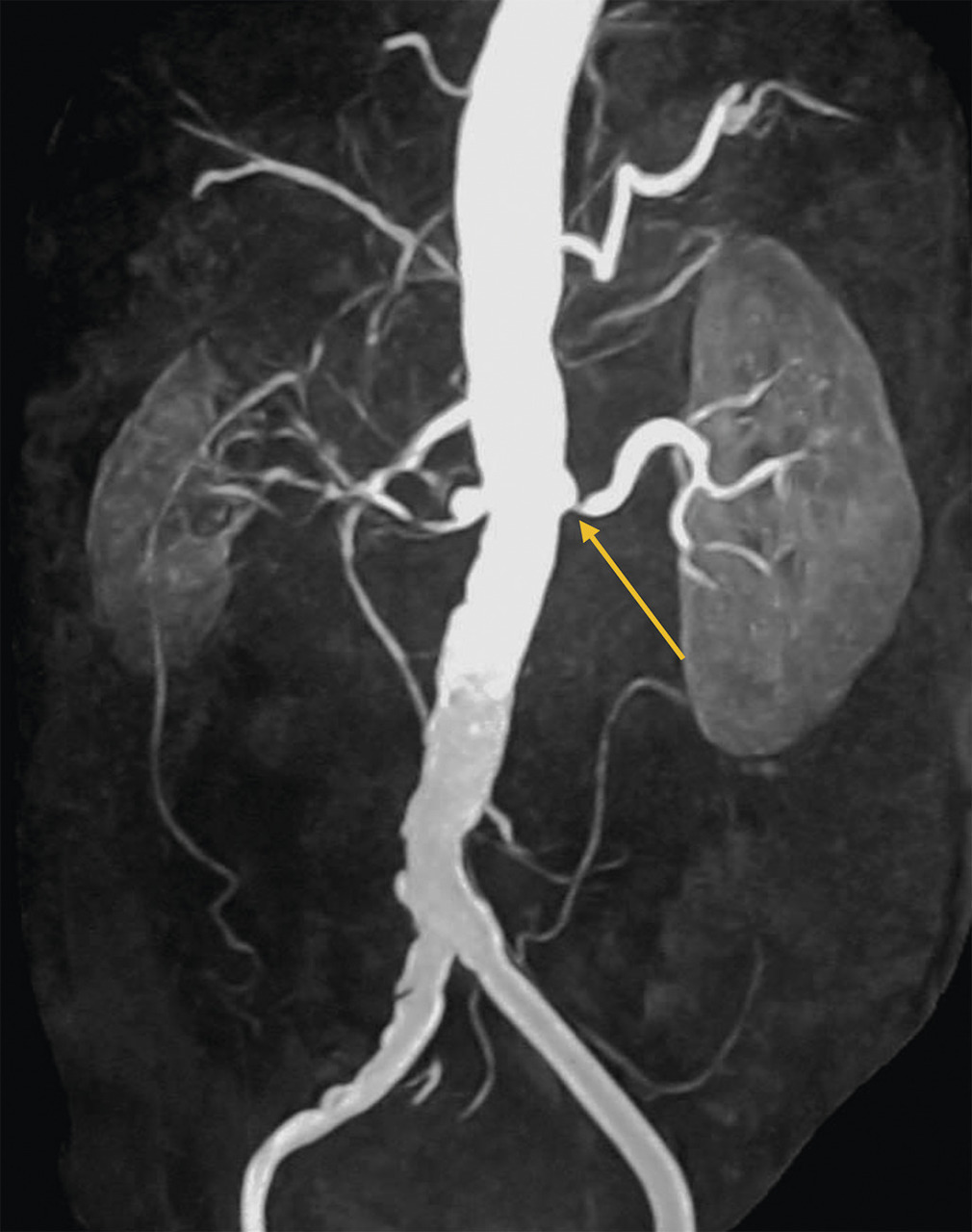
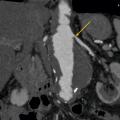
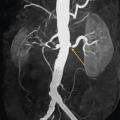
L’échographie-Doppler, l’angio-tomodensitométrie (angio-TDM [Le
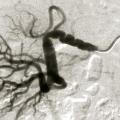
Dans la sténose de l'artère rénale athéromateuse, on retrouve une plaque habituellement unique, plus une moins calcifiée, ostiale, proximale ou tronculaire, responsable d’une réduction du diamètre endoluminal d’une ou des artères rénales (
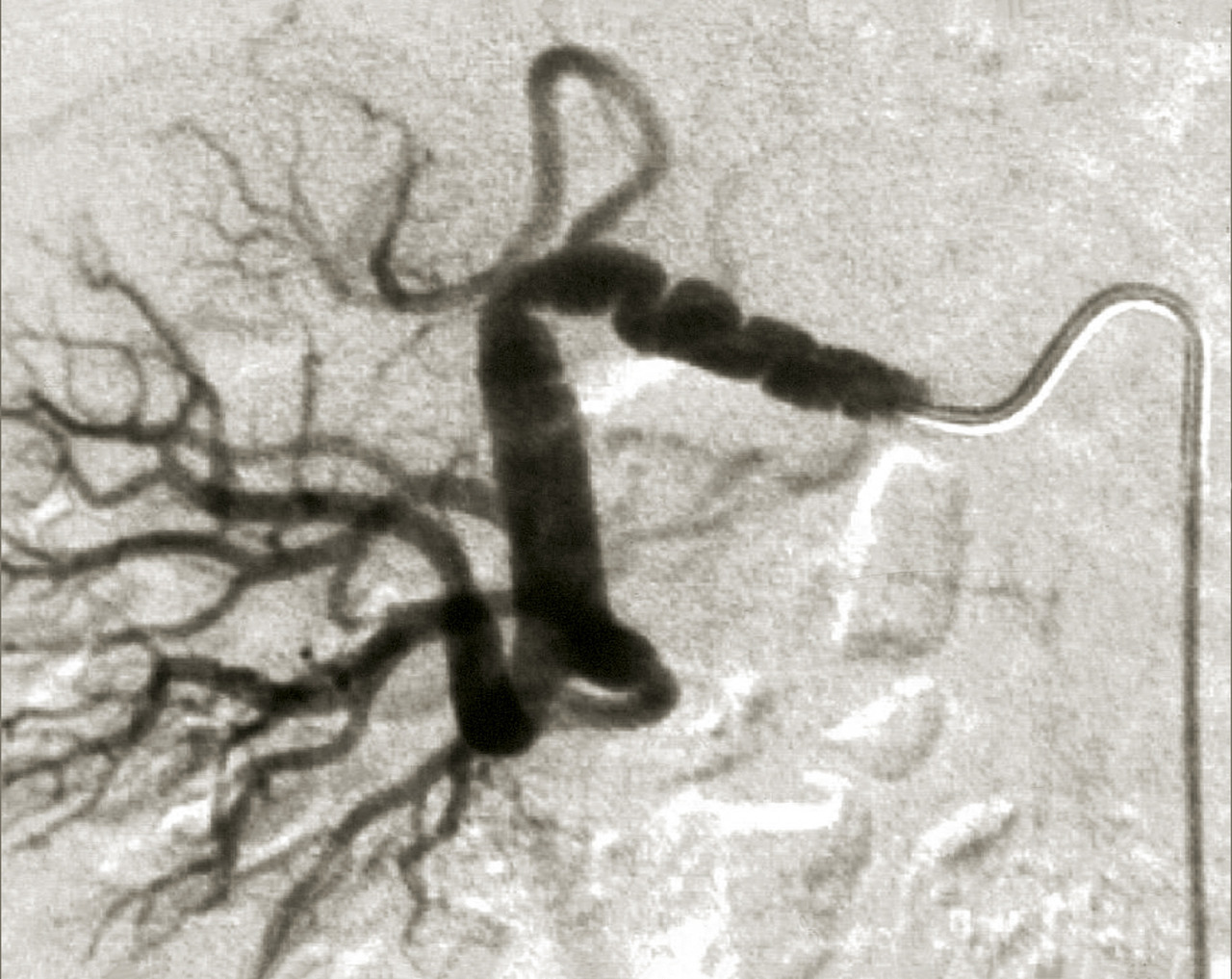
En cas de fibrodysplasie, les lésions sont multiples, distales, souvent bilatérales, avec aspect en « collier de perles » (
Prise en charge thérapeutique
Buts du traitement
L’évolution naturelle de la sténose de l'artère rénale conduit à une ischémie rénale progressive responsable d’une hypotrophie rénale, avec quelquefois une occlusion complète secondaire à une thrombose de l’artère.Les buts de la prise en charge thérapeutique sont de :
- normaliser la pression artérielle ;
- préserver la fonction rénale ;
- prendre en charge le risque cardiovasculaire et les atteintes extrarénales.
Options thérapeutiques
Le traitement médical est à base de :- bloqueurs du système rénine-angiotensine (en surveillant la tolérance fonctionnelle rénale) pour lutter contre l’hypertension artérielle. Une association d’antihypertenseurs est souvent nécessaire pour atteindre les objectifs tensionnels ;
- statine pour lutter contre l’hypercholestérolémie ;
- antiagrégant plaquettaire en prévention de la thrombose.
- un bénéfice qui est débattu dans la sténose athéromateuse, en dehors des rares situations d’œdèmes aigus du poumon (OAP) flashs ;
- de fortes chances de normaliser la pression artérielle dans la SAR par fibrodysplasie. Les récidives sont moins fréquentes que dans la sténose athéromateuse ;
- des complications : dissection de l’artère rénale, emboles de cholestérol (SAR athéromateuse), occlusion de l’artère rénale et infarctus rénal, récidive.
Microangiopathies thrombotiques
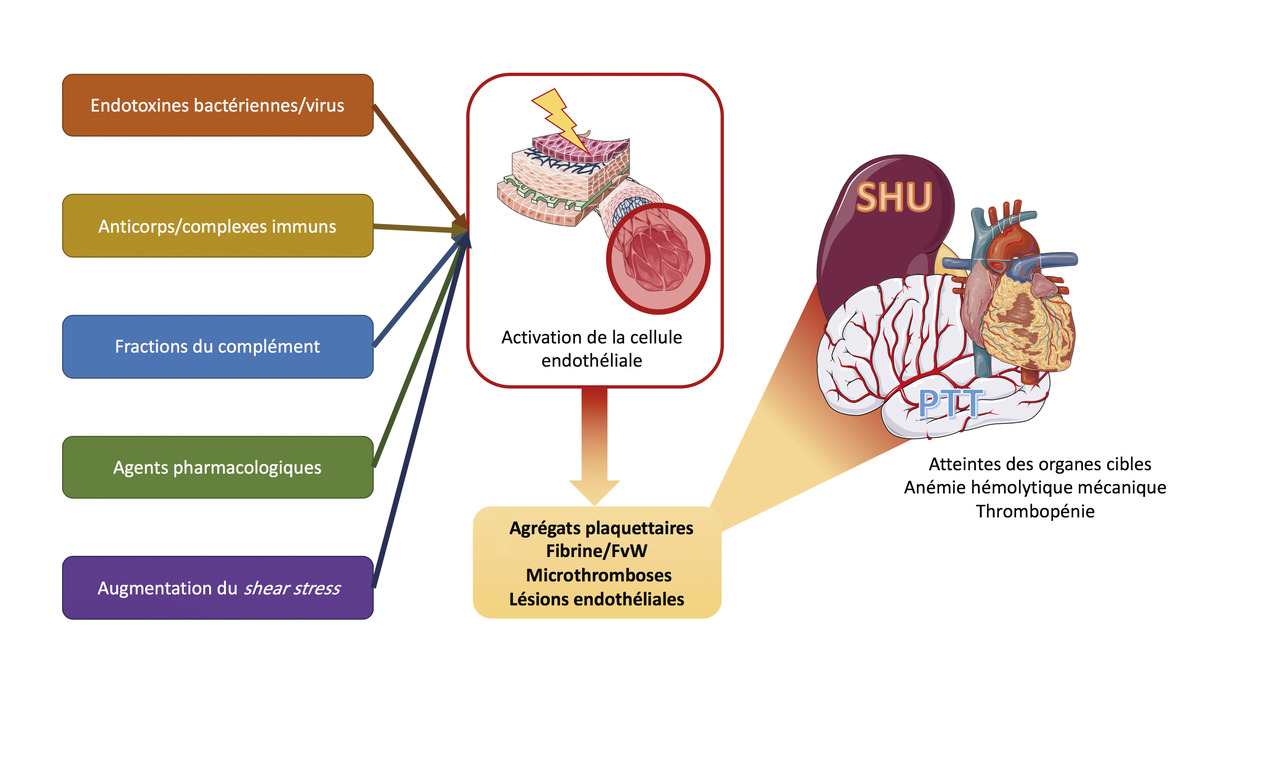
Généralités
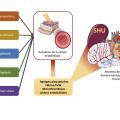
Les causes sont multiples et impliquent une agression endothéliale qui entraîne l’activation de la cellule endothéliale et la formation de micro-thrombi dans les capillaires.
L’agression endothéliale peut être provoquée par :
- des toxines bactériennes ;
- des anticorps ou des complexes immuns ;
- une activation inappropriée du complément ;
- des agents pharmacologiques ;
- l’augmentation des forces de cisaillement au niveau endothélial (shear stress) [
fig. 5 ].
Le syndrome hémolytique et urémique (SHU) : atteinte rénale prédominante avec hypertension artérielle, hématurie et protéinurie glomérulaire. Trois formes existent, qui se distinguent selon leur étiologie : typique, atypique et secondaire.
Le purpura thrombotique thrombocytopénique (PTT) : atteinte neurologique au premier plan (encéphalopathie, déficit, coma) et thrombopénie parfois très profonde. L’atteinte rénale y est souvent modérée, voire absente. Cette forme touche plutôt les adultes.
La lésion histologique de micro-angiopathie thrombotique est une occlusion de la lumière artériolaire et des capillaires par des thrombi fibrineux. Au niveau glomérulaire, l’endothélium peut présenter des doubles contours avec une mésangiolyse et une obstruction segmentaire par ces microthrombi.
Syndrome hémolytique et urémique typique
Définition
Il s’agit de la forme majoritaire des SHU de l’enfant, et elle constitue la première cause d’insuffisance rénale aiguë avant l’âge de 3 ans. L’agression endothéliale est causée par des toxines (shiga-like toxins ou SLT) produites par des entérobactéries (Escherichia coli, Salmonella, Shigella, Yersinia…). La bactérie le plus souvent en cause est la souche O157:H7 d’E. coli. Il s’agit d’une toxi-infection alimentaire à déclaration obligatoire chez l’enfant.Diagnostic
La présentation clinique débute par un syndrome dysentérique : diarrhée sanglante fébrile d’installation brutale. Une hypertension artérielle sévère et une insuffisance rénale aiguë souvent d’emblée anurique s’y associent. Le contexte estival ainsi que le groupement de cas en épidémies sont très évocateurs du diagnostic. La ponction-biopsie rénale est rarement réalisée, puisqu’elle est inutile au diagnostic quand le contexte est typique, et dangereuse dans le contexte de thrombopénie.Le diagnostic repose sur le tableau clinico-biologique. La coproculture ou l’écouvillonnage rectal ne retrouvent que rarement la bactérie en cause. Seule la PCR (polymerase chain reaction) permet de retrouver le gène codant pour la toxine dans les selles.
Traitement
Le traitement est essentiellement symptomatique (dialyse, contrôle de l’hypertension…). La prescription d’antibiotiques n’est pas recommandée en l’absence de signes de sepsis sévère ou de choc septique. L’évolution est le plus souvent spontanément favorable, avec un bon pronostic rénal à long terme.Syndrome hémolytique et urémique atypique
Définition
Il s’agit d’une cause rare de microangiopathie thrombotique, plutôt retrouvée chez l’adulte. On ne retrouve pas, contrairement au SHU typique, de notion d’épisode diarrhéique. La cause se situe le plus souvent dans une anomalie de la voie alterne du complément. Cette anomalie cible les protéines régulatrices de son activation et est causée soit par des mutations génétiques (familiales ou sporadiques), soit par des anticorps spécifiques dirigés contre ces protéines.Diagnostic
Le diagnostic est évoqué devant un syndrome biologique de MAT associé à une hypertension artérielle sévère et une insuffisance rénale de gravité variable, en l’absence d’argument pour un syndrome hémolytique et urémique secondaire.Le dosage des fractions circulantes du complément retrouve souvent un C3 bas voire effondré de façon isolée.
Le diagnostic de certitude est apporté par la biopsie rénale, qui retrouve des microthrombi, et par l’identification de l’anomalie de la voie alterne : mutation d’un des gènes codant pour une protéine régulatrice du complément (C3 du complément, facteur H, facteur I, CD46), mutation du gène de la thrombomoduline, ou anticorps anti-facteur H.
Traitement
Le traitement, longtemps fondé sur les échanges plasmatiques, repose aujourd’hui sur la prescription d’un anticorps anti-C5 convertase : l’éculizumab.Syndrome hémolytique et urémique secondaire
- médicaments : ciclosporine, tacrolimus, gemcitabine, mitomycine C ;
- infections : septicémie, virus de l’immunodéficience humaine (VIH) ;
- hypertension artérielle maligne ;
- éclampsie ;
- cancers ;
- maladies dysimmunitaires : lupus, syndrome des antiphospholipides, sclérodermie.
Purpura thrombotique thrombocytopénique
Cliniquement, les troubles neurologiques plus ou moins graves (encéphalopathie avec obnubilation et confusion, déficits sensitivomoteurs, voire coma) associés à un purpura sont au premier plan.
Biologiquement, la thrombopénie isolée est sévère et l’insuffisance rénale variable.
Le traitement comporte des échanges plasmatiques avec apport de plasma frais contenant de l’ADAMTS-13. Dans les formes acquises, une biothérapie à visée antiproductrice des anticorps de type anticorps anti-CD20 (rituximab) peut être associée.
Maladie des emboles de cristaux de cholestérol
Définition
Diagnostic
Facteurs déclenchants
Un geste endovasculaire artériel en amont des artères rénales est le plus souvent responsable de la rupture de la plaque. Parfois, la rupture de plaque est secondaire à la simple introduction d’anticoagulants ou de thrombolytiques.Clinique
Elle associe, après un temps de latence d’une dizaine de jours en moyenne (jusqu’à plusieurs semaines) :- une insuffisance rénale aiguë vasculaire ;
- des signes cutanés périphériques (orteils pourpres ou blue-toe syndrome, livedo à limite nette, gangrène distale),
- des signes d’atteinte d’autres territoires artériels (ischémie mésentérique, tableau neurologique d’accident vasculaire cérébral ou d’accident ischémique transitoire [AIT], troubles visuels…).
Biologie
Outre l’insuffisance rénale aiguë, on peut retrouver, de façon fugace et précoce :- un syndrome inflammatoire biologique ;
- une hyperéosinophilie sanguine ;
- une hyperéosinophilurie ;
- une hypocomplémentémie.
Examens complémentaires
Les principaux diagnostics différentiels doivent être éliminés : néphropathie immuno-allergique aux antagonistes de la vitamine K (AVK), vascularite des artères de petit calibre, néphropathie aux produits de contraste iodés.En cas de doute diagnostique persistant, la certitude est apportée par la visualisation au fond d’œil d’emboles dans les vaisseaux rétiniens (plaque d’Hollenhorst) et l’identification sur la biopsie d’un territoire atteint (peau, rein) d’occlusions artériolaires et capillaires par des cristaux de cholestérol.
Traitement
La mortalité reste élevée, avec plus de 40 % de décès à 6 mois.•
POINTS FORTS À RETENIR
La néphroangiosclérose bénigne est un diagnostic d’exclusion, elle représente l’atteinte de l’hypertension artérielle sur la microcirculation rénale. En raison de la prévalence de l’hypertension artérielle, elle était en 2016 la première cause d’insuffisance rénale terminale en France (24,4 %).
La néphroangiosclérose maligne est une complication de l’hypertension artérielle maligne et représente une urgence thérapeutique. Le traitement repose sur des vasodilatateurs par voie intraveineuse pour obtenir une baisse de la pression artérielle de 20 à 25 % en quelques heures et la restauration de la volémie.
Les sténoses de l’artère rénale sont le plus souvent d’origine athéromateuse (90 %) et représentent le plus souvent une conséquence athéromateuse de l’hypertension artérielle et des autres facteurs de risque cardiovasculaire.
Les microangiopathies thrombotiques associent constamment une thrombopénie et une anémie hémolytique mécanique à une atteinte d’organe cible (rein, cœur, foie, cerveau). Le traitement des microangiopathies thrombotiques est fonction de l’origine de la dysfonction endothéliale associé à un traitement symptomatique.
La maladie des emboles de cholestérol constitue une insuffisance rénale vasculaire apparaissant quelques jours à quelques semaines après une procédure endovasculaire artérielle sur un terrain athéromateux. Le traitement est surtout symptomatique et le pronostic rénal est sombre.
Néphropathie vasculaire
L’item est vaste par les pathologies qu’il englobe, mais son utilisation dans les cas cliniques est limitée par le fait que les objectifs de l’ECNI ne demandent pas explicitement aux étudiants de maîtriser la prise en charge thérapeutique des néphropathies vasculaires.
Les pathologies aiguës (microangiopathie thrombotique, néphroangiosclérose maligne, maladie des emboles de cristaux de cholestérol) semblent plus intéressantes à placer dans des cas cliniques que la néphroangiosclérose bénigne et la sténose d’artère rénale.
La néphroangiosclérose bénigne peut être évoquée (peu de chances qu’elle fasse l’objet d’un dossier complet) dans une question au sein d’un dossier d’hypertension artérielle. La sténose d’artère rénale pourrait éventuellement être abordée sur le plan diagnostique avec une interprétation d’imagerie injectée. Pour les microangiopathies thrombotiques, le syndrome hémolytique et urémique typique a plus de probabilité d’être utilisé car les connexions avec la déclaration des toxi-infections alimentaires et la pédiatrie sont multiples. Les autres atteintes (syndrome hémolytique et urémique atypique ou secondaire, PTT) restent plus difficiles et spécialisées. La néphro-angiosclérose maligne peut s’intégrer dans un dossier d’hypertension artérielle secondaire. Les emboles de cristaux de cholestérol peuvent constituer un cas transversal associant une pathologie nécessitant un geste endovasculaire (AOMI, infarctus du myocarde) puis débouchant sur l’insuffisance rénale terminale. Il faut donc y penser devant un cas clinique associant un geste endovasculaire et une IRA.

 Encadrés
Encadrés