10 % de patients éligibles, avec une amélioration de 50 % du score moteur, pas d’effet sur les troubles axiaux.
Par Stéphane Palfi*
La maladie de Parkinson (MP) a été longtemps considérée comme essentiellement motrice, caractérisée par une rigidité, une akinésie, un tremblement, des troubles de la posture, de l’équilibre ou de la marche. Elle est en réalité à l’origine d’une multitude de symptômes non moteurs (troubles du sommeil, manifes-tations psychiatriques, douleurs, déficit cognitif et perturbations neurovégétatives). La majorité des symptômes, notamment moteurs, signent la mort lente et progressive des neurones de la substance noire, responsable d’une dénervation dopaminergique du striatum (cible des axones) et de la triade : akinésie, hypertonie plastique et tremblements.
Les troubles s’étendent progressivement, avec les dépôts toxiques d’α-synucléine (composante principale des corps de Lewy et marqueur de la MP) dans les systèmes nerveux périphérique et entérique ainsi que dans d’autres circuits (sérotoninergiques, noradrénergiques et cholinergiques). Aux phases les plus avancées, les aires corticales sont également affectées, contribuant à l’aggravation des troubles cognitifs.1
Avant et après la L-dopa
Les premières interventions, au début du XIXe siècle, ont été imaginées à partir d’effets indésirables neurochirurgicaux. Elles consistaient à détruire le cortex moteur ou le noyau caudé, le putamen et la capsule interne. Le succès était variable sur le tremblement, médiocre sur la rigidité, toujours au prix d’une mortalité et d’une morbidité importantes.
La stéréotaxie (repérage externe tridimensionnel des structures cérébrales), associée à une meilleure connaissance des ganglions de la base, a permis des destructions thérapeutiques plus précises au cours des années 50. Mais c’est le traitement substitutif par la L-dopa et les agonistes dopaminergiques (dans les années 60-70) qui a permis la réduction spectaculaire des signes moteurs et conduit à l’abandon rapide de la chirurgie du thalamus et du globus pallidus (GPi). La prescription prolongée (10-12 ans) étant grevée, chez plus de 50 % des patients, d’effets indésirables sévères (fluctuations motrices et dyskinésies), les options chirurgicales ont retrouvé de l’intérêt : en particulier la modulation neuronale électrique, non lésionnelle et réversible. Cette technique, inventée par une équipe française,2 s’est développée ces 2 dernières décennies sous son impulsion.
Moduler certaines cibles cérébrales
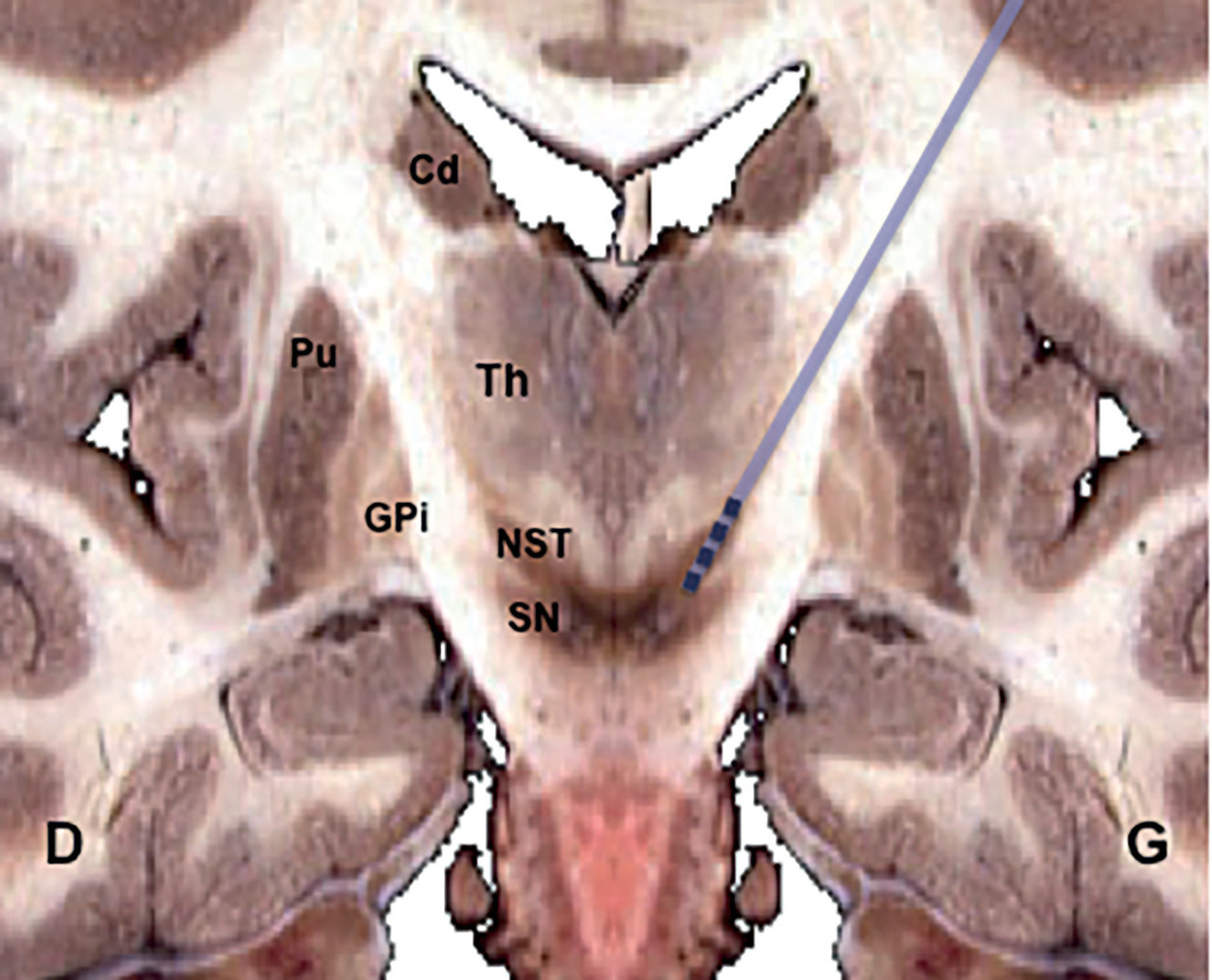
Des études expérimentales chez l’animal ont démontré qu’il était possible « d’exclure » le pallidum interne et certaines zones thalamiques par inhibition électrique à haute fréquence. Dans cette région, selon des essais chez les primates,3 le noyau sous-thalamique (NST) avait déjà paru une cible intéressante pour lutter contre les symptômes moteurs. Cependant, sa lésion définitive provoquant des effets secondaires impressionnants (hémiballisme), il avait été mis de côté. Son retour dans les cibles neurochirurgicales s’est fait grâce à la modulation neuronale réversible (
La méthode appliquée à la MP comporte l’implantation de deux électrodes profondes, une par hémisphère, reliées à un stimulateur placé sous la peau du thorax (comme d’autres pacemakers) ou parfois du ventre. La stimulation qui module l’activité des circuits moteurs exige un réglage très fin chez chaque patient. Une dizaine de jours d’hospitalisation sont nécessaires pour programmer le matériel et ajuster les doses de L-dopa. La période d’adaptation et de suivi rapprochés dure de 3 à 6 mois.
Indications choisies
Le succès de la neuromodulation du NST et du GPI tient essentiellement à une sélection rigoureuse des patients par une équipe pluridisciplinaire. Pour espérer un bénéfice significatif sur les fluctuations motrices et les dyskinésies induites par la L-dopa, le malade doit garder une très grande sensibilité à ce médicament : c’est-à-dire obtenir un résultat clinique supérieur à 50 % d’amélioration au test pharmacologique. Il faut aussi que ses fonctions cognitives soient encore préservées (encadré). La stimulation cérébrale est un traitement chronique, son efficacité peut se maintenir au moins 5 ans après modulation selon la progression des symptômes. Le bénéfice clinique diminue avec le temps, sans jamais devenir nul, en raison de l’apparition ou de l’aggravation d’autres symptômes de la MP insensibles à la stimulation.
Avec les restrictions instituées par la HAS,4 environ 10 % des parkinsoniens y sont éligibles. Dans certains cas, les corrections motrices et (parfois) non motrices peuvent persister plus de 10 ans après l’implan- tation.
Si les critères de sélection sont bien respectés, les résultats sont spectaculaires avec une amélioration de 40 à 65 % du score moteur de l’échelle UPRDS (Unified Parkinson Disease Rating Scale), et une réduction concomitante d’environ 50 % du traitement dopaminergique.5, 6, 7
Cependant, les troubles axiaux de la MP (langage, marche, équilibre) ne sont pas ou peu améliorés par la neuromodulation, quelle que soit la cible (STN, GPI ou thalamus). En revanche, celle-ci permet de mieux équilibrer le traitement, en réglant indépendamment les paramètres électriques des électrodes droite et gauche, pour rectifier l’asymétrie spontanée de la maladie. L’implantation a aussi l’avantage d’adapter la modulation thérapeutique à la progression inéluctable de la maladie.
Les effets indésirables sévères existent mais ils sont aujourd’hui plus rares, surtout au décours de l’implantation : hématome symptomatique (estimé à moins de 0,5 %) infection du matériel (entre 1 et 2 % selon les centres). Ils sont aussi liés au placement imparfait des électrodes ou bien aux caractéristiques de la MP, expliquant une aggravation possible d’une dysarthrie ou de troubles de la marche préexistants.
Du fait des fluctuations cliniques et de la finesse de la méthode, il est indispensable qu’une équipe experte en réglages de la stimulation cérébrale accompagne au long cours les médecins et neurologues traitants pour assurer le meilleur suivi.
Étapes ultérieures
La neuromodulation électrique cérébrale ne constitue qu’une phase du traitement, en complément de l’option médicale. Des zones d’ombre persistent quant à ses mécanismes d’action. C’est là que se portent les efforts des cliniciens et des fondamentalistes pour optimiser les méthodes actuelles et éventuellement élaborer d’autres applications.
Des électrodes dites « directionnelles » limitent le champ de stimulation aux zones motrices du NST. Elles constituent un progrès réel en diminuant les effets indésirables liés à un défaut de placement, même minime.
L’autorégulation de la stimulation en fonction des symptômes moteurs est une autre piste, majeure, d’amélioration des résultats. En effet, la détection et la correction de signaux électriques anormaux observés dans la MP permettent d’envisager une adaptation à la carte de la stimulation. C’est le cas des oscillations dites « bêta » (désynchronisées) enregistrées dans le NST : le stimulateur peut être programmé pour répondre en temps réel à leur apparition et les corriger en envoyant les impulsions adaptées (données encore expérimentales).
L’auteur déclare participer ou avoir participé à des interventions ponctuelles pour Medtronic et Boston Scientific et avoir été pris en charge lors de congrès par ces mêmes entreprises.
MP évolutive depuis plusieurs années
Grand tremblement non contrôlé représentant l’essentiel de la symptomatologie
Ou fluctuations motrices majeures avec blocages prolongés et/ou dyskinésies sévères
Bonne sensibilité à la L-dopa (tremblement excepté)
Sans détérioration cognitive ni troubles psychiatriques non contrôlés
Pas de contre-indications à la chirurgie et à l’anesthésie générale
Absence de séquelles d’AVC, malformations vasculaires ou atrophie cérébrale majeure
➜ Traitement symptomatique pour 10 % des patients atteints d’une maladie de Parkinson invalidante, après épuisement de l’effet de la L-dopa.
➜ Efficacité durable (au mieux 10 ans).
➜ Critères de sélection drastiques pour une réponse optimale, dont la conservation de la sensibilité à la L-dopa et des fonctions cognitives.
➜ Effets indésirables sévères mais de plus en plus rares.
Critères de sélection selon la HAS
MP évolutive depuis plusieurs années
Grand tremblement non contrôlé représentant l’essentiel de la symptomatologie
Ou fluctuations motrices majeures avec blocages prolongés et/ou dyskinésies sévères
Bonne sensibilité à la L-dopa (tremblement excepté)
Sans détérioration cognitive ni troubles psychiatriques non contrôlés
Pas de contre-indications à la chirurgie et à l’anesthésie générale
Absence de séquelles d’AVC, malformations vasculaires ou atrophie cérébrale majeure
1. Braak H. Del Tredici K. Neuropathological Staging of Brain Pathology in Sporadic Parkinson’s disease: Separating the Wheat from the Chaff. J Parkinson Dis 2017;7(S1):S73-S87.
2. Benabid AL, Pollak P, Louveau A, Henry S, de Rougemont J. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neuro- physiol 1987;50:344-6.
3. Benazzouz A, Gross C, Féger J, Boraud T, Bioulac B. Reversal of rigidity and improvement in motor performance by subthalamic high-frequency stimulation in MPTP-treated monkeys. Eur J Neuro-sci 1993;5:382-9.
4. HAS. Maladie de Parkinson. Guide du parcours de soins. Septembre 2016. www.has-sante.fr.
5. Limousin P, Krack P, Pollak P, Benazzouz A, Ardouin C, Hoffmann D, et al. Electrical stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med 1998;339:1105-11.
6. Karachi C, Fernandez-Vidal S, Golmard JL, Karachi C, Fernandez-Vidal S, Golmard JL, et al. Optimal target localization for subthalamic stimulation in patients with Parkinson disease. Neurology 2014;82:1352-61.
7. Senova S, Hosomi K, Gurruchaga JM, Gouello G, Ouerhefani N, Beaugendre Y, et al. Three-dimensional SPACE fluid-attenuated inversion recovery at 3 T to improve subthalamic nucleus lead placement for deep brain stimulation in Parkinson’s disease: from preclinical to clinical studies. J Neurosurg 2016;125:472-80.

 Encadrés
Encadrés