Le PNN est une cellule phagocytaire, actrice principale de l’immunité innée. Les déficits quantitatifs et qualitatifs des PNN se manifestent donc par un accroissement du risque infectieux bactérien et fongique.
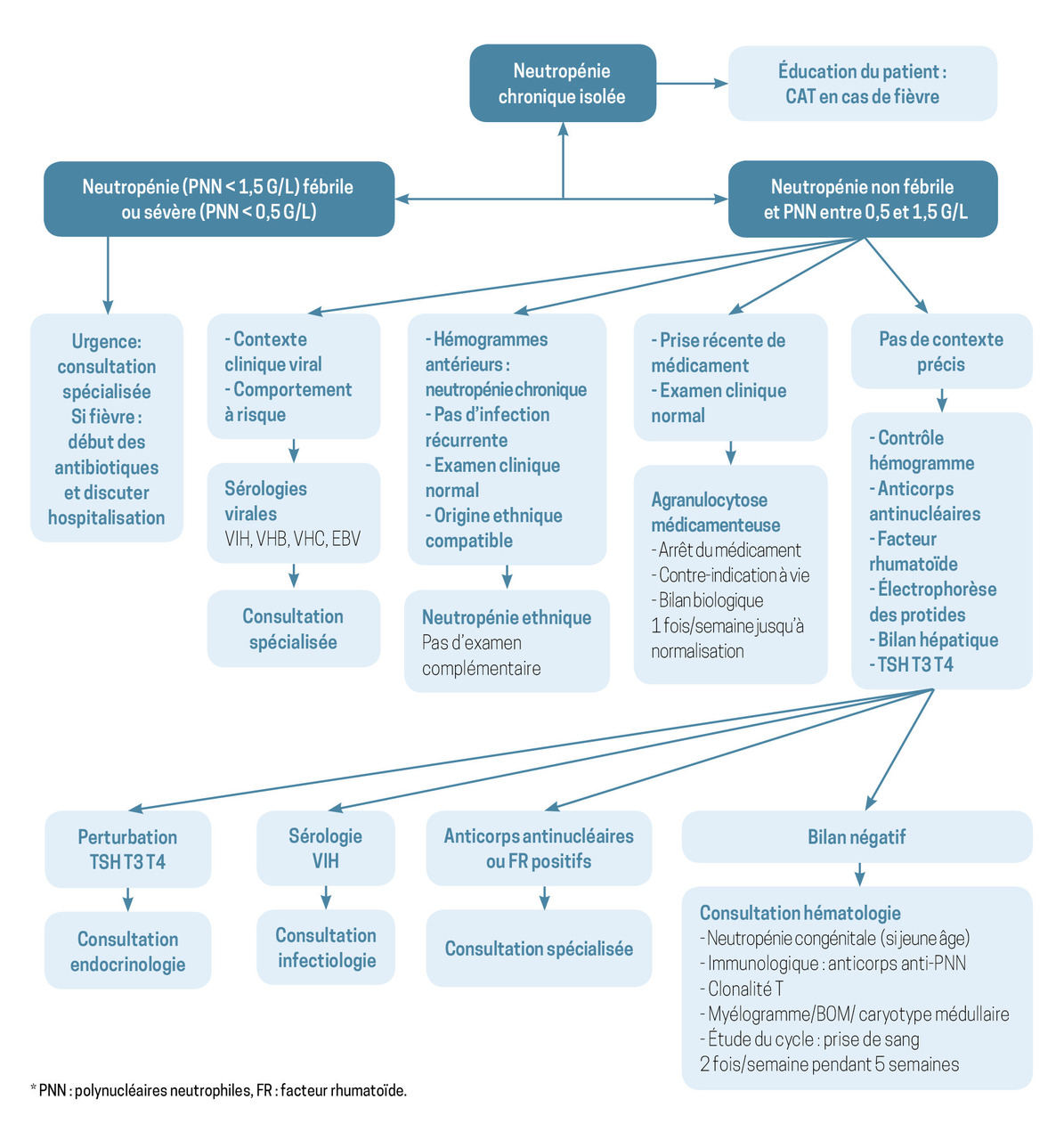
Orientation diagnostique et urgence face à une neutropénie
– le caractère isolé ou non de la neutropénie : une bicytopénie ou une pancytopénie nécessitent obligatoirement un avis spécialisé ;
– la profondeur de la neutropénie (risque infectieux modéré si les PNN sont compris entre 1 et 1,5 G/L ; risque infectieux important si les PNN sont inférieurs à 1 G/L ; risque infectieux majeur si les PNN sont inférieurs à 0,5 G/L) ;
– le caractère aigu ou chronique : les neutropénies chroniques sont définies comme persistantes depuis plus de trois mois ;
– la présence de signes d’infections associées.
Les infections associées aux neutropénies sont principalement ORL, pulmonaires et cutanéomuqueuses.
En cas de fièvre associée à la neutropénie, l’urgence absolue est de débuter au plus vite une antibiothérapie à large spectre ciblant les bacilles Gram négatif (bêtalactamines +/- quinolones est l’association la plus souvent recommandée). En cas de signes de mauvaise tolérance, le patient doit immédiatement être adressé en milieu hospitalier pour l’administration d’une antibiothérapie intraveineuse et une surveillance rapprochée.
Neutropénies aiguës isolées
Agranulocytose médicamenteuse
Par principe, tout médicament, surtout s’il a été introduit récemment, doit être suspecté. L’enquête médicamenteuse est donc primordiale. Les critères d’imputabilité sont établis par les centres de pharmacovigilance, auprès de qui ces accidents doivent être déclarés.
Les médicaments les plus fréquemment incriminés sont cités dans l’
Il existe deux mécanismes principaux d’agranulocytose médicamenteuse :
– le mécanisme toxique : il s’agit d’une toxicité directe du médicament. Elle est dépendante de la dose (toxicité cumulative) et ne nécessite pas de sensibilisation antérieure à la molécule. Son apparition est souvent progressive ;
– le mécanisme immunologique : il s’agit d’une toxicité indirecte avec formation d’un complexe immunologique anticorps-antigène (médicament) à la surface de la cellule (PNN ou précurseurs granuleux) entraînant sa destruction. Elle nécessite une exposition antérieure au médicament ou une exposition prolongée (plus de 8 jours). La neutropénie s’installe brutalement et est indépendante de la dose du médicament.
En réalité, ces deux mécanismes sont souvent intriqués.
Une déclaration de l’agranulocytose doit être faite au centre de pharmacovigilance, et le patient doit être informé clairement de la contre-indication à vie du traitement responsable.
Neutropénies de cause infectieuse
Les infections en cause sont virales (VIH, VHB, VHC, rougeole, rubéole, varicelle, grippe, CMV, herpès, mononucléose infectieuse qui peut s’accompagner d’une neutropénie et d’une hyperlymphocytose basophile), bactériennes (typhoïde, brucellose, Listeria, Helicobacter pylori) et parasitaires (leishmaniose, paludisme).
Une neutropénie peut aussi s’observer lors d’un choc septique. Dans ce cas, le contexte est évident.
Neutropénies chroniques
Dans le cas des neutropénies chroniques, et en particulier des neutropénies immunologiques, le risque infectieux est plus rare et plus imprévisible. Ce risque semble mieux corrélé au nombre de PNN quand ceux-ci sont inférieurs à 0,5 G/L. En effet, au-dessus de 0,5 G/L, il n’existe plus de relation directe entre le nombre de PNN et la survenue d’infections.1
Neutropénies ethniques
Cette entité reste floue, mais quatre critères simples doivent être présents : neutropénie isolée modérée entre 0,5 et 1,5 G/L, absence d’infection imputable à la neutropénie, absence d’autres causes mises en évidence et origine ethnique compatible.
L’origine ethnique d’un patient ne doit cependant pas faire méconnaître une autre cause à la neutropénie. Celle-ci doit être obligatoirement explorée si les critères ci-dessus ne sont pas tous respectés.
Neutropénies congénitales
Les neutropénies cycliques sont principalement diagnostiquées dans l’enfance. Elles se caractérisent par la fluctuation régulière du nombre absolu de PNN. Ces variations répondent classiquement à des cycles de 21 jours (de 16 à 28 jours). Au nadir de la neutropénie, le patient peut avoir une hyperthermie, des aphtes, des douleurs abdominales et parfois des infections sévères. Ces symptômes durent en général quatre jours. La transmission est autosomique dominante et implique dans 90 % des cas le gène ELANE (ELA2). Plus de 50 mutations de ce gène ont été décrites.4
Neutropénies chroniques acquises
Auto-immunes
Les neutropénies acquises auto-immunes (NAI) se caractérisent par la présence d’anticorps, le plus souvent de type immunoglobulines G (IgG), dirigés contre les antigènes spécifiques du PNN. Ces autoanticorps agglutinent les PNN, qui sont ensuite phagocytés.5Auto-immunes primitives
Les neutropénies auto-immunes primitives sont l’apanage de l’enfant. Chez l’adulte, elles sont exceptionnelles. Elles se définissent par une neutropénie chronique et la présence d’un autoanticorps anti-PNN (anti-CD16 ou CD114), sans contexte immunologique clinique associé.
Auto-immunes secondaires à un syndrome lymphoprolifératif
Les leucémies à grands lymphocytes à grains (LGL) correspondent à un syndrome lymphoprolifératif chronique T ou NK, souvent associé à des pathologies dysimmunitaires ainsi qu’à des cytopénies. L’âge médian de diagnostic d’une leucémie LGL est de 60 ans, avec une prévalence identique entre les deux sexes. Les patients sont souvent symptomatiques avec, principalement, une splénomégalie et des infections récurrentes. Ce syndrome lymphoprolifératif s’associe, dans 15 % des cas, à une pathologie auto-immune, une polyarthrite rhumatoïde le plus souvent. Il s’accompagne d’une neutropénie, dans 60 % des cas, avec un nombre de PNN < 0,5 G/L, dans 25 % des cas.6
Des neutropénies immunes peuvent aussi s’observer dans le cadre de syndromes lymphoprolifératifs B comme la leucémie lymphoïde chronique, la maladie de Waldenström ou le lymphome de Hodgkin. Elles peuvent être isolées ou accompagner d’autres cytopénies auto-immunes, et survenir aussi bien pendant une phase active de la maladie qu’en période de rémission.
Auto-immunes secondaires à une pathologie dysimmunitaire
Les principales pathologies dysimmunitaires s’associant à une neutropénie chronique sont, par ordre de fréquence :
– la maladie de Gougerot-Sjögren ; il s’agit d’une pathologie auto-immune caractérisée par un syndrome sec oculaire et buccal. L’incidence de la neutropénie est de 12 %, dont 2 % de neutropénies sévères ;
– la polyarthrite rhumatoïde (PR) ; les neutropénies au cours de la PR sont souvent modérées et rarement inférieures à 0,5 G/L. Le syndrome de Felty (neutropénie associée à une splénomégalie) est devenu exceptionnel depuis l’avènement des traitements anti-TNF ;
– le lupus érythémateux disséminé ; cette maladie s’accompagne principalement de lymphopénie. L’apparition d’une neutropénie lupique < 1 G/L reste rare.
Allo-immunes
Chez l’adulte, les neutropénies allo-immunes sont plus rares que chez le nouveau-né (secondaires au passage transplacentaire d’anticorps maternels). Elles peuvent survenir dans les suites d’une transplantation ou d’une transfusion.Hémopathies
Diverses hémopathies malignes peuvent entraîner des neutropénies, souvent associées à d’autres cytopénies : myélodysplasie, myélofibrose, leucémie aiguë, envahissement médullaire (lymphopathie). Dans ce contexte, une analyse médullaire est indispensable.Endocrinopathies
L’hyperthyroïdie et l’hypothyroïdie, l’insuffisance surrénalienne, le panhypopituitarisme peuvent se compliquer d’une neutropénie. La correction de cette dernière est obtenue par le traitement spécifique de l’endocrinopathie.7Carences vitaminiques
Les carences vitaminiques en vitamine B12 et/ou en vitamine B9 peuvent se compliquer, en plus d’une anémie mégaloblastique, d’une neutropénie. Outre ces cytopénies, on note souvent des caractéristiques cliniques évocatrices de syndrome carentiel : fragilité des phanères (chute des cheveux, ongles cassants), fragilité des muqueuses (glossite, œsophagite).Anorexie mentale
Lors de l’anorexie mentale (mais aussi dans des contextes de dénutrition sévère), on peut observer des anomalies hématologiques modérées, à type d’anémie ou de leucopénie. Cela peut être dû à une transformation gélatineuse de la moelle osseuse (atrophie séreuse, ou moelle de déprivation). Le myélogramme montre alors une hypoplasie médullaire et une infiltration interstitielle par une substance gélatineuse amorphe formée de mucopolysaccharides acides.Traitement des neutropénies chroniques
Le traitement des neutropénies congénitales sévères repose sur le G-CSF ou la greffe de cellules souches hématopoïétiques : la prise en charge de ces patients nécessite donc un suivi dans un centre spécialisé.
Circonstance révélatrice
Agranulocytose médicamenteuse : les molécules les plus fréquemment incriminées
– Antibiotiques : amoxicilline, méropénème (Meronem), sulfamides (Bactrim), rifampicine (Rifadine), chloramphénicol, ceftriaxone (Rocephine), céfépime, vancomycine, pipéracilline-tazobactam (Tazocilline).
– Anti-inflammatoires non stéroïdiens (quels qu’ils soient).
– Anticonvulsivants : diazépam (Valium), carbamazépine (Tegretol).
– Cardiologiques : propranolol (Avlocardyl).
– Psychotropes : chlorpromazine (Largactil), clomipramine (Anafranil), clozapine (Leponex), carbamazépine (Tegretol).
– Endocrinologiques : carbimazole (Neo-Mercazole).
– Agents cytotoxiques, anticorps monoclonaux : fludarabine, rituximab, étanercept, et autres.
Que dire à vos patients ?
Lors de la découverte biologique d’une neutropénie, l’analyse du contexte clinique est primordiale. Cela conditionne le discours face au patient. Une neutropénie aiguë isolée sans infection associée doit faire, avant tout, rechercher une cause médicamenteuse. Si tel est le cas :
– rassurer le patient sur la réversibilité ;
– expliquer la contre-indication à vie du médicament incriminé ;
– expliquer la surveillance biologique nécessaire jusqu’à normalisation du taux de PNN.
En cas de neutropénie chronique, l’éducation du patient est primordiale. Il doit ainsi :
– disposer d’une ordonnance d’antibiothérapie à large spectre probabiliste ;
– savoir débuter le traitement en urgence en cas de fièvre.
2. Hsieh MM, Everhart JE, Byrd-Holt DD, et al. Prevalence of neutropenia in the U.S. population: age, sex, smoking status, and ethnic differences. Ann Intern Med 2007;146(7):486-92.
3. Donadieu J, Beaupain B, Fenneteau O, et al. Congenital neutropenia in the era of genomics: classification, diagnosis, and natural history. Br J Haematol 2017;179(4):557-74.
4. Dale DC, Makaryan V, et al. ELANE-Related Neutropenia. GeneReviews 2002 [mis à jour en 2018]. PMID : 20301705.
5. Autrel-Moignet A, Lamy T. Autoimmune neutropenia. Presse Med 2014;43(4):e105,18.
6. Lamy T, Moignet A, Loughran TP Jr. LGL leukemia: from pathogenesis to treatment. Blood 2017;129(9):1082-94.
7. Donadieu J. Recommandations pour le diagnostic et la prise en charge des patients ayant une neutropénie chronique. Centre de référence des déficits immunitaires héréditaires, 17 juin 2009. Disponible sur: https://bit.ly/3aR9vg2

 Encadrés
Encadrés