Signes
S’y associent souvent des sensations de corps étranger intrarectal ou intra-vaginal dites « sympathalgies ».
Classiquement, ces symptômes, quasiment inexistants le matin au réveil, augmentent en intensité tout au long de la journée ; ils ne réveillent pas le patient la nuit. Ils sont déclenchés ou aggravés par la position assise. Des troubles sensitifs ou sphinctériens associés doivent faire rechercher d’autres étiologies (syndrome de la queue de cheval ou processus compressif sur le trajet du nerf) et imposent une IRM lombo-pelvienne.
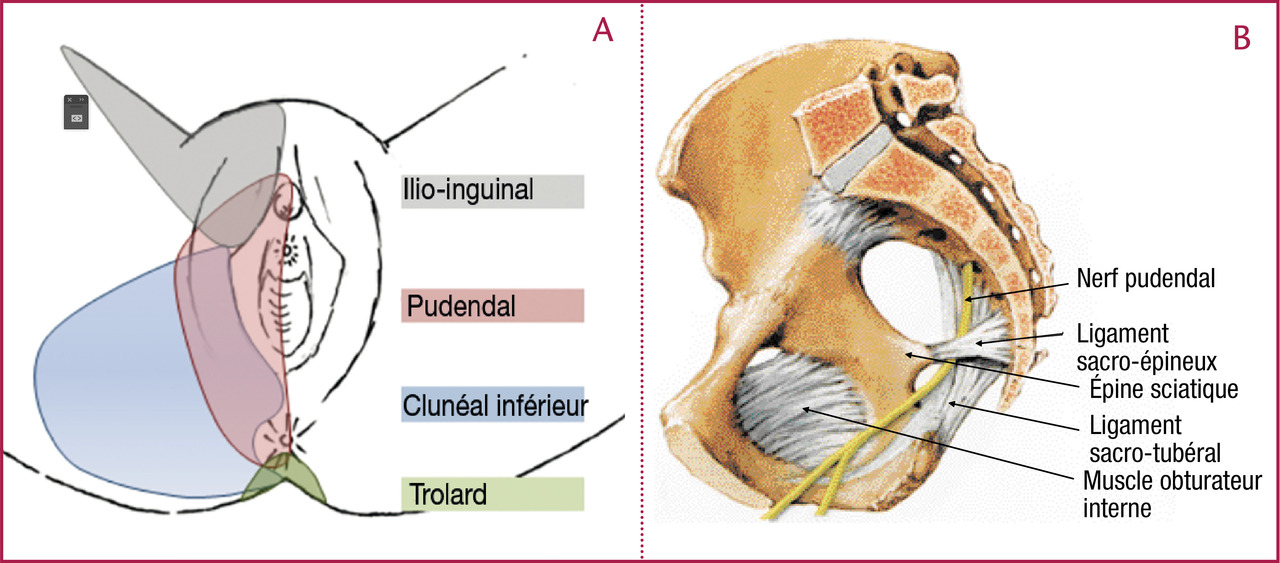
Chez certains patients, les douleurs périnéales s’étendent au-delà du territoire du nerf pudendal. Elles peuvent être causées par d’autres conflits nerveux comme ceux des nerfs ilio-hypogastriques ou ilio-inguinaux après chirurgie de hernie inguinale par exemple. Le rameau clunéal inférieur qui innerve le pli sous-fessier, l’ischion et la zone péri-anale peut également être victime d’une compression. Enfin, le nerf de Trolard (région sacro-coccygienne) peut souffrir de conflits directs (spicule coccygienne, luxation) ou indirects (pathologie des sacro-iliaques ou de la charnière lombo-sacrée) [figure].
Un diagnostic clinique
Les éléments déclenchants sont nombreux (vélo, chirurgie pelvienne, chute…), mais il faut en général les considérer comme révélateurs d’une compression préalable asymptomatique puisque, selon les études anatomiques, elle serait impliquée chez 30 % de la population générale.
En l’absence d’anomalie visible, il ne faut pas évoquer trop hâtivement une pathologie psychogène. Des critères diagnostiques (encadré) ont été définis par un groupe d’experts.1
Les bilans d’imagerie (pelvis ou rachis) servent à éliminer des pathologies lésionnelles pelviennes, urologiques, proctologiques, neurologiques ou gynécologiques. Cependant, aucun examen n’est suffisamment sensible ou spécifique pour affirmer une névralgie pudendale par syndrome canalaire.
L’électroneuromyogramme ne doit plus être réalisé dans des contextes purement douloureux, sans autre trouble neurologique (hypoesthésie, déficits sphinctériens). Cet examen peut être faussement normal : réalisé en position couché, il ne teste en effet que les fibres sensitives et motrices et non les petites fibres Aδ et C.
À l’inverse, il peut être altéré dans d’autres pathologies non systématiquement douloureuses (neuropathies périnéales d’étirement, fréquentes après accouchement).
Ainsi, les anomalies découvertes à l’EMG, l’écho-doppler ou à la neurographie par IRM manquent de spécificité (cf. fréquence des anomalies asymptomatiques : kystes de Tarlov ou périradiculaires, varices pelviennes…).
L’évaluation avec quantification de la douleur (échelle numérique, EN), réalisée en station assise, juste avant et après une infiltration anesthésique du nerf pudendal est en revanche un critère indispensable au diagnostic. Ce « block test » doit être effectué avec de petits volumes d’anesthésiques locaux seuls, injectés au niveau du ligament sacro-épineux, site le plus fréquent de conflit avec le nerf pudendal. Cette étape n’est pas thérapeutique mais permet de valider l’indication chirurgicale. En effet, un essai randomisé en double aveugle comparant des infiltrations d’anesthésiques seuls versus anesthésiques + cortocoïdes ne montre une efficacité significative à 3 mois que dans 13 % des cas, sans différence entre les 2 groupes.2
Traitement
La prise en charge antalgique doit toujours être tentée en 1re intention, en attendant l’infiltration test et une éventuelle chirurgie. Contre la douleur neuropathique : amitrypitiline 3 gouttes le soir, puis augmenter de 2 gouttes tous les 3 jours, jusqu’à 8 à 15 gouttes/j durant au moins 6 mois ; en 2e intention : duloxétine, prégabaline ou gabapentine. La kinésithérapie de relaxation des muscles pelvi-trochantériens et périnéaux peut être aussi prescrite, le plus souvent associée à des mesures comportementales visant à mettre le plus possible le périnée en décharge (bureau permettant de travailler debout, coussin d’assise en forme de bouée, arrêt du vélo…).
Le seul traitement curatif est actuellement la chirurgie : l’objectif est de libérer le nerf pudendal dans toutes les zones de conflits potentiels.
Deux types d’approche ont été décrites, avec des résultats similaires, l’une par voie transpérinéale,3 l’autre transglutéale.4 Seule la visibilité du nerf diffère, la seconde permettant de l’observer sur toute sa longueur et de le libérer de plusieurs sites de compression (pince ligamentaire et canal d’Alcock) le cas échéant.
D’autres techniques se développent, notamment la voie robotique et l’approche endoscopique.5, 6
Selon les auteurs et les méthodes, on obtient dans 60 à 80 % des cas environ une baisse significative de l’intensité de la douleur (au moins 30 %). Cependant, certains patients ne sont pas opérables en raison de leur âge (moins bons résultats après 70 ans), des comorbidités, ou d’un tableau clinique atypique (douleurs à la marche, la nuit ou à la défécation au premier plan…). D’autres techniques non validées peuvent être tentées après concertation pluridisciplinaire en cas de douleurs rebelles : radiofréquence pulsée ou neuromodulation du nerf pudendal ou des racines sacrées (stimulation via des électrodes implantées chirurgicalement).7-9
Actuellement, un protocole de recherche national (Stim Cone) vise à évaluer l’intérêt de la neurostimulation du cône terminal de la moelle en cas d’échec de l’intervention de libération.
Cependant, un certain nombre de patients n’ont jamais recours à la chirurgie car les douleurs ont une évolution favorable, soit spontanée, soit après traitement médical. Ainsi, une prise en charge précoce est essentielle, avant l’épuisement physique et psychologique dû aux douleurs.
Critères de Nantes
Indispensables au diagnostic
1. Douleur située dans le territoire anatomique du nerf pudendal
2. Aggravée en station assise
3. Ne réveillant pas la nuit
4. Sans hypoesthésie objective à l’examen clinique
5. Bloc anesthésique du tronc du nerf pudendal positif
Complémentaires
• Sensations de brûlures, décharges électriques, tiraillements, engourdissements
• Sensation de corps étranger endocavitaire (« sympathalgie » rectale ou vaginale)
• Aggravation de la douleur au cours de la journée
• Douleur à prédominance unilatérale
• Douleurs apparaissant après la défécation
• Douleur exquise à la palpation de l’épine sciatique
• Données de l’électroneuromyogramme chez l’homme et la femme nullipare
Critères d’exclusion
• Douleurs uniquement coccygienne, fessière, pubienne ou hypogastrique
• Prurit
• Douleurs uniquement paroxystiques
• Anomalies d’imagerie pouvant expliquer la douleur
2. Labat JJ, et al. Adding cortico-steroids to the pudendal nerve block for pudendal neuralgia: a randomised, double-blind, controlled trial. BJOG 2017;124:251-60.
3. Bautrant E, et al. [Modern algorithm for treating pudendal neuralgia: 212 cases and 104 decompressions]. J Gynecol Obstet Biol Reprod (Paris) 2003; 32:705-12.
4. Robert R, et al. Decompression and transposition of the pudendal nerve in pudendal neuralgia: a randomized controlled trial and long-term evaluation. Eur Urol 2005;47:403-8.
5. Erdogru T, et al. Laparoscopic pudendal nerve decompression and transposition combined with omental flap protection of the nerve (Istanbul technique): technical description and feasibility analysis. Surg Endosc 2014;28:925-32.
6. Ploteau S, et al. A new endoscopic minimal invasive approach for pudendal nerve and inferior cluneal nerve neurolysis: An anatomical study. Neurourol Urodyn 2018;37:971-7.
7. Petrov-Kondratov V, et al. Pulsed Radiofrequency ablation of pudendal nerve for treatment of a case of refractory pelvic pain. Pain Physician 2017; 20:E451-E454.
8. Hong MJ, et al. Management of pudendal neuralgia using ultrasound-guided pulsed radiofrequency: a report of two cases and discussion of pudendal nerve block techniques. J Anesth 2016;30:356-9.
9. Li ALK, et al. Laparoscopic implantation of electrodes for bilateral neuromodulation of the pudendal nerves and S3 nerve roots for treating pelvic pain and voiding dysfunction. Int Urogynecol J 2018;29:1061-4.

 Encadrés
Encadrés