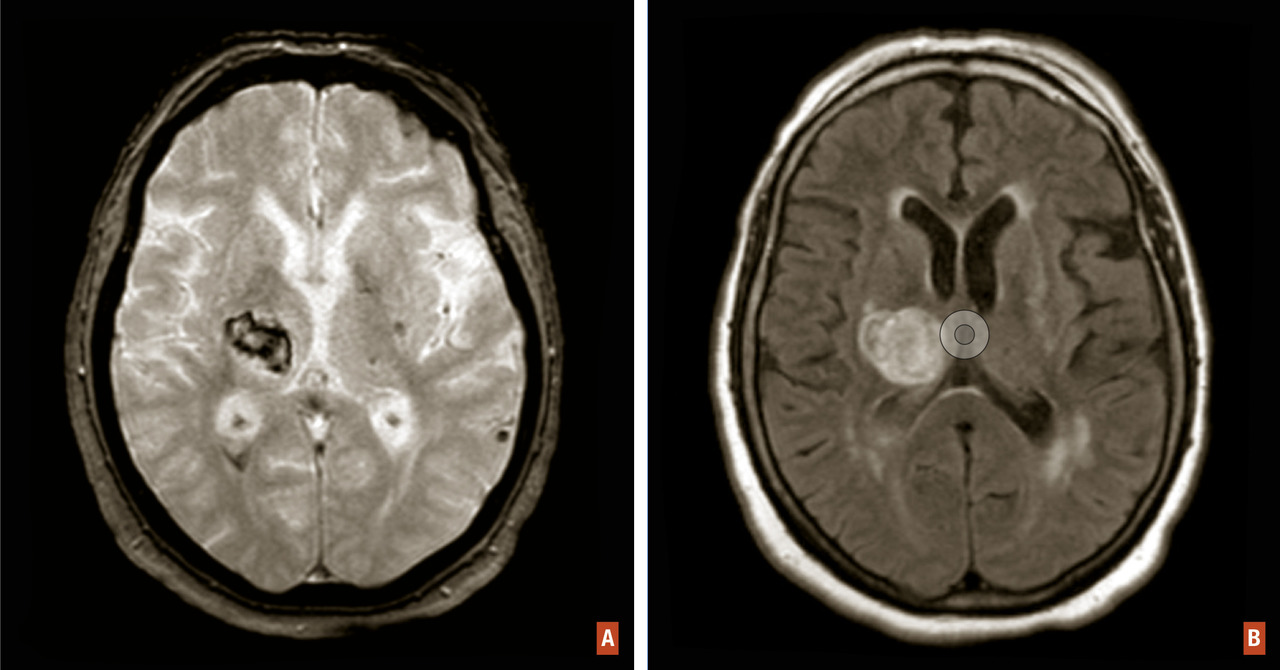
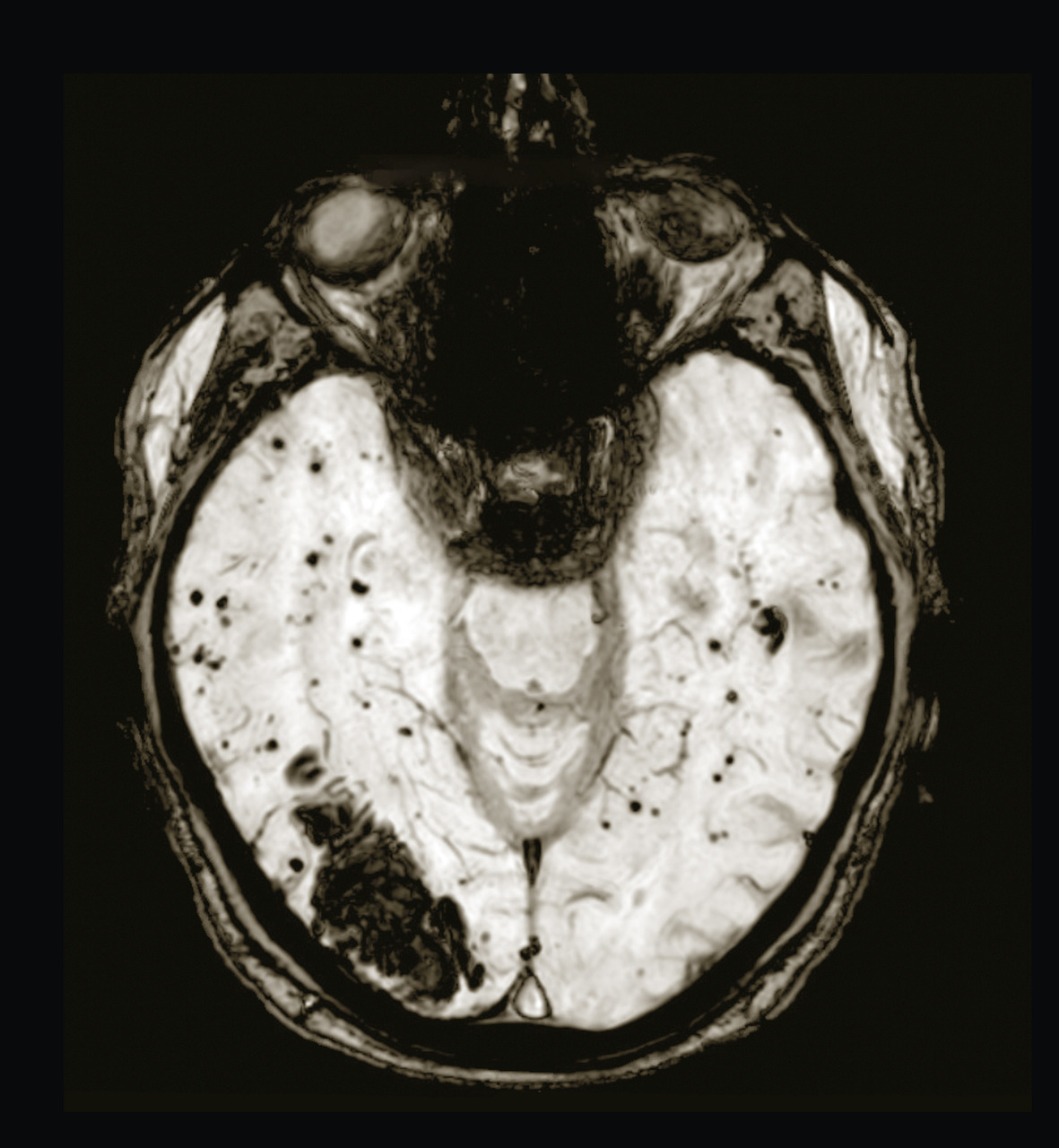
Les hémorragies intracérébrales spontanées résultent d’un saignement cérébral intraparenchymateux en lien avec la rupture de petits vaisseaux généralement touchés par une microangiopathie sporadique. Elles représentent environ 15 % des accidents vasculaires cérébraux (AVC) dans les pays occidentaux. Les hémorragies localisées dans les régions profondes du cerveau sont le résultat de la rupture des petites artérioles touchant préférentiellement le putamen et le thalamus et sont sous-tendues par la microangiopathie des perforantes longues favorisée par les facteurs de risque vasculaires (fig. 1A et B ). Les hémorragies de localisation lobaire proviennent de la rupture d’artérioles de petite et moyenne taille perforant le cortex et la substance blanche sous-corticale et sont principalement sous-tendues chez le sujet âgé par l’angiopathie amyloïde cérébrale (fig. 2 ).
Après une hémorragie intracérébrale, les taux de mortalité à 1 mois sont d’environ 40 %, et moins d’un survivant sur deux est indépendant à 1 an. En effet, alors que des progrès significatifs ont pu être observés dans la prise en charge de la phase aiguë de l’ischémie cérébrale, les hémorragies intracérébrales spontanées restent une cause majeure de morbidité et de mortalité. Malgré une stabilité apparente de l’incidence globale, des modifications notables ont été observées dans le profil des patients, avec une augmentation de l’incidence après 75 ans associée parallèlement à sa diminution chez les moins de 60 ans. Ces données sont en faveur d’un changement dans la répartition des deux principales causes d’ hémorragie intracérébrale : une diminution de la microangiopathie des perforantes longues grâce à une meilleure prise en charge de l’hypertension artérielle, d’une part, et une augmentation de l’incidence des hémorragies intracérébrales lobaires souvent associées à l’angiopathie amyloïde cérébrale, probablement en lien avec l’utilisation accrue des traitements antithrombotiques sur une population vieillissante, d’autre part.
Après une hémorragie intracérébrale, les taux de mortalité à 1 mois sont d’environ 40 %, et moins d’un survivant sur deux est indépendant à 1 an. En effet, alors que des progrès significatifs ont pu être observés dans la prise en charge de la phase aiguë de l’ischémie cérébrale, les hémorragies intracérébrales spontanées restent une cause majeure de morbidité et de mortalité. Malgré une stabilité apparente de l’incidence globale, des modifications notables ont été observées dans le profil des patients, avec une augmentation de l’incidence après 75 ans associée parallèlement à sa diminution chez les moins de 60 ans. Ces données sont en faveur d’un changement dans la répartition des deux principales causes d’ hémorragie intracérébrale : une diminution de la microangiopathie des perforantes longues grâce à une meilleure prise en charge de l’hypertension artérielle, d’une part, et une augmentation de l’incidence des hémorragies intracérébrales lobaires souvent associées à l’angiopathie amyloïde cérébrale, probablement en lien avec l’utilisation accrue des traitements antithrombotiques sur une population vieillissante, d’autre part.
Diagnostic et évaluation initiale
Le tableau clinique des hémorragies intracérébrales associe des symptômes non spécifiques (céphalées, vomissements, troubles de la vigilance d’aggravation progressive...) et un déficit neurologique focal qui dépend de la localisation anatomique de l’atteinte. Il est donc difficile cliniquement de distinguer une hémorragie intracérébrale d’un accident ischémique cérébral. Une imagerie cérébrale doit être réalisée immédiatement pour confirmer la nature de l’AVC (ischémique ou hémorragique) et éventuellement la cause sous-jacente.1, 2
Imagerie cérébrale
Les séquences d’imagerie par résonance magnétique (IRM) dites sensibles au sang écho de gradient T2* ou SWI (susceptibility weighted imaging) permettent d’identifier l’hémorragie cérébrale à la phase aiguë et donnent de plus des informations sur le parenchyme cérébral autour de l’hémorragie. Quand l’IRM n’est pas réalisable (indisponibilité ou contre-indication), la tomodensitométrie s’avère aussi sensible que l’IRM à la phase aiguë, mais sa sensibilité décroît avec le temps, notamment pour les hémorragies de petite taille. Les hémorragies cérébrales spontanées (angiopathie amyloïde cérébrale et maladie des petites artères) représenteraient environ 80 % des hémorragies cérébrales non traumatiques. Néanmoins, il convient de rechercher devant certains signes cliniques ou radiologiques d’autres causes relevant de prises en charge spécifiques (v . tableau ).1, 2
À la phase aiguë : lutter contre l’expansion de l’hémorragie
Objectifs tensionnels à la phase aiguë
L’hypertension artérielle (définie par une pression artérielle systolique [PAS] supérieure à 140 mmHg) est un facteur modifiable associé à une croissance de l’hémorragie cérébrale et à un mauvais pronostic fonctionnel. Ainsi, la baisse précoce et rapide de la pression artérielle pourrait améliorer le pronostic, notamment en diminuant l’expansion de l’hématome. L’essai international randomisé INTERACT 2 ayant inclus 2 829 patients victimes d’une hémorragie intracérébrale a montré qu’une baisse rapide de la PAS à moins de 140 mmHg dans les 6 heures du début des symptômes entraînait une légère amélioration du pronostic fonctionnel et de certains items de qualité de vie en comparaison aux prises en charge standard contemporaines de l’étude (PAS < 180 mmHg). Cependant, un second essai randomisé ATACH 2 ayant inclus 1 000 patients ayant les mêmes caractéristiques cliniques et démographiques n’a montré aucun bénéfice de la baisse intensive de la pression artérielle, mais a en outre soulevé le problème d’effets indésirables rénaux.
Ces discordances peuvent s’expliquer par une différence dans la manière de gérer la baisse de la pression artérielle : INTERACT 2 a opté pour une approche pragmatique en autorisant différentes thérapeutiques antihypertensives alors qu’ATACH 2 utilisait un protocole intensif fondé exclusivement sur l’utilisation de la nicardipine. Par ailleurs, les investigateurs d’ATACH 2 ont pu être influencés par la mise à jour des recommandations récentes et proposer une baisse intensive de la pression artérielle également chez les sujets contrôles.
D’autres preuves indirectes d’un bénéfice de la baisse intensive de la pression artérielle viennent de plusieurs autres sources, notamment d’analyses secondaires d’INTERACT 2.5 À l’heure actuelle, des preuves suffisamment solides sont retenues pour recommander une diminution de la pression artérielle (PAS cible entre 130 et 140 mmHg dans les 6 heures du début des symptômes) chez les patients ayant une hémorragie intracérébrale.2-4
Ces discordances peuvent s’expliquer par une différence dans la manière de gérer la baisse de la pression artérielle : INTERACT 2 a opté pour une approche pragmatique en autorisant différentes thérapeutiques antihypertensives alors qu’ATACH 2 utilisait un protocole intensif fondé exclusivement sur l’utilisation de la nicardipine. Par ailleurs, les investigateurs d’ATACH 2 ont pu être influencés par la mise à jour des recommandations récentes et proposer une baisse intensive de la pression artérielle également chez les sujets contrôles.
D’autres preuves indirectes d’un bénéfice de la baisse intensive de la pression artérielle viennent de plusieurs autres sources, notamment d’analyses secondaires d’INTERACT 2.5 À l’heure actuelle, des preuves suffisamment solides sont retenues pour recommander une diminution de la pression artérielle (PAS cible entre 130 et 140 mmHg dans les 6 heures du début des symptômes) chez les patients ayant une hémorragie intracérébrale.2-4
Gestion des traitements antithrombotiques
Les patients ayant une coagulopathie secondaire à un déficit en facteur de la coagulation ou une thrombocytopénie doivent recevoir respectivement des facteurs de coagulation et des concentrés plaquettaires. Les patients ayant un international normalized ratio (INR) élevé doivent recevoir de la vitamine K associée à un concentré de complexe prothrombinique (classe IIb ; niveau de preuve : B).2-4 Les concentrés de complexe prothrombinique sont préférés au plasma frais congelé, car ils induisent moins d’hypervolémie et de réactions allergiques pour un taux de complications thromboemboliques équivalent.6 L’action des agents antithrombiniques tel que le dabigatran peut être neutralisée par l’idarucizumab et pour les anti-Xa tels que l’apixaban et le rivaroxaban par l’andexanet alfa (non mis sur le marché pour le moment en raison d’un risque d’événement thrombotique élevé). En revanche, l’administration de facteur recombinant VIIa, l’acide tranxénamique et la transfusion de plaquettes chez les patients sous antiagrégants plaquettaires n’ont pas fait la preuve de leur efficacité dans des essais randomisés contre placebo.1
Indication neurochirurgicale à la phase aiguë
L’objectif du traitement chirurgical dans l’hémorragie intracérébrale spontanée réside dans l’ablation du caillot, permettant ainsi de réduire l’œdème cérébral secondaire périhématique.
Une évacuation chirurgicale d’un hématome cérébelleux responsable d’une dégradation neurologique rapide par compression du tronc cérébral est proposée en pratique clinique malgré l’absence d’essai randomisé ayant évalué cette stratégie.2-4
Concernant les hémorragies supratentorielles, une évacuation précoce (< 24 heures du début de l’hémorragie) associée à une craniotomie est considérée comme une procédure de sauvetage chez les patients se détériorant rapidement sans pour autant avoir démontré de bénéfice clair chez les patients comateux ou stables.1
Dans l’étude STICH, 1 033 patients avec une hémorragie intracérébrale supratentorielle issus de 83 centres ont été randomisés pour bénéficier soit d’un traitement chirurgical précoce, soit d’une prise en charge initiale conservatrice. Aucune différence significative n’était observée, avec une proportion de survie à 6 mois identique dans les deux groupes. L’unique sous-groupe favorable à un traitement chirurgical était celui avec une hémorragie située à moins de 1 cm du cortex. Fort de ces résultats, l’essai STICH II avait pour objectif d’évaluer l’intérêt de l’ablation précoce de l’hémorragie cérébrale lobaire (situé à 1 cm de la surface corticale) chez un patient conscient.7 L’évolution défavorable à 6 mois était sans différence significative entre les 2 bras. Cependant, dans ces deux essais internationaux, les patients pour lesquels l’indication chirurgicale ne posait pas de doute étaient exclus. Les résultats se sont grevés d’un taux élevé de cross-over du traitement conservateur vers le traitement chirurgical chez les patients se détériorant, ce qui a probablement compromis un effet statistique pour détecter un bénéfice de la chirurgie.
Plusieurs méta-analyses d’essais cliniques comparant des techniques stéréotaxiques ou endoscopiques avec d’autres traitements (craniotomie ou traitement conservateur) ont montré des bénéfices cliniques à moyen et long terme de ces procédures mini-invasives. Après les résultats encourageants d’un essai de phase II (MISTIE), l’association d’une approche stéréotaxique à l’instillation d’un agent lytique est en cours d’évaluation.1 Cependant, le délai du traitement chirurgical de l’hémorragie cérébrale spontanée reste une donnée controversée.
Une évacuation chirurgicale d’un hématome cérébelleux responsable d’une dégradation neurologique rapide par compression du tronc cérébral est proposée en pratique clinique malgré l’absence d’essai randomisé ayant évalué cette stratégie.2-4
Concernant les hémorragies supratentorielles, une évacuation précoce (< 24 heures du début de l’hémorragie) associée à une craniotomie est considérée comme une procédure de sauvetage chez les patients se détériorant rapidement sans pour autant avoir démontré de bénéfice clair chez les patients comateux ou stables.1
Dans l’étude STICH, 1 033 patients avec une hémorragie intracérébrale supratentorielle issus de 83 centres ont été randomisés pour bénéficier soit d’un traitement chirurgical précoce, soit d’une prise en charge initiale conservatrice. Aucune différence significative n’était observée, avec une proportion de survie à 6 mois identique dans les deux groupes. L’unique sous-groupe favorable à un traitement chirurgical était celui avec une hémorragie située à moins de 1 cm du cortex. Fort de ces résultats, l’essai STICH II avait pour objectif d’évaluer l’intérêt de l’ablation précoce de l’hémorragie cérébrale lobaire (situé à 1 cm de la surface corticale) chez un patient conscient.7 L’évolution défavorable à 6 mois était sans différence significative entre les 2 bras. Cependant, dans ces deux essais internationaux, les patients pour lesquels l’indication chirurgicale ne posait pas de doute étaient exclus. Les résultats se sont grevés d’un taux élevé de cross-over du traitement conservateur vers le traitement chirurgical chez les patients se détériorant, ce qui a probablement compromis un effet statistique pour détecter un bénéfice de la chirurgie.
Plusieurs méta-analyses d’essais cliniques comparant des techniques stéréotaxiques ou endoscopiques avec d’autres traitements (craniotomie ou traitement conservateur) ont montré des bénéfices cliniques à moyen et long terme de ces procédures mini-invasives. Après les résultats encourageants d’un essai de phase II (MISTIE), l’association d’une approche stéréotaxique à l’instillation d’un agent lytique est en cours d’évaluation.1 Cependant, le délai du traitement chirurgical de l’hémorragie cérébrale spontanée reste une donnée controversée.
Complications de la phase aiguë
Crises d’épilepsie précoces (< 7 jours après la survenue de l’hémorragie)
Le risque de crise d’épilepsie est relativement élevé après une hémorragie cérébrale (5-10 %). Les traitements antiépileptiques prophylactiques ne sont pas recommandés et peuvent être associés à un moins bon pronostic. Cependant, devant la survenue d’une crise d’épilepsie, un traitement doit être prescrit,1, 2 et en cas de crises précoces généralement il doit être poursuivi de 3 à 6 mois pour prévenir des crises futures.
Œdème cérébral
Aucun des traitements antiœdémateux utilisés habituellement (corticoïdes, mannitol, hyperventilation…) n’a montré la preuve de son efficacité dans l’hémorragie cérébrale en phase aiguë.2-4 Plusieurs études évaluant de nouvelles approches ciblant l’inflammation (fingolimod [NCT02175225], déféroxamine) ou encore l’hémicraniectomie (NCT02258919) sont en cours.1
Complication thromboembolique veineuse
La compression pneumatique intermittente a montré un bénéfice significatif à la phase aiguë de l’hémorragie cérébrale pour prévenir les événements thromboemboliques. En pratique, il est préférable d’attendre au moins 24 à 48 heures avant d’introduire des héparines de bas poids moléculaire ou autres héparinoïdes chez les patients immobiles afin de limiter le risque d’une récidive du saignement et d’aggraver le pronostic fonctionnel.2-4
Des résultats décevants
À la phase aiguë, une hémorragie intracérébrale est une urgence médicale, au même titre que l’ischémie cérébrale (d’autant que rien ne les différencie au début), ce qui doit conduire à l’hospitalisation rapide des patients en unité de soins intensifs neurovasculaires. En dépit des avancées scientifiques, peu de traitements de phase aiguë ont fait la preuve de leur efficacité pour améliorer le pronostic fonctionnel ou réduire la mortalité au décours d’une hémorragie cérébrale. La recherche doit dans l’avenir se focaliser sur de nouvelles stratégies thérapeutiques, qui devront non seulement lutter contre l’expansion de l’hématome mais également cibler les mécanismes neuro-inflammatoires de l’œdème cérébral.
Références
1. Cordonnier C, Demchik A, Zia W, et al. Intracerebral haemorrhage: current approaches to acute management. Lancet 2018;392:1257-68.
2. Hemphill JC 3rd, Greenberg SM, Anderson CS, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2015;46:2032-60.
3. Schreuder FH, Sato S, Klijn CJ, Anderson CS. Medical management of intracerebral haemorrhage. J Neurol Neurosurg Psychiatry 2017;88:76-84.
4. Steiner T, Al-Shahi Salman R, Beer R, et al. European Stroke Organisation (ESO) guidelines for the management of spontaneous intracerebral hemorrhage. Int J Stroke 2014;9:840-55.
5. Qureshi AI, Palesch YY, Barsan WG, et al. Intensive blood-pressure lowering in patients with acute cerebral hemorrhage. N Engl J Med 2016;375:1033-43.
6. Steiner T, Poli S, Griebe M, et al. Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): a randomised trial. Lancet Neurol 2016;15:566-73.
7. Mendelow AD, Gregson BA, Rowan EN, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet 2013;382:397-408.
2. Hemphill JC 3rd, Greenberg SM, Anderson CS, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2015;46:2032-60.
3. Schreuder FH, Sato S, Klijn CJ, Anderson CS. Medical management of intracerebral haemorrhage. J Neurol Neurosurg Psychiatry 2017;88:76-84.
4. Steiner T, Al-Shahi Salman R, Beer R, et al. European Stroke Organisation (ESO) guidelines for the management of spontaneous intracerebral hemorrhage. Int J Stroke 2014;9:840-55.
5. Qureshi AI, Palesch YY, Barsan WG, et al. Intensive blood-pressure lowering in patients with acute cerebral hemorrhage. N Engl J Med 2016;375:1033-43.
6. Steiner T, Poli S, Griebe M, et al. Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): a randomised trial. Lancet Neurol 2016;15:566-73.
7. Mendelow AD, Gregson BA, Rowan EN, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): a randomised trial. Lancet 2013;382:397-408.