L’insuffisance rénale chronique modifie la stratégie d’utilisation des hypoglycémiants chez le diabétique.
Environ un tiers des diabétiques de type 2 ont une néphropathie, dont 10 à 15 % sont compliquées d’une insuffisance rénale chronique (IRC) de stade 3 ou plus (DFG estimé < 60 mL/min/1,73 m2).
Elle témoigne souvent d’un diabète évolué. Mais la nécessité d’intensifier le traitement est controversée, notamment en raison d’un risque accru d’hypoglycémie. Selon la HAS et la Société européenne de néphrologie, la cible d’HbA1C est ≤ 7 % en cas d’IRC de stade 3 et ≤ 8 % aux stades 4-5.1
Dans la plupart des études pharmacologiques, la clairance de la créatinine calculée selon Cockcroft sous-estime la fonction rénale réelle chez les sujets âgés et donc chez les diabétiques. Les médicaments sont alors sous-dosés, voire contre-indiqués trop précocement. Il faut préférer la CKD-EPI, plus performante et moins dépendante de l’âge. Son inconvénient principal est de fournir un DFGe indexé à une surface corporelle théorique (1,73 m²), ce qui peut être facilement contourné chez l’individu obèse en désindexant le résultat (DFGe x S/1,73) ; S étant calculé avec la formule de Dubois.
L’IRC modifie le maniement des antidiabétiques oraux (ADO). Cela conduit souvent à instaurer trop vite une insulinothérapie, avec ses risques propres (prise de poids, rétention hydrosodée et hypoglycémie), alors même que les cibles d’HbA1c sont plus souples dans cette population âgée.
La metformine, médicament de 1re in-tention, s’accumule en cas d’IRC, favorisant parfois le développement d’une acidose lactique. Classiquement, elle était contre-indiquée en cas de DFGe ≤ 60 mL/min.
Compte tenu de son bénéfice sur la morbi-mortalité, la FDA et l’EMA ont récemment assoupli leur position, permettant son usage au stade 3, sous réserve d’une adaptation posologique :1 500 mg/j au stade 3A (DFG entre 45 et 59) ; 1 000 mg/j au stade 3B (DFG entre 30 et 44). Pour certains auteurs, à 500 mg/j, elle est bien tolérée au stade 4 (DFG entre 15 et 30).2
L’emploi d’un sulfamide hypoglycémiant est possible au stade 3 sous réserve de réduire la dose et de privilégier ceux à demi-vie d’action courte (glimépiride, glipizide) pour limiter le risque de surdosage et d’hypoglycémies graves.
Actuellement, en cas de DFGe < 30 mL/min, seuls sont autorisés les inhibiteurs de l’α-glucosidase (jusqu’à 25 mL/min), mais ils sont modérément efficaces ; les inhibiteurs de la dipeptidylpeptidase-4 (iDDP4 ou gliptines), le répaglinide et l’insuline.
Les « nouveaux » ADO sont des incrétino-mimétiques. Les incrétines (GLP-1 et GIP), sécrétées en réponse à la présence de glucose dans le tube digestif (donc sans risque d’hypoglycémie) majorent la sécrétion d’insuline, diminuent celle de glucagon, réduisent la vidange gastrique et la prise alimentaire.
On distingue : les agonistes directs du récepteur au GLP-1 (injectables) et les inhibiteurs du DPP4, enzyme dégradant le GLP-1 et le GIP endogènes (per os).
Elle témoigne souvent d’un diabète évolué. Mais la nécessité d’intensifier le traitement est controversée, notamment en raison d’un risque accru d’hypoglycémie. Selon la HAS et la Société européenne de néphrologie, la cible d’HbA1C est ≤ 7 % en cas d’IRC de stade 3 et ≤ 8 % aux stades 4-5.1
Dans la plupart des études pharmacologiques, la clairance de la créatinine calculée selon Cockcroft sous-estime la fonction rénale réelle chez les sujets âgés et donc chez les diabétiques. Les médicaments sont alors sous-dosés, voire contre-indiqués trop précocement. Il faut préférer la CKD-EPI, plus performante et moins dépendante de l’âge. Son inconvénient principal est de fournir un DFGe indexé à une surface corporelle théorique (1,73 m²), ce qui peut être facilement contourné chez l’individu obèse en désindexant le résultat (DFGe x S/1,73) ; S étant calculé avec la formule de Dubois.
L’IRC modifie le maniement des antidiabétiques oraux (ADO). Cela conduit souvent à instaurer trop vite une insulinothérapie, avec ses risques propres (prise de poids, rétention hydrosodée et hypoglycémie), alors même que les cibles d’HbA1c sont plus souples dans cette population âgée.
La metformine, médicament de 1re in-tention, s’accumule en cas d’IRC, favorisant parfois le développement d’une acidose lactique. Classiquement, elle était contre-indiquée en cas de DFGe ≤ 60 mL/min.
Compte tenu de son bénéfice sur la morbi-mortalité, la FDA et l’EMA ont récemment assoupli leur position, permettant son usage au stade 3, sous réserve d’une adaptation posologique :1 500 mg/j au stade 3A (DFG entre 45 et 59) ; 1 000 mg/j au stade 3B (DFG entre 30 et 44). Pour certains auteurs, à 500 mg/j, elle est bien tolérée au stade 4 (DFG entre 15 et 30).2
L’emploi d’un sulfamide hypoglycémiant est possible au stade 3 sous réserve de réduire la dose et de privilégier ceux à demi-vie d’action courte (glimépiride, glipizide) pour limiter le risque de surdosage et d’hypoglycémies graves.
Actuellement, en cas de DFGe < 30 mL/min, seuls sont autorisés les inhibiteurs de l’α-glucosidase (jusqu’à 25 mL/min), mais ils sont modérément efficaces ; les inhibiteurs de la dipeptidylpeptidase-4 (iDDP4 ou gliptines), le répaglinide et l’insuline.
Les « nouveaux » ADO sont des incrétino-mimétiques. Les incrétines (GLP-1 et GIP), sécrétées en réponse à la présence de glucose dans le tube digestif (donc sans risque d’hypoglycémie) majorent la sécrétion d’insuline, diminuent celle de glucagon, réduisent la vidange gastrique et la prise alimentaire.
On distingue : les agonistes directs du récepteur au GLP-1 (injectables) et les inhibiteurs du DPP4, enzyme dégradant le GLP-1 et le GIP endogènes (per os).
Inhibiteurs de la DPP4
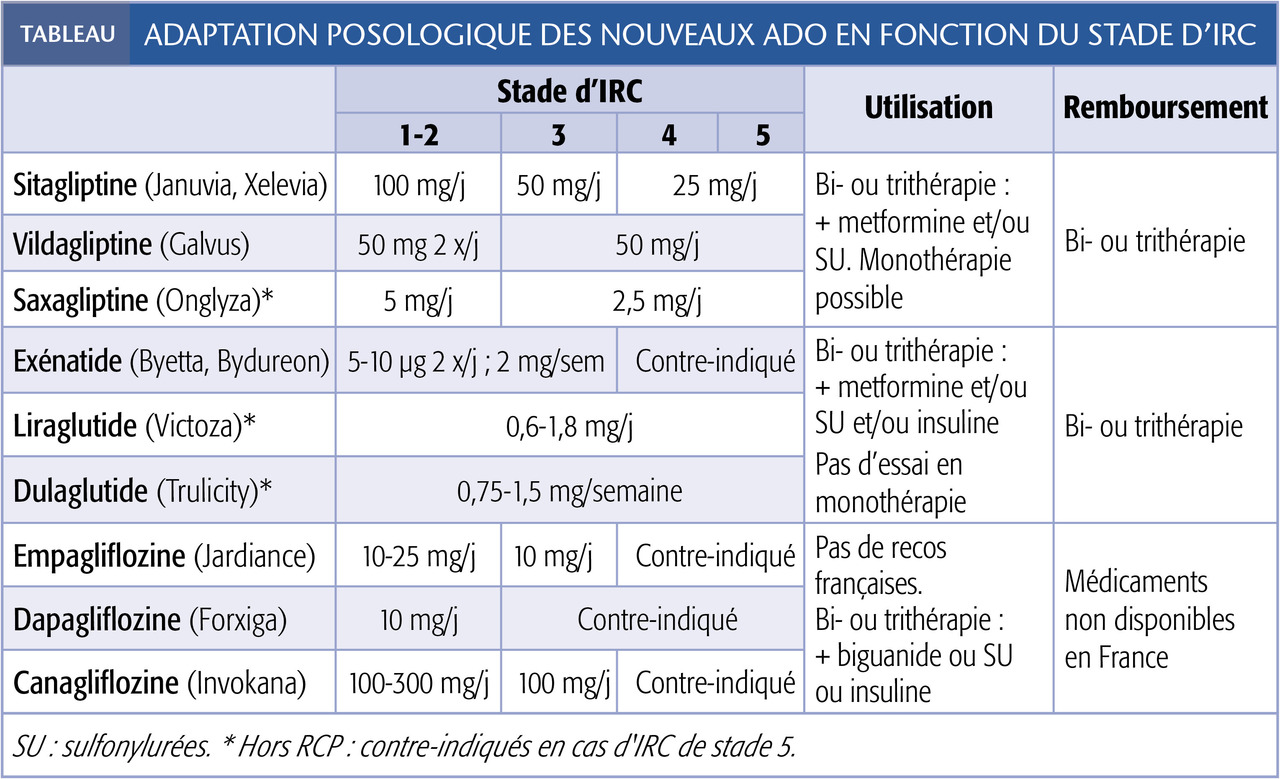
Ce sont la sitagliptine (Januvia, Xelevia), la vildagliptine (Galvus), la saxagliptine (Onglyza). La linagliptine (Trajenta) n’est pas commercialisée en France.
La sitagliptine est éliminée à 80 % par voie rénale et s’accumule en cas d’IRC (AUC x 2, 4 et 4,5 si IRC de stade 3, 4 et 5, respectivement). La posologie doit donc être diminuée de 100 à 50 mg/j en cas de DFGe < 50 mL/min et à 25 mg/j en cas d’IRC de stade 4-5D ou 5ND (dialyse ou non). Cependant, les comprimés à 25 mg ne sont pas commercialisés en France.
La vildagliptine est éliminée à 85 % par le rein. La posologie usuelle (50 mg 2 x/j) est possible jusqu’à un DFGe > 50 mL/min. La posologie doit ensuite être diminuée à 50 mg/j, y compris en cas d’IRC de stade 5D ou 5ND.
La saxagliptine est éliminée à 36 % par voie rénale et s’accumule en cas d’IRC (AUC x 4,5 si IRC de stade 3). La posologie usuelle est de 5 mg/j si le DFGe > 60 mL/min. Elle doit être ensuite diminuée à 2,5 mg/j, y compris en cas d’IRC de stade 5D ou 5ND (dans les RCP : pas recommandée si IR terminale mais utilisable en pratique).
L’efficacité de ces médicaments, indépendante de la fonction rénale, se traduit par une baisse d’HbA1C d’environ 0,8-0,9 %. On les associe à la metformine et/ou à un sulfamide hypoglycémiant en cas de contrôle insuffisant. Si contre-indication ou intolérance à la metformine (par exemple IRC de stade 4-5), les 3 gliptines peuvent être utilisées en monothérapie ou associées à l’insuline mais ne sont alors pas remboursées par la Sécurité sociale.
Les études de sécurité post-commercialisation ont montré un effet neutre en prévention de la mortalité ou des complications cardiovasculaires,3 mais la saxagliptine pourrait augmenter le risque d’hospitalisations pour insuffisance cardiaque.
La sitagliptine est éliminée à 80 % par voie rénale et s’accumule en cas d’IRC (AUC x 2, 4 et 4,5 si IRC de stade 3, 4 et 5, respectivement). La posologie doit donc être diminuée de 100 à 50 mg/j en cas de DFGe < 50 mL/min et à 25 mg/j en cas d’IRC de stade 4-5D ou 5ND (dialyse ou non). Cependant, les comprimés à 25 mg ne sont pas commercialisés en France.
La vildagliptine est éliminée à 85 % par le rein. La posologie usuelle (50 mg 2 x/j) est possible jusqu’à un DFGe > 50 mL/min. La posologie doit ensuite être diminuée à 50 mg/j, y compris en cas d’IRC de stade 5D ou 5ND.
La saxagliptine est éliminée à 36 % par voie rénale et s’accumule en cas d’IRC (AUC x 4,5 si IRC de stade 3). La posologie usuelle est de 5 mg/j si le DFGe > 60 mL/min. Elle doit être ensuite diminuée à 2,5 mg/j, y compris en cas d’IRC de stade 5D ou 5ND (dans les RCP : pas recommandée si IR terminale mais utilisable en pratique).
L’efficacité de ces médicaments, indépendante de la fonction rénale, se traduit par une baisse d’HbA1C d’environ 0,8-0,9 %. On les associe à la metformine et/ou à un sulfamide hypoglycémiant en cas de contrôle insuffisant. Si contre-indication ou intolérance à la metformine (par exemple IRC de stade 4-5), les 3 gliptines peuvent être utilisées en monothérapie ou associées à l’insuline mais ne sont alors pas remboursées par la Sécurité sociale.
Les études de sécurité post-commercialisation ont montré un effet neutre en prévention de la mortalité ou des complications cardiovasculaires,3 mais la saxagliptine pourrait augmenter le risque d’hospitalisations pour insuffisance cardiaque.
Agonistes du GLP-1
Administrés en sous-cutané, leur utilisation sans adaptation de posologie les rapproche des ADO. L’effet bénéfique sur le risque cardiovasculaire, démontré pour le liraglutide, l’absence d’hypoglycémie et la perte pondérale associée leur confèrent un profil métabolique très intéressant.
L’exénatide est disponible sous forme à libération prolongée (Bydureon 2 mg/semaine) ou à libération immédiate (Byetta 5-10 µg 2 x/j). Son élimination est principalement rénale. Son utilisation est possible sans adaptation posologique jusqu’à un DFGe de 30 mL/min.
Le liraglutide (Victoza) a la particularité de ne pas avoir d’élimination rénale ou fécale mais d’être dégradé par le catabolisme général des protéines. Son usage est autorisé aux posologies usuelles (0,6 à 1,8 mg/j) à tous les stades d’IRC, y compris aux stades 5ND ou 5D (dans les RCP : non recommandé si DFG < 15). Toutefois, ces patients ont davantage de nausées-vomissements et un risque d’insuffisance rénale aiguë fonctionnelle surajoutée. Au stade 5ND, une confusion avec les symptômes digestifs liés à l’urémie est possible.
Le dulaglutide (Trulicity) a la même voie de dégradation que le liraglutide. On le prescrit en monothérapie (0,75 mg/semaine) ou en bithérapie (0,75-1,5 mg/semaine) sans adaptation de posologie jusqu’à un DFGe de 15 mL/min. En-deça, on peut aussi l’utiliser (hors RCP).
La baisse d’HbA1C attendue est de 0,9-1,0 % et le liraglutide est efficace en prévention des complications cardiorénales.4 On les prescrit de préférence en bi- ou trithérapie, en association à la metformine et/ou à un sulfamide hypoglycémiant (surtout si IMC ≥ 30 kg/m², prise de poids, hypo- glycémies sous insuline) ou à l’insuline. Ils ne sont pas indiqués en monothérapie et non remboursés dans cette situation.
L’exénatide est disponible sous forme à libération prolongée (Bydureon 2 mg/semaine) ou à libération immédiate (Byetta 5-10 µg 2 x/j). Son élimination est principalement rénale. Son utilisation est possible sans adaptation posologique jusqu’à un DFGe de 30 mL/min.
Le liraglutide (Victoza) a la particularité de ne pas avoir d’élimination rénale ou fécale mais d’être dégradé par le catabolisme général des protéines. Son usage est autorisé aux posologies usuelles (0,6 à 1,8 mg/j) à tous les stades d’IRC, y compris aux stades 5ND ou 5D (dans les RCP : non recommandé si DFG < 15). Toutefois, ces patients ont davantage de nausées-vomissements et un risque d’insuffisance rénale aiguë fonctionnelle surajoutée. Au stade 5ND, une confusion avec les symptômes digestifs liés à l’urémie est possible.
Le dulaglutide (Trulicity) a la même voie de dégradation que le liraglutide. On le prescrit en monothérapie (0,75 mg/semaine) ou en bithérapie (0,75-1,5 mg/semaine) sans adaptation de posologie jusqu’à un DFGe de 15 mL/min. En-deça, on peut aussi l’utiliser (hors RCP).
La baisse d’HbA1C attendue est de 0,9-1,0 % et le liraglutide est efficace en prévention des complications cardiorénales.4 On les prescrit de préférence en bi- ou trithérapie, en association à la metformine et/ou à un sulfamide hypoglycémiant (surtout si IMC ≥ 30 kg/m², prise de poids, hypo- glycémies sous insuline) ou à l’insuline. Ils ne sont pas indiqués en monothérapie et non remboursés dans cette situation.
Inhibiteurs de SGLT2
Nouveaux médicaments, les gliflozines inhibent la réabsorption rénale de glucose en bloquant le transporteur tubulaire proximal SGLT2. L’effet glucorétique est proportionnel à la glycémie mais indépendant de l’insuline et associé à un effet natriurétique significatif qui contribue à réduire la PA, le poids ainsi que le risque d’insuffisance cardiaque. En raison du site d’action principalement rénal, leur efficacité pharmaco- logique s’atténue avec la baisse du DFG.
Malgré leurs bénéfices modestes sur le contrôle glycémique (baisse de l’HbA1c de 0,66 %), ils diminuent significativement la mortalité cardiovasculaire et rénale.5 Bien que la FDA et l’EMA leur soient favorables, ces molécules ne sont pas encore commercialisées en France.
L’empagliflozine (Jardiance) est d’élimination fécale et urinaire. Son usage est autorisé sans adaptation posologique (10-25 mg/j) jusqu’à un DFGe ≥ 60 mL/min. Au stade 3A (DFGe 45-59 mL), il faut réduire à 10 mg/j. Elle est contre-indiquée en cas de DFGe < 45 mL/min (mais utilisée jusqu’à 30 mL/min en Belgique).
La dapagliflozine (Forxiga, Edistride) et la canagliflozine (Invokana) ont un mode d’action identique. Leur usage est autorisé sans adaptation de posologie (respectivement 10 mg/j et 100-300 mg/j) en l’absence d’IRC (DFGe > 60 mL/min). La posologie de la canagliflozine est de 100 mg/j si l’IRC est de stade 3A (entre 45 et 59).
Non recommandés en monothérapie, ils doivent être prescrits en bi- ou trithérapie avec la metformine ou un SU, ou l’insuline (empagliflozine, canagliflozine). Effets indésirables : polyurie initiale et risque modéré d’infection du tractus urogénital, présumé en lien avec la glycosurie.
Malgré leurs bénéfices modestes sur le contrôle glycémique (baisse de l’HbA1c de 0,66 %), ils diminuent significativement la mortalité cardiovasculaire et rénale.5 Bien que la FDA et l’EMA leur soient favorables, ces molécules ne sont pas encore commercialisées en France.
L’empagliflozine (Jardiance) est d’élimination fécale et urinaire. Son usage est autorisé sans adaptation posologique (10-25 mg/j) jusqu’à un DFGe ≥ 60 mL/min. Au stade 3A (DFGe 45-59 mL), il faut réduire à 10 mg/j. Elle est contre-indiquée en cas de DFGe < 45 mL/min (mais utilisée jusqu’à 30 mL/min en Belgique).
La dapagliflozine (Forxiga, Edistride) et la canagliflozine (Invokana) ont un mode d’action identique. Leur usage est autorisé sans adaptation de posologie (respectivement 10 mg/j et 100-300 mg/j) en l’absence d’IRC (DFGe > 60 mL/min). La posologie de la canagliflozine est de 100 mg/j si l’IRC est de stade 3A (entre 45 et 59).
Non recommandés en monothérapie, ils doivent être prescrits en bi- ou trithérapie avec la metformine ou un SU, ou l’insuline (empagliflozine, canagliflozine). Effets indésirables : polyurie initiale et risque modéré d’infection du tractus urogénital, présumé en lien avec la glycosurie.
Encadre
Traitement initial et combinaisons selon le stade d’IRC*
Stade 3 : metformine dose réduite (max 1 500 mg/j) ± gliptine dose réduite (50 mg de sitagliptine ou de vildagliptine) ± répaglinide
Alternative ou si échec : metformine dose réduite ± agoniste GLP-1 ± répaglinide
Si échec : metformine dose réduite ± agoniste GLP-1 ± insuline
Alternative stade 3A : metformine dose réduite ± gliflozine (dose réduite) ± gliptine (ou agoniste GLP-1)
Stades 4-5ND-5D : gliptine dose réduite ± répaglinide
Alternative ou si échec : agoniste GLP-1 (liraglutide ou dulaglutide hors RCP) ± répaglinide
Si échec : gliptine ou agoniste GLP-1 (liraglutide ou dulaglutide hors RCP au stade 5) ± insuline
Références
1. Guideline development group. Clinical Practice Guideline on management of patients with diabetes and chronic kidney disease stage 3b or higher (eGFR <45 mL/min). Nephrol Dial Transplant 2015;30 (Suppl 2): ii1-142.
2. Lalau JD, Kajbaf F, Bennis Y, et al. Metformin Treatment in Patients With Type 2 Diabetes and Chronic Kidney Disease Stages 3A, 3B, or 4. Diabetes Care 2018;41:547-53.
3. Scheen AJ. Pharmacological management of type 2 diabetes: what’s new in 2017? Expert Rev Clin Pharmacol 2017;10:1383-94.
4. Nauck MA, Meier JJ, Cavender MA, et al. Cardiovascular Actions and Clinical Outcomes With Glucagon-Like Peptide-1 Receptor Agonists and Dipeptidyl Peptidase-4 Inhibitors. Circulation 2017;136:849-70.
5. Zinman B, Wanner C, Lachin JM, et al. Empagli- flozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28.
2. Lalau JD, Kajbaf F, Bennis Y, et al. Metformin Treatment in Patients With Type 2 Diabetes and Chronic Kidney Disease Stages 3A, 3B, or 4. Diabetes Care 2018;41:547-53.
3. Scheen AJ. Pharmacological management of type 2 diabetes: what’s new in 2017? Expert Rev Clin Pharmacol 2017;10:1383-94.
4. Nauck MA, Meier JJ, Cavender MA, et al. Cardiovascular Actions and Clinical Outcomes With Glucagon-Like Peptide-1 Receptor Agonists and Dipeptidyl Peptidase-4 Inhibitors. Circulation 2017;136:849-70.
5. Zinman B, Wanner C, Lachin JM, et al. Empagli- flozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-28.

 Encadrés
Encadrés