Grâce aux inhibiteurs de tyrosine kinase, la leucémie myéloïde chronique est devenue pour la majorité des patients une maladie chronique qui n’impacte pas leur espérance de vie, avec même la possibilité dans certaines conditions d’un arrêt de traitement pour quelques patients. Pour ceux qui sont résistants ou intolérants au traitement, l’apparition des inhibiteurs allostériques est un nouvel espoir.
Voici maintenant 20 ans que l’arrivée de l’imatinib, la première molécule d’une nouvelle classe thérapeutique, celle des inhibiteurs de tyrosine kinase, faisait la une du Time Magazine (fig. 1 ). Un événement à la mesure de la formidable révolution thérapeutique que cette molécule allait représenter pour les patients. La leucémie myéloïde chronique en phase chronique, hémopathie maligne jadis d’évolution fatale, avec une évolution vers une leucémie aiguë, est devenue une maladie chronique n’ayant quasiment plus d’impact sur l’espérance de vie attendue des patients. Depuis l’imatinib, inhibiteur de tyrosine kinase dit de « première génération », ont été développés ceux de 2e génération et de 3e génération. Plus récemment est arrivé l’asciminib, la première molécule d’une nouvelle classe thérapeutique, celle des inhibiteurs allostériques.
Inhibiteurs de tyrosine kinase
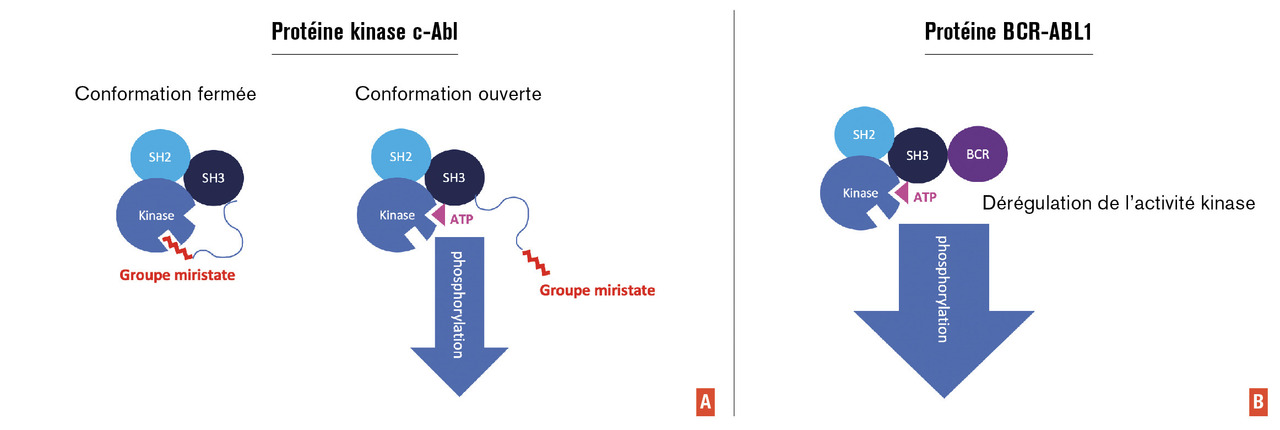
Les inhibiteurs de tyrosine kinase sont des inhibiteurs compétitifs de l’adénosine triphosphate (ATP), substrat indispensable à l’action de la kinase d’ABL (v. infra ). Pour rappel, la leucémie myéloïde chronique est liée à la présence d’une anomalie chromosomique acquise dans les cellules souches hématopoïétiques, nommée chromosome Philadelphie, résultat d’une translocation entre les chromosomes 9 et 22 aboutissant à un gène anormal BCR Abelson (ABL1). Cet oncogène est transcrit, puis traduit en une protéine de fusion du même nom. Dans cette protéine de fusion, ABL se retrouve amputée du domaine « cap » et du groupe myristoyle, tout en gardant ses domaines SH et son domaine kinase (fig. 2 ). Cette amputation d’une partie d’ABL empêche sa fermeture conformationnelle responsable de l’exposition permanente de son domaine kinase et donc de la phosphorylation dérégulée de différentes protéines de signalisation cellulaire (fig. 2 ). Cette réaction enzymatique de phosphorylation nécessite la présence d’ATP. Les inhibiteurs de tyrosine kinase, en se logeant dans le repli de la protéine destinée à recevoir normalement l’ATP (poche ATP), inhibent ainsi l’activité kinase (fig. 3A ).
Outre l’imatinib (1re génération), il existe les inhibiteurs de tyrosine kinase de 2e génération (nilotinib, dasatinib et bosutinib) et de 3e génération (ponatinib). En première ligne de traitement, il a été bien montré que les inhibiteurs de 2e génération permettaient d’obtenir des réponses cytogénétiques et moléculaires plus rapides en comparaison de l’imatinib. Toutefois, aucun impact sur la survie n’a été observé.1-3 Actuellement, bien que tous les inhibiteurs de tyrosine kinase de 2e génération aient obtenu une autorisation de mise sur le marché en première ligne, seuls le nilotinib et le bosutinib ont obtenu un prix de remboursement, autorisant leur prescription en première ligne.
Le traitement doit être instauré par un spécialiste et passe par la discussion du dossier en réunion de concertation pluridisciplinaire. Le choix de l’inhibiteur de tyrosine kinase en première ligne de traitement est guidé par l’âge du patient, la phase de la maladie (chronique ou accélérée), le score pronostique (Sokal et ELTS) et les comorbidités du patient. En effet, chaque inhibiteur a son propre spectre de possibles effets indésirables (tableau 1 ). Les effets indésirables non hématologiques sont généralement de faible intensité, accessibles à un traitement symptomatique.4 Ils peuvent, en revanche, impacter la qualité de vie des patients et avoir pour conséquence une mauvaise observance du traitement. Cependant, certains inhibiteurs de tyrosine kinase peuvent s’accompagner de complications cardiovasculaires ou pulmonaires pouvant être responsables de morbidité et plus exceptionnellement de mortalité. Une vigilance toute particulière doit donc être de mise en cas de comorbidités ou de facteurs de risque cardiovasculaire préexistants. De manière générale, l’initiation et le suivi d’un traitement par inhibiteurs de tyrosine kinase nécessitent un interrogatoire médical, précisant en particulier les antécédents et les traitements en cours, un examen clinique et la réalisation d’examens complémentaires. Quel que soit l’inhibiteur de tyrosine kinase utilisé, le suivi biologique comprend un hémogramme, les tests hépatiques et un bilan rénal et phosphocalcique. Chez les patients sous nilotinib, la surveillance de la lipasémie, de la glycémie et du profil lipidique est essentielle. L’utilisation du dasatinib et du bosutinib nécessite une surveillance pulmonaire régulière, dans le but de dépister au plus tôt la survenue d’un épanchement pleural. La réalisation d’un bilan cardiaque, avec une échographie cardiaque et un électrocardiogramme (ECG) avant l’introduction d’un inhibiteur de tyrosine kinase de 2e génération, est recommandée, de même que la réalisation d’un ECG sous traitement afin de vérifier l’absence d’allongement significatif de l’espace QT. Enfin, il convient d’être prudent vis-à-vis des médicaments associés ; en effet, les inhibiteurs de tyrosine kinase ont un métabolisme hépatique et sont des substrats et inhibiteurs majeurs du CYP3A4. Ils peuvent également inhiber d’autres isoenzymes du cytochrome P450.
Le pronostic à long terme est étroitement corrélé à la qualité de la réponse au traitement initial, établi par des consensus internationaux qui viennent d’être récemment actualisés.5 Alors que le diagnostic de la leucémie myéloïde chronique repose toujours sur la réalisation d’un bilan médullaire, le suivi de la réponse, sauf cas particuliers, peut se faire uniquement sur le sang (biologie moléculaire quantitative). Considérant l’efficacité attendue des inhibiteurs de tyrosine kinase et tenant compte des nouvelles modalités de suivi, les objectifs thérapeutiques et les critères de résistance ont été redéfinis, et ce, quelle que soit la ligne de traitement (première ou deuxième ligne) [tableau 2 ].
La réponse optimale maintenant attendue chez un patient est une réponse moléculaire profonde (BCR-ABL1 ≤ 0,01 % [IS*]), ce qui pourra, à moyen terme, le mettre en lisse d’un éventuel arrêt de traitement. Cependant, cet objectif peut être tempéré, notamment en fonction de l’âge du patient.
En cas de résistance, un bilan médullaire reste nécessaire et une recherche de mutation du domaine kinase d’ABL est indispensable. Un changement de l’inhibiteur de tyrosine kinase est alors proposé. Chez les patients porteurs d’une mutation, le degré de sensibilité aux inhibiteurs de tyrosine kinase des différents mutants déterminé in vitro peut guider le choix de l’inhibiteur de tyrosine kinase. En cas de mutation T315I, actuellement seul le ponatinib peut être efficace. L’allogreffe de cellules souches hématopoïétiques est réservée aux patients en échec d’un traitement par inhibiteurs de tyrosine kinase de 3e ligne, et aux patients ayant évolué vers la phase blastique.
Outre l’imatinib (1re génération), il existe les inhibiteurs de tyrosine kinase de 2e génération (nilotinib, dasatinib et bosutinib) et de 3e génération (ponatinib). En première ligne de traitement, il a été bien montré que les inhibiteurs de 2e génération permettaient d’obtenir des réponses cytogénétiques et moléculaires plus rapides en comparaison de l’imatinib. Toutefois, aucun impact sur la survie n’a été observé.1-3 Actuellement, bien que tous les inhibiteurs de tyrosine kinase de 2e génération aient obtenu une autorisation de mise sur le marché en première ligne, seuls le nilotinib et le bosutinib ont obtenu un prix de remboursement, autorisant leur prescription en première ligne.
Le traitement doit être instauré par un spécialiste et passe par la discussion du dossier en réunion de concertation pluridisciplinaire. Le choix de l’inhibiteur de tyrosine kinase en première ligne de traitement est guidé par l’âge du patient, la phase de la maladie (chronique ou accélérée), le score pronostique (Sokal et ELTS) et les comorbidités du patient. En effet, chaque inhibiteur a son propre spectre de possibles effets indésirables (
Le pronostic à long terme est étroitement corrélé à la qualité de la réponse au traitement initial, établi par des consensus internationaux qui viennent d’être récemment actualisés.5 Alors que le diagnostic de la leucémie myéloïde chronique repose toujours sur la réalisation d’un bilan médullaire, le suivi de la réponse, sauf cas particuliers, peut se faire uniquement sur le sang (biologie moléculaire quantitative). Considérant l’efficacité attendue des inhibiteurs de tyrosine kinase et tenant compte des nouvelles modalités de suivi, les objectifs thérapeutiques et les critères de résistance ont été redéfinis, et ce, quelle que soit la ligne de traitement (première ou deuxième ligne) [
La réponse optimale maintenant attendue chez un patient est une réponse moléculaire profonde (BCR-ABL1 ≤ 0,01 % [IS*]), ce qui pourra, à moyen terme, le mettre en lisse d’un éventuel arrêt de traitement. Cependant, cet objectif peut être tempéré, notamment en fonction de l’âge du patient.
En cas de résistance, un bilan médullaire reste nécessaire et une recherche de mutation du domaine kinase d’ABL est indispensable. Un changement de l’inhibiteur de tyrosine kinase est alors proposé. Chez les patients porteurs d’une mutation, le degré de sensibilité aux inhibiteurs de tyrosine kinase des différents mutants déterminé in vitro peut guider le choix de l’inhibiteur de tyrosine kinase. En cas de mutation T315I, actuellement seul le ponatinib peut être efficace. L’allogreffe de cellules souches hématopoïétiques est réservée aux patients en échec d’un traitement par inhibiteurs de tyrosine kinase de 3e ligne, et aux patients ayant évolué vers la phase blastique.
Inhibiteur allostérique
Une molécule au mécanisme d’action innovant est venue récemment enrichir l’arsenal thérapeutique pour des patients en échec des inhibiteurs de tyrosine kinase : l’asciminib. Il s’agit d’un inhibiteur allostérique de BCR-ABL1. Son mécanisme d’action est différent de celui des inhibiteurs de tyrosine kinase. Comme précédemment précisé, la translocation 9;22 conduit à une protéine chimérique dans laquelle ABL est amputée de son domaine « cap » et du groupe myristoyle, avec pour conséquence l’impossibilité de modification de la structure tertiaire de la protéine nécessaire à la régulation négative de son activité kinase (fig. 2 ). L’asciminib, par sa fixation à BCR-ABL1, rend possible ce changement de conformation et inhibe ainsi l’activité kinase (fig. 3 ). Le mécanisme d’autorégulation négative de l’activité kinase semble spécifique d’ABL et permet d’espérer une forte sélectivité de ce nouveau type d’inhibiteur et donc une meilleure tolérance clinique. Le développement clinique de la molécule débute en 2014 par une phase I d’escalade de dose, dont les résultats ont été publiés récemment.6 Les premiers patients traités étaient résistants à au moins deux inhibiteurs de tyrosine kinase. Le niveau de réponse obtenu a été tel que des patients ayant des mutations T315I ont par la suite été rapidement inclus. Les résultats de cette cohorte de patients, présentés au congrès de la Société américaine d’hématologie en décembre 2020, montrent que près d’un patient sur deux ayant obtenu une réponse significative (BCR-ABL1 < 0,1 % [IS]) a atteint une réponse moléculaire profonde. Cette étude a montré par ailleurs que la posologie efficace en cas de mutation T315I était plus élevée que celle utilisée pour les autres situations. La molécule est actuellement disponible, sous réserve d’acceptation, dans le cadre d’une autorisation temporaire d’utilisation (ATU) nominative selon deux schémas posologiques (présence ou non de la mutation T315I). Le profil de tolérance semble très favorable et peu différent quelle que soit la dose utilisée. Seuls une augmentation de la lipase, le plus souvent asymptomatique, et des rashs cutanés sont le plus fréquemment observés.
Arrêts de traitement
L’amélioration de l’espérance de vie observée dans la leucémie myéloïde chronique en phase chronique est à mettre, en partie, sur le compte des réponses moléculaires profondes observées sous inhibiteurs de tyrosine kinase. Chez certains patients a même été observée une indétectabilité prolongée de BCR-ABL1. Dans ces conditions, la question de l’arrêt de l’inhibiteur de tyrosine kinase s’est posée. La faisabilité de cette stratégie a été démontrée pour la première fois en 2010, et les résultats à 5 ans ont récemment été actualisés.7 Des patients adultes en phase chronique lors du diagnostic, ayant un transcrit BCR-ABL1 bien caractérisé et classique, traités par un inhibiteurs de tyrosine kinase de 1re ou de 2e génération pendant au moins 5 ans et en réponse optimale dès le début de leur histoire peuvent être candidats à une stratégie d’arrêt de traitement si leur réponse moléculaire est suffisamment profonde (BCR-ABL1 ≤ 0,0032 % [IS]) et stable depuis au moins 2 ans. Cependant, cette stratégie d’arrêt de traitement ne s’accompagne de succès que chez environ 50 % des patients et nécessite une surveillance clinique et par biologie moléculaire quantitative régulière, à vie, du fait de la possibilité connue de rechutes tardives et du manque de recul à très long terme.
* IS : international scale.
Encadre
L’association LMC France
Cette association, conçue en priorité pour les patients et les aidants, apporte des informations fiables et précises sur la maladie ainsi que des outils au service du patient, les événements autour de la LMC, des informations sur les progrès de la recherche, et l’agenda de l’année…
Vos patients trouveront toutes les réponses à leurs questions en naviguant sur ce site, en particulier, dans son « point info », des informations sur la vaccination contre la Covid-19 !
Références
1. Saglio G, Kim DW, Issaragrisil S, et al.; ENESTnd investigators. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med 2010;362:2251-9.
2. Jabbour E, Kantarjian HM, Saglio G, et al. Early response with dasatinib or imatinib in chronic myeloid leukemia: 3-year follow-up from a randomized phase 3 trial (DASISION). Blood 2014;123:494-500.
3. Cortes JE, Gambacorti-Passerini C, Deininger MW, et al. Bosutinib versus imatinib for newly diagnosed chronic myeloid leukemia: results from the randomized BFORE trial. J Clin Oncol 2018;36:231-7.
4. Steegmann JL, Baccarani M, Breccia M, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia 2016;30:1648-71.
5. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020;34:966-84.
6. Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019;381:2315-26.
7. Etienne G, Guilhot J, Rea D, et al. Long-term follow-up of the French Stop Imatinib (STIM1) study in patients with chronic myeloid leukemia. J Clin Oncol 2017;35:298-305.
2. Jabbour E, Kantarjian HM, Saglio G, et al. Early response with dasatinib or imatinib in chronic myeloid leukemia: 3-year follow-up from a randomized phase 3 trial (DASISION). Blood 2014;123:494-500.
3. Cortes JE, Gambacorti-Passerini C, Deininger MW, et al. Bosutinib versus imatinib for newly diagnosed chronic myeloid leukemia: results from the randomized BFORE trial. J Clin Oncol 2018;36:231-7.
4. Steegmann JL, Baccarani M, Breccia M, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia 2016;30:1648-71.
5. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020;34:966-84.
6. Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019;381:2315-26.
7. Etienne G, Guilhot J, Rea D, et al. Long-term follow-up of the French Stop Imatinib (STIM1) study in patients with chronic myeloid leukemia. J Clin Oncol 2017;35:298-305.

 Encadrés
Encadrés