Grâce aux avancées thérapeutiques des dernières décennies, et notamment l’immunothérapie, le pronostic des patients atteints de myélome multiple, qui reste hétérogène, s’est considérablement amélioré.
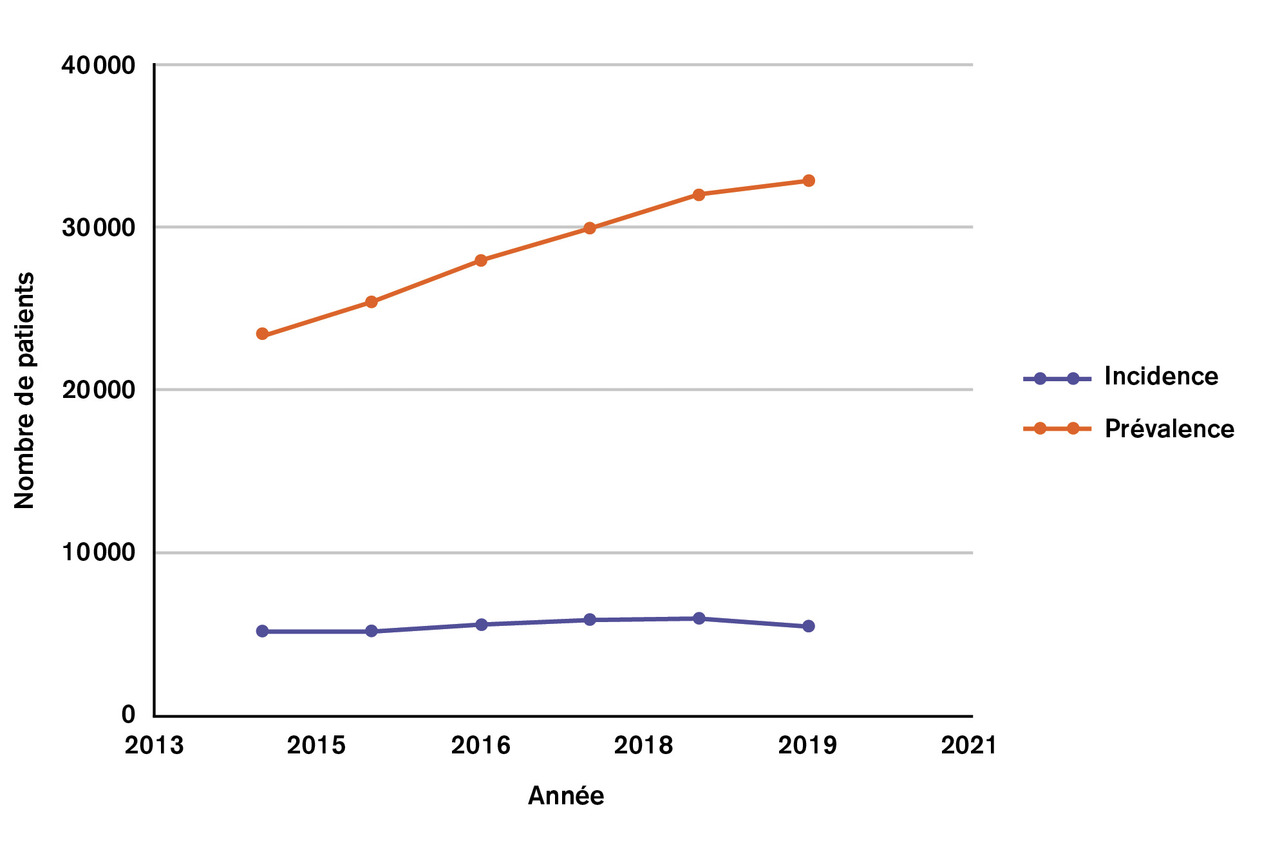
Le myélome multiple (MM) est une hémopathie maligne caractérisée par l’accumulation de plasmocytes tumoraux. Le clone tumoral sécrète une immunoglobuline monoclonale dont l’accumulation dans le sang, les urines et au niveau de certains organes (reins…) participe à la pathogénicité. Deuxième hémopathie maligne en incidence dans le monde occidental (15 % des diagnostics d’hémopathies malignes par an), elle représente environ 1 % de l’ensemble des cancers. Le myélome multiple touche principalement les sujets âgés, avec une médiane au diagnostic d’environ 70 ans. Sa prévalence a nettement augmenté depuis dix ans, du fait d’un diagnostic plus précoce, de l’amélioration des traitements proposés et de l’augmentation de l’espérance de vie (fig. 1 ). Un traitement est indiqué dès lors que le MM est symptomatique ou s’il présente des signes d’évolutivité (tableau 1 ) ; il n’a pas été démontré à ce jour d’intérêt à un traitement plus précoce au stade de MM asymptomatique ou indolent. Le MM reste en effet, dans la majorité des cas, une pathologie incurable dont la présentation et l’évolution peuvent être extrêmement différentes d’un patient à l’autre : le grand écart entre potentiel cancer mortel à court terme et maladie chronique est à prendre en compte dans la relation médecin-patient.
Une histoire riche en innovations thérapeutiques
La prise en charge des patients atteints de myélome multiple a considérablement évolué ces dernières décennies.
Traitement intensif supporté par l’autogreffe de cellules souches
L’intensification thérapeutique avec l’utilisation de hautes doses d’alkylants (dose myéloablative de melphalan), supportée par une autogreffe de cellules souches hématopoïétiques (ACSH) a été une avancée majeure dans les années 1980. Dix ans plus tard, l’étude multicentrique randomisée conduite par l’Intergroupe francophone du myélome (IFM) établit la supériorité de ce traitement intensif supporté par une ACSH chez les sujets de moins de 66 ans.1
Thalidomide et médicaments immunomodulateurs
Molécule anciennement indiquée comme sédatif et antinauséeux, le thalidomide avait été abandonné pour ses effets tératogènes. Il prend place dans le traitement du myélome multiple à la fin des années 1990, grâce à ses propriétés antiangiogénique et immunomodulatrice. D’abord évalué chez les patients en rechute, le thalidomide démontre une efficacité sans précédent, avec 30 % de taux de réponse.2 Il obtient ensuite une autorisation de mise sur le marché (AMM) en 2008 pour le traitement de première ligne.3
D’autres médicaments immunomodulateurs (ImiD, immunomodulatory drugs) ont été développés : le lénalidomide ou le pomalidomide. Les IMiD sont devenus un traitement de référence dans le MM, que ce soit chez les sujets non éligibles ou éligibles à l’intensification thérapeutique, tant en traitement d’induction que d’entretien.
D’autres médicaments immunomodulateurs (ImiD, immunomodulatory drugs) ont été développés : le lénalidomide ou le pomalidomide. Les IMiD sont devenus un traitement de référence dans le MM, que ce soit chez les sujets non éligibles ou éligibles à l’intensification thérapeutique, tant en traitement d’induction que d’entretien.
Inhibiteurs du protéasome
Les plasmocytes malins sécrètent une grande quantité d’immunoglobulines nécessitant un turn-over protéique important, ce qui rend les plasmocytes très sensibles à l’inhibition du protéasome.
Les inhibiteurs du protéasome (IP) ont donc modifié la prise en charge du myélome, avec le bortézomib comme chef de file. Ce médicament obtient une AMM européenne en 2004 pour le traitement des rechutes de myélome, puis en première ligne en 2008, en association avec le melphalan et la prednisone (VMP) chez les sujets inéligibles à l’intensification thérapeutique. Le bortézomib n’arrive en première ligne qu’en 2013, dans le traitement d’induction des patients éligibles à l’ACSH en association à la dexaméthasone avec ou sans thalidomide.
Actuellement, le triplet IMiD + IP + corticoïdes est devenu incontournable.
Les inhibiteurs du protéasome (IP) ont donc modifié la prise en charge du myélome, avec le bortézomib comme chef de file. Ce médicament obtient une AMM européenne en 2004 pour le traitement des rechutes de myélome, puis en première ligne en 2008, en association avec le melphalan et la prednisone (VMP) chez les sujets inéligibles à l’intensification thérapeutique. Le bortézomib n’arrive en première ligne qu’en 2013, dans le traitement d’induction des patients éligibles à l’ACSH en association à la dexaméthasone avec ou sans thalidomide.
Actuellement, le triplet IMiD + IP + corticoïdes est devenu incontournable.
L’ère des thérapies ciblées
Initiés par l’immunothérapie, les traitements ciblés ont déjà fait la preuve de leur efficacité, et la recherche reste active en la matière.
Anti-CD38 : premier grand succès de l’immunothérapie dans le myélome
Comme pour de nombreux cancers, l’immunothérapie contre le myélome multiple bénéficie d’un grand engouement.
Les anticorps monoclonaux anti-CD38 ont ouvert la voie, avec le daratumumab puis l’isatuximab. Le récepteur CD38 s’intègre dans des voies de signalisation régulant l’apoptose, la survie et la prolifération des plasmocytes. La fixation de l’anticorps sur le CD38 conduit à la destruction des plasmocytes par plusieurs processus : induction directe de l’apoptose et activation du système immunitaire (cytotoxicité dépendante du complément, cytotoxicité dépendante de l’anticorps, phagocytose).
Le daratumumab a montré une bonne efficacité en monothérapie chez les patients en rechute et réfractaires, avec un taux de réponse avoisinant les 30 %.4 Son indication a été ensuite étendue aux patients en première rechute, en association aux standards bortézomib-dexaméthasone (étude CASTOR, avec un bénéfice de survie sans progression [SSP] de 9,6 mois)5 ou lénalidomide-dexaméthasone (étude POLLUX, bénéfice de SSP de 27 mois)6. Son efficacité est telle qu’il a désormais sa place dès la première ligne dans deux situations :
– chez les patients non éligibles à l’intensification thérapeutique, en association avec lénalidomide-dexaméthasone (étude MAIA, avec une SSP à 60 mois de 52,5 % pour l’association daratumumab-lénalidomide-dexaméthasone versus 28,7 % pour lénalidomide-dexaméthasone) ou avec bortézomib-melphalan-prednisone (étude ALCYONE, avec un bénéfice de SSP de 17 mois) ;
– en traitement d’induction et de consolidation chez les patients éligibles à l’ACSH en association avec le schéma VTD (bortézomib-thalidomide-dexaméthasone) [étude CASSIOPEIA, avec une SSP à 18 mois de 93 % pour daratumumab-VTD versus 85 % pour VTD].
La forme sous-cutanée du daratumumab est une révolution d’un point de vue pratique et organisationnel : la durée d’administration a été réduite à cinq minutes (contre 7 heures pour la forme intraveineuse à la première perfusion, puis 3 heures pour les suivantes). Cette galénique reste pour l’instant limitée au milieu hospitalier en raison des contraintes de préparation et des possibles réactions d’hypersensibilité lors des premières injections.
L’arsenal thérapeutique contre le myélome s’est donc considérablement développé, offrant un vaste choix d’options thérapeutiques, que ce soit en première ligne ou à la rechute, pour les patients éligibles à la transplantation (TE, transplant eligible) ou non éligibles (TNE, transplant non-eligible). Les associations actuellement approuvées et remboursées en France sont nombreuses (tableau x 2 et 3).
Les anticorps monoclonaux anti-CD38 ont ouvert la voie, avec le daratumumab puis l’isatuximab. Le récepteur CD38 s’intègre dans des voies de signalisation régulant l’apoptose, la survie et la prolifération des plasmocytes. La fixation de l’anticorps sur le CD38 conduit à la destruction des plasmocytes par plusieurs processus : induction directe de l’apoptose et activation du système immunitaire (cytotoxicité dépendante du complément, cytotoxicité dépendante de l’anticorps, phagocytose).
Le daratumumab a montré une bonne efficacité en monothérapie chez les patients en rechute et réfractaires, avec un taux de réponse avoisinant les 30 %.4 Son indication a été ensuite étendue aux patients en première rechute, en association aux standards bortézomib-dexaméthasone (étude CASTOR, avec un bénéfice de survie sans progression [SSP] de 9,6 mois)5 ou lénalidomide-dexaméthasone (étude POLLUX, bénéfice de SSP de 27 mois)6. Son efficacité est telle qu’il a désormais sa place dès la première ligne dans deux situations :
– chez les patients non éligibles à l’intensification thérapeutique, en association avec lénalidomide-dexaméthasone (étude MAIA, avec une SSP à 60 mois de 52,5 % pour l’association daratumumab-lénalidomide-dexaméthasone versus 28,7 % pour lénalidomide-dexaméthasone) ou avec bortézomib-melphalan-prednisone (étude ALCYONE, avec un bénéfice de SSP de 17 mois) ;
– en traitement d’induction et de consolidation chez les patients éligibles à l’ACSH en association avec le schéma VTD (bortézomib-thalidomide-dexaméthasone) [étude CASSIOPEIA, avec une SSP à 18 mois de 93 % pour daratumumab-VTD versus 85 % pour VTD].
La forme sous-cutanée du daratumumab est une révolution d’un point de vue pratique et organisationnel : la durée d’administration a été réduite à cinq minutes (contre 7 heures pour la forme intraveineuse à la première perfusion, puis 3 heures pour les suivantes). Cette galénique reste pour l’instant limitée au milieu hospitalier en raison des contraintes de préparation et des possibles réactions d’hypersensibilité lors des premières injections.
L’arsenal thérapeutique contre le myélome s’est donc considérablement développé, offrant un vaste choix d’options thérapeutiques, que ce soit en première ligne ou à la rechute, pour les patients éligibles à la transplantation (TE, transplant eligible) ou non éligibles (TNE, transplant non-eligible). Les associations actuellement approuvées et remboursées en France sont nombreuses (
Vers de nouvelles thérapies ciblées
Le développement des anti-CD38, révolution dans la prise en charge du MM, a permis l’amélioration significative de la survie des patients. Ces résultats ont encouragé les laboratoires pharmaceutiques à chercher de nouvelles cibles pour le développement de médicaments. Parmi les molécules préférentiellement exprimées sur les plasmocytes, les récepteurs transmembranaires BCMA (B-cell maturation antigen) et GPRC5D (G-protein coupled receptor family C group 5 member D) sont les cibles qui suscitent le plus d’intérêt. Les traitements sont de plus en plus perfectionnés, avec l’apparition d’anticorps conjugués (bélantamab mafodotine dirigé contre BCMA), des CAR-T cells et d’anticorps bispécifiques.
Ces traitements sont évalués dans de nombreux essais cliniques pour les myélomes en rechute et multiréfractaires ; ils constituent un vecteur d’espoir pour les patients.
Ces thérapies présentent cependant des limites : longue durée de fabrication, absence de persistance des CAR-T cells dans l’organisme, difficulté à obtenir une réponse stable dans le temps, avec l’apparition de rechutes plus ou moins précoces.
Les premiers essais montrent des résultats très encourageants. Dans l’étude MajesTEC-1, le taux de réponse globale est de 62 % chez des patients avec une médiane de cinq lignes antérieures de traitement. Ce taux atteint les 67 à 70 % dans l’étude MonumenTAL-1 chez des patients penta-réfractaires et exposés aux trois classes de médicaments (IMiD, IP et anti-CD38).
Enfin, le sélinexor est un inhibiteur sélectif de l’exportine 1 (XPO1) ; il est indiqué en association avec la dexaméthasone dans les myélomes multiples, après au moins quatre lignes de traitement et lorsque la maladie est réfractaire à au moins deux IP, deux IMiD et un anti-CD38.8
Ces traitements sont évalués dans de nombreux essais cliniques pour les myélomes en rechute et multiréfractaires ; ils constituent un vecteur d’espoir pour les patients.
CAR-T cells : des résultats spectaculaires et quelques limites
Les deux CAR-T cells les plus avancées dans les essais cliniques actuellement sont le ciltacabtagène autoleucel (essais CARTITUDE) et l’idécabtagène vicleucel (essais KarMMa). Les lymphocytes T (LT) du patient (autologues) sont reprogrammés in vitro par transduction grâce à un lentivirus d’un récepteur chimérique (CAR) qui cible spécifiquement les cellules tumorales (ici, BCMA). Ce système perfectionné permet d’utiliser la propriété de reconnaissance d’un anticorps avec les fonctions performantes de cytotoxicité et de mémoire des LT du patient. Ces essais montrent des résultats parfois spectaculaires, avec une mise en rémission complète d’une partie des patients réfractaires à toutes les thérapies disponibles jusque-là. Ainsi, dans l’étude de phase I CARTITUDE-1, le taux de réponse globale atteignait 98 %, avec 80 % des patients en réponse complète stringente*.Ces thérapies présentent cependant des limites : longue durée de fabrication, absence de persistance des CAR-T cells dans l’organisme, difficulté à obtenir une réponse stable dans le temps, avec l’apparition de rechutes plus ou moins précoces.
Résultats encourageants pour les anticorps bispécifiques
Des anticorps bispécifiques ont été développés pour pallier les écueils des CAR-T cells ; ils ciblent d’une part le récepteur membranaire CD3 exprimé à la surface des lymphocytes T, d’autre part un antigène de surface plasmocytaire (par exemple, BCMA pour le téclistamab [essai MajesTEC-1] ou GPRC5D pour le talquétamab [essai MonumenTAL-1]). Le rapprochement du LT de sa cible lui permet d’exercer son action cytotoxique.Les premiers essais montrent des résultats très encourageants. Dans l’étude MajesTEC-1, le taux de réponse globale est de 62 % chez des patients avec une médiane de cinq lignes antérieures de traitement. Ce taux atteint les 67 à 70 % dans l’étude MonumenTAL-1 chez des patients penta-réfractaires et exposés aux trois classes de médicaments (IMiD, IP et anti-CD38).
Au-delà de l’immunothérapie
Le vénétoclax est un inhibiteur spécifique de la protéine antiapoptotique BCL2, déjà indiqué chez certains patients atteints de leucémie lymphoïde chronique ou de leucémie aiguë myéloïde. Dans le cadre du myélome, le vénétoclax a un intérêt particulier pour les patients dont les cellules portent une translocation t(11;14) car leur rapport d’expression BCL2/BCL2L1 est nettement augmenté.7 Ceci ouvre la voie aux traitements personnalisés selon le profil cytogénétique.Enfin, le sélinexor est un inhibiteur sélectif de l’exportine 1 (XPO1) ; il est indiqué en association avec la dexaméthasone dans les myélomes multiples, après au moins quatre lignes de traitement et lorsque la maladie est réfractaire à au moins deux IP, deux IMiD et un anti-CD38.8
Des progrès aussi dans l’évaluation de la réponse au traitement
Des techniques d’analyse toujours plus performantes permettent de détecter une activité résiduelle minime de la maladie, affinant ainsi l’évaluation des traitements.
Technique d’analyse de haute sensibilité au service de la surveillance
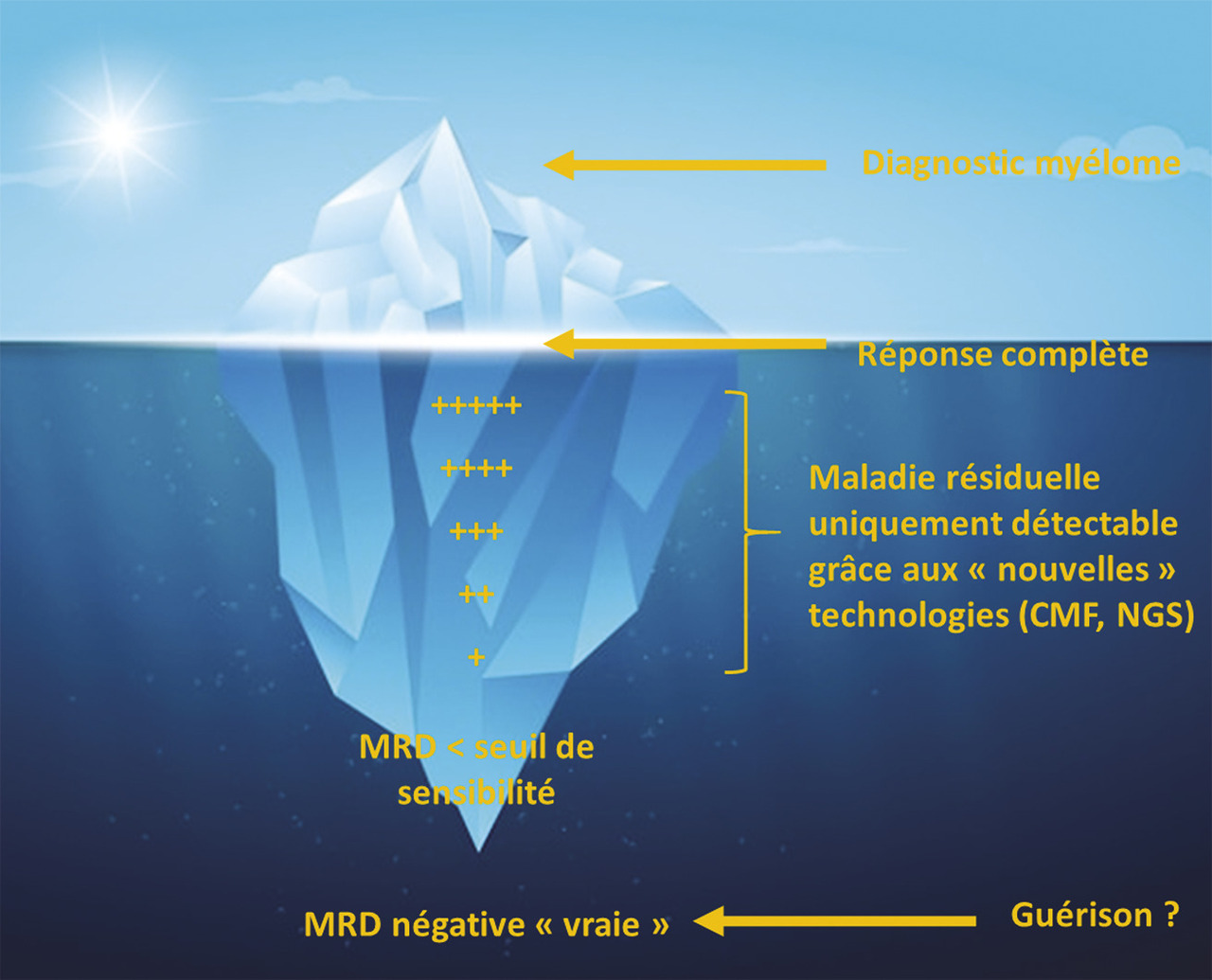
Avec l’amélioration des thérapeutiques, de nombreux patients parviennent à une réponse complète. Si le suivi de l’immunoglobuline monoclonale et l’examen cytologique médullaire restent nécessaires, les nouvelles techniques d’analyse (next-generation sequencing, ou cytométrie en flux de nouvelle génération) permettent d’évaluer la maladie résiduelle grâce à une haute sensibilité : jusqu’à 1 cellule tumorale détectée sur 1 million de cellules analysées (fig. 2 ).
La maladie résiduelle minimale, ou minimal residual disease (MRD), est définie par la persistance, dans le tissu examiné (la moelle osseuse pour le MM), de cellules malignes en dessous du seuil de détection par des techniques conventionnelles, au terme d’une séquence thérapeutique à visée éradicatrice.
La maladie résiduelle minimale, ou minimal residual disease (MRD), est définie par la persistance, dans le tissu examiné (la moelle osseuse pour le MM), de cellules malignes en dessous du seuil de détection par des techniques conventionnelles, au terme d’une séquence thérapeutique à visée éradicatrice.
Maladie résiduelle, un critère prometteur
Dans le myélome, l’obtention d’une MRD négative et durable dans le temps (sustained MRD) est corrélée à une amélioration de la survie sans progression (SSP) et de la survie globale (SG) ; cela en fait un très bon critère de jugement intermédiaire dans les essais cliniques pour accélérer la mise sur le marché des nouveaux traitements.
Au-delà de son intérêt pronostique et de son utilité dans l’évaluation de la réponse au traitement, la MRD pourrait également aider à la décision thérapeutique, notamment concernant l’interruption ou la poursuite des traitements chez des patients qui vivent de plus en plus longtemps avec la maladie.
Au-delà de son intérêt pronostique et de son utilité dans l’évaluation de la réponse au traitement, la MRD pourrait également aider à la décision thérapeutique, notamment concernant l’interruption ou la poursuite des traitements chez des patients qui vivent de plus en plus longtemps avec la maladie.
Personnaliser toujours plus le traitement
Grâce à un effort majeur de développement thérapeutique et de mise en place d’essais cliniques, un large choix de traitements existe aujourd’hui. L’arrivée des thérapies ciblées, comme les anti-CD38 en première ligne, a été un progrès incontestable. Pour preuve, les projections de l’étude CASSIOPEIA estiment que les premières données de survie globale médiane seront disponibles seulement en 2029 alors que les recrutements se sont terminés en 2018. Des molécules de nouvelle génération, différentes cibles et associations thérapeutiques sont par ailleurs testées à travers le monde pour optimiser les traitements.
L’amélioration de la survie des patients soulève de nouvelles problématiques puisque, pour certains, le myélome est devenu une pathologie « chronique ». Les patients vivent de plus en plus longtemps avec la maladie et certains traitements sont indiqués jusqu’à progression. Le médecin traitant prend alors une place prépondérante, en association avec l’hématologue, pour le suivi de la maladie (et la détection précoce des rechutes) d’une part et pour la prise en charge des effets indésirables et de la qualité de vie du patient d’autre part (tableau 4 ). L’observance au traitement est d’autant plus facile que l’impact sur la qualité de vie est limité (effets indésirables [diarrhée, neuropathie, infections], déplacements à l’hôpital pour l’administration des traitements...). La commercialisation de formes orales comme l’ixazomib (classe des IP) ou de formes sous-cutanées avec possible administration à domicile permet ainsi une plus grande liberté et limite les déplacements pour des patients parfois isolés.
Malgré tous les progrès énoncés, le myélome multiple reste une maladie le plus souvent incurable. Les réponses sont hétérogènes et l’amélioration de la survie variable d’un patient à un autre. Pour surmonter cette hétérogénéité pronostique et pouvoir envisager un jour la guérison de la majorité des patients, l’avenir est à la personnalisation du traitement, avec des essais cliniques fondés sur le risque cytogénétique ou sur la réponse thérapeutique (MRD).
L’amélioration de la survie des patients soulève de nouvelles problématiques puisque, pour certains, le myélome est devenu une pathologie « chronique ». Les patients vivent de plus en plus longtemps avec la maladie et certains traitements sont indiqués jusqu’à progression. Le médecin traitant prend alors une place prépondérante, en association avec l’hématologue, pour le suivi de la maladie (et la détection précoce des rechutes) d’une part et pour la prise en charge des effets indésirables et de la qualité de vie du patient d’autre part (
Malgré tous les progrès énoncés, le myélome multiple reste une maladie le plus souvent incurable. Les réponses sont hétérogènes et l’amélioration de la survie variable d’un patient à un autre. Pour surmonter cette hétérogénéité pronostique et pouvoir envisager un jour la guérison de la majorité des patients, l’avenir est à la personnalisation du traitement, avec des essais cliniques fondés sur le risque cytogénétique ou sur la réponse thérapeutique (MRD).
* NDLR : la rémission complète stringente correspond à une rémission complète avec un ratio de chaînes légères normal et un immunophénotypage plasmocytaire négatif.
Références
1. Attal M, Harousseau JL, Stoppa AM, Sotto JJ, Fuzibet JG, Rossi JF, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe français du myélome. N Engl J Med 1996;335:91-7. www.nejm.org/doi/full/10.1056/NEJM199607113350204.
2. Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddlemon P, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999;341:1565-71. https://www.nejm.org/doi/full/10.1056/nejm199911183412102.
3. Facon T, Mary JY, Hulin C, Benboubker L, Attal M, Pegourie B, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): a randomised trial. Lancet Lond Engl 2007;370:1209–18. https://www.medinews.it/bin/06_Facon_9906_Lancet_2007.pdf.
4. Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015;373:1207-19. https://www.nejm.org/doi/full/10.1056/nejmoa1506348.
5. Mateos M-V, Sonneveld P, Hungria V, Nooka AK, Estell JA, Barreto W, et al. Daratumumab, bortezomib, and dexamethasone versus bortezomib and dexamethasone in patients with previously treated multiple myeloma: Three-year follow-up of CASTOR. Clin Lymphoma Myeloma Leuk 2020;20:509-18. https://www.clinical-lymphoma-myeloma-leukemia.com/article/S2152-2650(19)32010-5/fulltext.
6. Bahlis NJ, Dimopoulos MA, White DJ, Benboubker L, Cook G, Leiba M, et al. Daratumumab plus lenalidomide and dexamethasone in relapsed/refractory multiple myeloma: extended follow-up of POLLUX, a randomized, open-label, phase 3 study. Leukemia 2020;34:1875-84. https://www.nature.com/articles/s41375-020-0711-6.
7. Kumar SK, Harrison SJ, Cavo M, de la Rubia J, Popat R, Gasparetto C, et al. Venetoclax or placebo in combination with bortezomib and dexamethasone in patients with relapsed or refractory multiple myeloma (BELLINI): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol 2020;21:1630-42.
8. Chari A, Vogl DT, Gavriatopoulou M, Nooka AK, Yee AJ, Huff CA, et al. Oral selinexor-dexamethasone for triple-class refractory multiple myeloma. N Engl J Med 2019;381:727-38. https://www.nejm.org/doi/full/10.1056/NEJMoa1903455.
9. Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos M-V, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15:e538-48.
Thalidomide : https://www.onco-occitanie.fr/oo/download/media/file/729
Lénalidomide : https://www.onco-occitanie.fr/oo/download/media/file/253
Pomalidomide : https://www.onco-occitanie.fr/oo/download/media/file/204
Ixazomib : https://www.onco-occitanie.fr/oo/download/media/file/2015
DaraRd : https://www.onco-occitanie.fr/oo/download/media/file/2019
DaraVTD : https://www.onco-occitanie.fr/oo/download/media/file/2775
KRd : https://www.onco-occitanie.fr/oo/download/media/file/2020
VRd : https://www.onco-occitanie.fr/oo/download/media/file/1895
VRd lite : https://www.onco-occitanie.fr/oo/download/media/file/1898
IxaRd : https://www.onco-occitanie.fr/oo/download/media/file/2018
https://www.onco-occitanie.fr/oo/download/media/file/2805
2. Singhal S, Mehta J, Desikan R, Ayers D, Roberson P, Eddlemon P, et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999;341:1565-71. https://www.nejm.org/doi/full/10.1056/nejm199911183412102.
3. Facon T, Mary JY, Hulin C, Benboubker L, Attal M, Pegourie B, et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): a randomised trial. Lancet Lond Engl 2007;370:1209–18. https://www.medinews.it/bin/06_Facon_9906_Lancet_2007.pdf.
4. Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015;373:1207-19. https://www.nejm.org/doi/full/10.1056/nejmoa1506348.
5. Mateos M-V, Sonneveld P, Hungria V, Nooka AK, Estell JA, Barreto W, et al. Daratumumab, bortezomib, and dexamethasone versus bortezomib and dexamethasone in patients with previously treated multiple myeloma: Three-year follow-up of CASTOR. Clin Lymphoma Myeloma Leuk 2020;20:509-18. https://www.clinical-lymphoma-myeloma-leukemia.com/article/S2152-2650(19)32010-5/fulltext.
6. Bahlis NJ, Dimopoulos MA, White DJ, Benboubker L, Cook G, Leiba M, et al. Daratumumab plus lenalidomide and dexamethasone in relapsed/refractory multiple myeloma: extended follow-up of POLLUX, a randomized, open-label, phase 3 study. Leukemia 2020;34:1875-84. https://www.nature.com/articles/s41375-020-0711-6.
7. Kumar SK, Harrison SJ, Cavo M, de la Rubia J, Popat R, Gasparetto C, et al. Venetoclax or placebo in combination with bortezomib and dexamethasone in patients with relapsed or refractory multiple myeloma (BELLINI): a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol 2020;21:1630-42.
8. Chari A, Vogl DT, Gavriatopoulou M, Nooka AK, Yee AJ, Huff CA, et al. Oral selinexor-dexamethasone for triple-class refractory multiple myeloma. N Engl J Med 2019;381:727-38. https://www.nejm.org/doi/full/10.1056/NEJMoa1903455.
9. Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos M-V, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15:e538-48.
Thalidomide : https://www.onco-occitanie.fr/oo/download/media/file/729
Lénalidomide : https://www.onco-occitanie.fr/oo/download/media/file/253
Pomalidomide : https://www.onco-occitanie.fr/oo/download/media/file/204
Ixazomib : https://www.onco-occitanie.fr/oo/download/media/file/2015
DaraRd : https://www.onco-occitanie.fr/oo/download/media/file/2019
DaraVTD : https://www.onco-occitanie.fr/oo/download/media/file/2775
KRd : https://www.onco-occitanie.fr/oo/download/media/file/2020
VRd : https://www.onco-occitanie.fr/oo/download/media/file/1895
VRd lite : https://www.onco-occitanie.fr/oo/download/media/file/1898
IxaRd : https://www.onco-occitanie.fr/oo/download/media/file/2018
https://www.onco-occitanie.fr/oo/download/media/file/2805