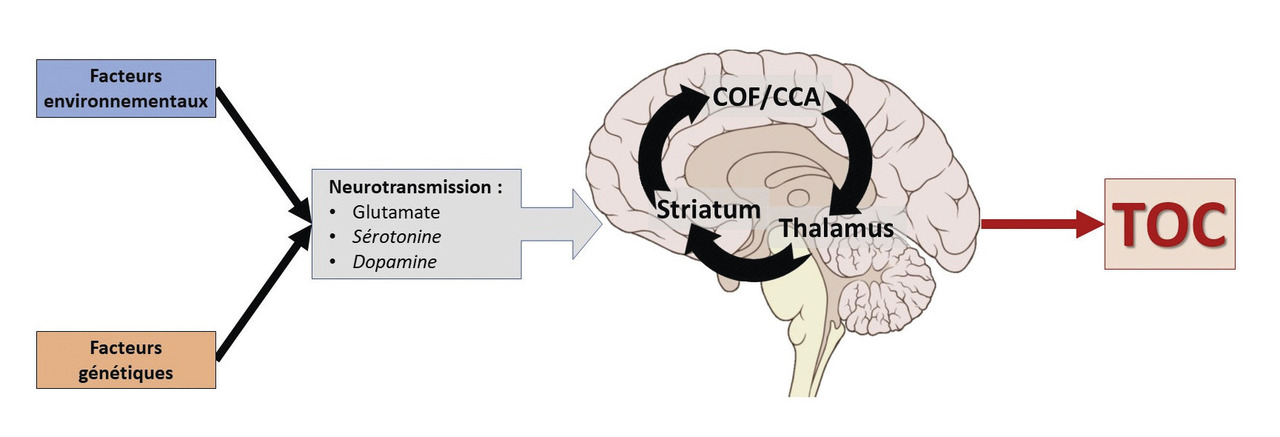
Le trouble obsessionnel-compulsif (TOC) se retrouve dans différentes populations étudiées à travers le monde, indépendamment donc du milieu culturel du patient.1 Ce qui suggère ainsi une implication de mécanismes neurobiologiques universels dans sa pathogenèse.
Hypothèse sérotoninergique
La sérotonine est une monoamine neuromodulatrice. Les neurones sérotoninergiques se situent dans les noyaux du raphé au niveau du tronc cérébral et se projettent vers l’ensemble des structures cortico-sous-corticales. La sérotonine joue un double rôle dans les réactions aux situations aversives : elle peut inhiber les réactions de combat ou de fuite face à une menace, tout en facilitant les manifestations anxieuses secondaires à l’anticipation de celle-ci. Ce double rôle couplé à l’efficacité des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) dans le traitement du TOC a contribué à la formulation de l’hypothèse d’une altération de ce système dans le TOC. Cependant, les recherches se sont révélées infructueuses tant sur le plan génétique (absence d’identification consistante de gènes impliqués dans ce système) que neurophysiologique. Sur ce dernier point, les premières études se sont attachées à mesurer des paramètres périphériques de la fonction sérotoninergique telles les concentrations plasmatique, intraplaquettaire et cérébrospinale en sérotonine ; avec une absence de différence relevée chez les patients souffrant de TOC comparés aux sujets sains ;2 à relativiser toutefois. En effet, le lien entre marqueurs périphériques, notamment plaquettaires, et les paramètres correspondant au niveau neuronal n’est pas évident.
C’est ainsi que des études plus récentes ont étudié ces derniers chez des patients naïfs de tout traitement, au niveau du système nerveux central, par le biais de la neuro-imagerie métabolique. Mais, là aussi, les recherches sont infructueuses, avec une grande inconsistance d’une étude à l’autre,3 révélant la complexité de ce trouble et l’impossibilité de le réduire à une hypothèse aussi simple. L’argument premier derrière ces recherches était l’efficacité des ISRS dans le traitement des TOC. Or, sans que le système sérotoninergique ne soit altéré, agir sur celui-ci pourrait compenser des dysfonctions dans d’autres systèmes cibles de sa modulation et ainsi expliquer l’efficacité des ISRS. De plus, cet argument est à tempérer quand on sait que plus d’un tiers des patients souffrant de ce trouble ne répondent pas à ces molécules.
C’est ainsi que des études plus récentes ont étudié ces derniers chez des patients naïfs de tout traitement, au niveau du système nerveux central, par le biais de la neuro-imagerie métabolique. Mais, là aussi, les recherches sont infructueuses, avec une grande inconsistance d’une étude à l’autre,3 révélant la complexité de ce trouble et l’impossibilité de le réduire à une hypothèse aussi simple. L’argument premier derrière ces recherches était l’efficacité des ISRS dans le traitement des TOC. Or, sans que le système sérotoninergique ne soit altéré, agir sur celui-ci pourrait compenser des dysfonctions dans d’autres systèmes cibles de sa modulation et ainsi expliquer l’efficacité des ISRS. De plus, cet argument est à tempérer quand on sait que plus d’un tiers des patients souffrant de ce trouble ne répondent pas à ces molécules.
Au-delà de la sérotonine
Le système dopaminergique
La dopamine est elle aussi une monoamine neuromodulatrice. Les neurones dopaminergiques sont majoritairement localisés au niveau de l’aire tegmentale ventrale et de la substance noire au sein du mésencéphale. Les neurones de l’aire tegmentale ventrale projettent vers les régions corticales préfrontales via la voie mésocorticale, jouant un rôle de régulation des fonctions exécutives, et vers le striatum ventral via la voie mésolimbique impliquée dans le traitement des récompenses, le renforcement positif et la motivation, entre autres. Les neurones dopaminergiques reçoivent des afférences sérotoninergiques exerçant une activité modulatrice sur eux. L’interaction existante entre ces deux systèmes est une des raisons de l’intérêt porté à la dopamine. D’autres arguments viennent à l’appui de son implication dans le TOC, comme l’identification dès les années 1960 de son rôle dans la genèse de comportements stéréotypés dans le cas de son dysfonctionnement ; ou encore la mise en évidence, dès les années 1980, de l’implication des régions striatales (à forte innervation dopaminergique) dans la physiopathologie du TOC. L’efficacité chez environ 30 % des patients ayant un TOC résistant aux ISRS de stratégies de potentialisation reposant sur l’emploi des antipsychotiques atypiques est aussi un argument (faible du fait de leur action sérotoninergique en sus du blocage dopaminergique) en faveur de son implication.
Ainsi, des études se sont attelées à mesurer des marqueurs périphériques de ce système de neurotransmission. Cependant, le très faible nombre d’études réalisées ne permet pas de conclure à une dysfonction du système dopaminergique,4 ce d’autant plus qu’il existe une inconsistance entre celles-ci. Sachant que les marqueurs périphériques ne sont pas de bons indicateurs de l’échelon neuronal, des études en neuro-imagerie métabolique ont été menées chez des patients naïfs de tout traitement ; ce sans résultat probant.4 Il n’est ainsi pas possible de conclure quant à l’implication du système dopaminergique dans la physiopathologie du TOC. Ajoutée à cela l’absence de mise en évidence de gènes impliqués dans ce système, cette hypothèse se voit d’autant plus affaiblie. Considérant de plus la forte proportion de patients ne répondant ni aux traitements sérotoninergiques ni aux stratégies d’augmentation par antipsychotique se pose la question de l’implication d’un autre système dans la physiopathologie du TOC.
Ainsi, des études se sont attelées à mesurer des marqueurs périphériques de ce système de neurotransmission. Cependant, le très faible nombre d’études réalisées ne permet pas de conclure à une dysfonction du système dopaminergique,4 ce d’autant plus qu’il existe une inconsistance entre celles-ci. Sachant que les marqueurs périphériques ne sont pas de bons indicateurs de l’échelon neuronal, des études en neuro-imagerie métabolique ont été menées chez des patients naïfs de tout traitement ; ce sans résultat probant.4 Il n’est ainsi pas possible de conclure quant à l’implication du système dopaminergique dans la physiopathologie du TOC. Ajoutée à cela l’absence de mise en évidence de gènes impliqués dans ce système, cette hypothèse se voit d’autant plus affaiblie. Considérant de plus la forte proportion de patients ne répondant ni aux traitements sérotoninergiques ni aux stratégies d’augmentation par antipsychotique se pose la question de l’implication d’un autre système dans la physiopathologie du TOC.
Importance du système glutamatergique
Le glutamate est un acide aminé représentant le principal neurotransmetteur excitateur du système nerveux central. Les neurones glutamatergiques se retrouvent dans l’ensemble du cerveau et sont constitutifs des différents circuits cérébraux. Le glutamate est le support de la transmission de l’information et sous-tend des processus cruciaux tels que la plasticité synaptique, l’apprentissage et la mémorisation.
Le TOC se caractérise par une dysfonction de la boucle cortico-striato-thalamo-corticale (CSTC) avec hyperactivation de ses composantes cortico-striatales. Or le glutamate est le principal neurotransmetteur de ce circuit. De plus, les études menées sur la génétique du TOC pointent avec consistance vers l’implication de gènes du système glutamatergique.5 C’est ainsi qu’un nombre croissant d’études s’intéresse à ce système dans le TOC ; ce d’autant plus que de récentes recherches cliniques tendent à montrer l’efficacité des traitements anti-glutamatergiques dans le traitement du TOC.6
Il a ainsi pu être montré une concentration du glutamate plus élevée au niveau du liquide cérébrospinal mais chez une partie seulement de patients souffrant de TOC comparés aux sujets sains.7 Mais des études en spectroscopie par résonance magnétique menées dans le but de mesurer in situ la concentration cérébrale en glutamate n’ont pas retrouvé de différence quelle que soit la région cérébrale d’intérêt.8
Ainsi, bien qu’il existe des arguments, notamment génétiques, en faveur d’une dysfonction glutamatergique dans le TOC, les études tentant d’évaluer directement la fonction glutamatergique chez l’humain ne permettent pas encore de conforter cette hypothèse en raison de certaines limites techniques (difficulté d’isoler le signal du glutamate de celui d’autres molécules entre autres). Cependant, des études plus fondamentales apportent des résultats en faveur d’une telle dysfonction, avec des modèles animaux de comportements compulsifs reposant sur une altération spécifique du système glutamatergique.9
Le TOC se caractérise par une dysfonction de la boucle cortico-striato-thalamo-corticale (CSTC) avec hyperactivation de ses composantes cortico-striatales. Or le glutamate est le principal neurotransmetteur de ce circuit. De plus, les études menées sur la génétique du TOC pointent avec consistance vers l’implication de gènes du système glutamatergique.5 C’est ainsi qu’un nombre croissant d’études s’intéresse à ce système dans le TOC ; ce d’autant plus que de récentes recherches cliniques tendent à montrer l’efficacité des traitements anti-glutamatergiques dans le traitement du TOC.6
Il a ainsi pu être montré une concentration du glutamate plus élevée au niveau du liquide cérébrospinal mais chez une partie seulement de patients souffrant de TOC comparés aux sujets sains.7 Mais des études en spectroscopie par résonance magnétique menées dans le but de mesurer in situ la concentration cérébrale en glutamate n’ont pas retrouvé de différence quelle que soit la région cérébrale d’intérêt.8
Ainsi, bien qu’il existe des arguments, notamment génétiques, en faveur d’une dysfonction glutamatergique dans le TOC, les études tentant d’évaluer directement la fonction glutamatergique chez l’humain ne permettent pas encore de conforter cette hypothèse en raison de certaines limites techniques (difficulté d’isoler le signal du glutamate de celui d’autres molécules entre autres). Cependant, des études plus fondamentales apportent des résultats en faveur d’une telle dysfonction, avec des modèles animaux de comportements compulsifs reposant sur une altération spécifique du système glutamatergique.9
Au cœur du TOC : la boucle orbito-fronto-striatale
Dès les années 1980, des études reposant sur l’analyse de l’activité métabolique cérébrale ont montré des activations anormales des différentes structures composant la boucle CSTC ; notamment au niveau des cortex orbitofrontal, cingulaire antérieur et du noyau caudé.10 Se fondant sur ces résultats d’imagerie fonctionnelle, les études structurelles en imagerie par résonance magnétique (IRM)11 ont trouvé ainsi une altération du volume de ces régions chez les patients souffrant de TOC. Bien que confirmant l’implication des boucles orbitofrontale et cingulaire antérieure dans la pathogenèse du TOC, ces études ont cependant une limitation majeure reposant sur la sélection a priori des régions cérébrales ne permettant pas l’identification d’autres structures potentiellement impliquées dans le trouble.
Au-delà de cette boucle, un réseau bien plus large impliqué
Ces résultats en imagerie métabolique et structurelle pointant vers une dysfonction de la boucle CSTC, et plus précisément de sa composante orbitofrontale, se sont vus confirmés par des études plus récentes en IRM fonctionnelle (IRMf), mais surtout complétés, avec l’identification de structures extérieures à cette boucle tels les cortex frontal latéral, cingulaire, occipital, pariétal, et même le cervelet.12 Plus récemment, il a également pu être souligné l'implication de l'amygdale dans le TOC13. Ces résultats pointent ainsi vers l'implication d'un réseau cérébral plus large que la seule boucle orbito-fronto-striatale classiquement mise en évidence. Cette atteinte d’un réseau frontopariétal est notamment étayée par les études de connectivité fonctionnelle en IRMf de repos,14 avec mise en évidence d’une hypoconnectivité dans le TOC au sein et entre les réseaux frontopariétal, de saillance (comprenant, entre autres, les cortex insulaire et cingulaire antérieurs) et du mode par défaut (constitué des lobe temporal médian, cortex préfrontal médian, cortex cingulaire postérieur, entre autres). Des études d’imagerie structurelle en « cerveau entier » (fondées sur des techniques IRM de morphométrie et d’analyse de l’épaisseur corticale) ont pu confirmer ces résultats en montrant des altérations de la substance grise au niveau de ces régions.15 Enfin, des études de tractographie vont aussi dans ce sens en révélant des altérations des faisceaux de substance blanche dans le TOC au sein du cortex cingulaire antérieur et du cortex orbitofrontal ; mais aussi au sein des faisceaux reliant le cortex préfrontal aux cortex associatifs pariétal et occipital16.
Synthèse
L’ensemble de ces données confirme donc le rôle central dans la physiopathologie du TOC de la boucle orbito-fronto-striatale et de ses connections aux structures limbiques tels le cortex cingulaire antérieur et l’amygdale (v . figure
Le cortex orbitofrontal est une structure clé dans l’adaptation flexible des comportements dirigés vers un but. Le cortex cingulaire antérieur (dans sa composante dorsale) est quant à lui responsable (entre autres) du monitorage de l’action et de la détection des conflits cognitifs/erreurs. L’amygdale, enfin, est une structure clé dans la gestion des émotions et plus spécifiquement de l’anxiété et de la peur. On voit ainsi comment une atteinte de ces différentes structures peut mener aux différents symptômes du TOC : altération des comportements dirigés vers un but (cortex orbitofrontal), doute pathologique (cortex cingulaire antérieur) et réponse émotionnelle pathologique (amygdale).
Ces données amènent aussi à considérer d’autres structures cérébrales, au premier rang desquelles le réseau frontopariétal. Ce réseau sous-tend les fonctions exécutives et, par extension, les comportements dirigés vers un but. Il est de surcroît en interaction constante avec au moins deux autres réseaux que sont les réseaux du mode par défaut et de saillance. Tandis que le réseau du mode par défaut est le support des processus mentaux en jeu en l’absence de focalisation sur le monde extérieur (penser au passé ou à l’avenir par exemple, divagations, rêveries…), le réseau de saillance assure la transition entre ce dernier et le réseau frontopariétal en cas de détection d’un stimulus environnemental suffisamment pertinent pour s’y focaliser et potentiellement agir. Ainsi, les différentes altérations rapportées au sein et entre ces réseaux iraient dans le sens d’une difficulté à défocaliser l’attention du « monde intérieur » (les pensées obsessionnelles) au détriment d’une adaptation des comportements aux sollicitations de l’environnement, ce qui serait cohérent avec la phénoménologie du TOC ; les patients ayant des difficultés à s’extraire de leurs pensées obsessionnelles pour adapter leur comportement aux demandes de l’environnement.
Le cortex orbitofrontal est une structure clé dans l’adaptation flexible des comportements dirigés vers un but. Le cortex cingulaire antérieur (dans sa composante dorsale) est quant à lui responsable (entre autres) du monitorage de l’action et de la détection des conflits cognitifs/erreurs. L’amygdale, enfin, est une structure clé dans la gestion des émotions et plus spécifiquement de l’anxiété et de la peur. On voit ainsi comment une atteinte de ces différentes structures peut mener aux différents symptômes du TOC : altération des comportements dirigés vers un but (cortex orbitofrontal), doute pathologique (cortex cingulaire antérieur) et réponse émotionnelle pathologique (amygdale).
Ces données amènent aussi à considérer d’autres structures cérébrales, au premier rang desquelles le réseau frontopariétal. Ce réseau sous-tend les fonctions exécutives et, par extension, les comportements dirigés vers un but. Il est de surcroît en interaction constante avec au moins deux autres réseaux que sont les réseaux du mode par défaut et de saillance. Tandis que le réseau du mode par défaut est le support des processus mentaux en jeu en l’absence de focalisation sur le monde extérieur (penser au passé ou à l’avenir par exemple, divagations, rêveries…), le réseau de saillance assure la transition entre ce dernier et le réseau frontopariétal en cas de détection d’un stimulus environnemental suffisamment pertinent pour s’y focaliser et potentiellement agir. Ainsi, les différentes altérations rapportées au sein et entre ces réseaux iraient dans le sens d’une difficulté à défocaliser l’attention du « monde intérieur » (les pensées obsessionnelles) au détriment d’une adaptation des comportements aux sollicitations de l’environnement, ce qui serait cohérent avec la phénoménologie du TOC ; les patients ayant des difficultés à s’extraire de leurs pensées obsessionnelles pour adapter leur comportement aux demandes de l’environnement.
Références
1. Fontenelle LF, Mendlowicz MV, Marques C, Versiani M. Trans-cultural aspects of obsessive–compulsive disorder: a description of a Brazilian sample and a systematic review of international clinical studies. J. Psychiatr Res 2004;38:403-11.
2. Westenberg HGM, Fineberg NA, Denys D. Neurobiology of obsessive-compulsive disorder: serotonin and beyond. CNS Spectr 2007;12:14-27.
3. Maron E, Nutt D, Shlik J. Neuroimaging of serotonin system in anxiety disorders. Curr Pharm Des 2012;18:5699-708.
4. Koo MS, Kim EJ, Roh D, Kim CH. Role of dopamine in the pathophysiology and treatment of obsessive–compulsive disorder. Expert Rev Neurother 2010;10:275-90.
5. Bozorgmehr A, Ghadirivasfi M, Shahsavand Ananloo E. Obsessive–compulsive disorder, which genes? Which functions? Which pathways? An integrated holistic view regarding OCD and its complex genetic etiology. J Neurogenet 2017;31:153-60.
6. Marinova Z, Chuang DM, Fineberg N. Glutamate-modulating drugs as a potential therapeutic strategy in obsessive-compulsive disorder. Curr Neuropharmacol 2017;15:977-95.
7. Chakrabarty K, Bhattacharyya S, Christopher R, Khanna S. Glutamatergic dysfunction in OCD. Neuropsychopharmacology 2005;30:1735-40.
8. Brennan BP, Rauch SL, Jensen JE, Pope HG. A critical review of magnetic resonance spectroscopy studies of obsessive-compulsive disorder. Biol Psychiatry 2013;73:24-31.
9. Kariuki-Nyuthe C, Gomez-Mancilla B, Stein, D. Obsessive compulsive disorder and the glutamatergic system. Curr Opin Psychiatry 2014;27:32-7.
10. Whiteside SP, Port JD, Abramowitz JS. A meta–analysis of functional neuroimaging in obsessive–compulsive disorder. Psychiatry Res Neuroimaging 2004;132:69-79.
11. Rotge JY, Guehl D, Dilharreguy B, et al. Meta-analysis of brain volume changes in obsessive-compulsive disorder. Biol Psychiatry 2009;65:75-83.
12. Menzies L, Chamberlain SR, Laird AR, et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: the orbitofronto-striatal model revisited. Neurosci Biobehav Rev 2008;32:525-49.
13. Thorsen AL, Hagland P, Radua J, et al. Emotional processing in obsessive-compulsive disorder: a systematic review and meta-analysis of 25 functional neuroimaging studies. Biol. Psychiatry Cogn. Neurosci Neuroimaging 2018;3:563-71.
14. Gürsel DA, Avram M, Sorg C, et al. Frontoparietal areas link impairments of large-scale intrinsic brain networks with aberrant fronto-striatal interactions in OCD: a meta-analysis of resting-state functional connectivity. Neurosci Biobehav Rev 2018;87:151-60.
15. de Wit SJ, Alonso P, Schweren L, et al. Multicenter voxel-based morphometry mega-analysis of structural brain scans in obsessive-compulsive disorder. Am J Psychiatry 2014;171:340-9.
16. Piras F, Piras F, Caltagirone C, Spalletta G. Brain circuitries of obsessive compulsive disorder: A systematic review and meta-analysis of diffusion tensor imaging studies. Neurosci Biobehav Rev 2013;37:2856-77.
2. Westenberg HGM, Fineberg NA, Denys D. Neurobiology of obsessive-compulsive disorder: serotonin and beyond. CNS Spectr 2007;12:14-27.
3. Maron E, Nutt D, Shlik J. Neuroimaging of serotonin system in anxiety disorders. Curr Pharm Des 2012;18:5699-708.
4. Koo MS, Kim EJ, Roh D, Kim CH. Role of dopamine in the pathophysiology and treatment of obsessive–compulsive disorder. Expert Rev Neurother 2010;10:275-90.
5. Bozorgmehr A, Ghadirivasfi M, Shahsavand Ananloo E. Obsessive–compulsive disorder, which genes? Which functions? Which pathways? An integrated holistic view regarding OCD and its complex genetic etiology. J Neurogenet 2017;31:153-60.
6. Marinova Z, Chuang DM, Fineberg N. Glutamate-modulating drugs as a potential therapeutic strategy in obsessive-compulsive disorder. Curr Neuropharmacol 2017;15:977-95.
7. Chakrabarty K, Bhattacharyya S, Christopher R, Khanna S. Glutamatergic dysfunction in OCD. Neuropsychopharmacology 2005;30:1735-40.
8. Brennan BP, Rauch SL, Jensen JE, Pope HG. A critical review of magnetic resonance spectroscopy studies of obsessive-compulsive disorder. Biol Psychiatry 2013;73:24-31.
9. Kariuki-Nyuthe C, Gomez-Mancilla B, Stein, D. Obsessive compulsive disorder and the glutamatergic system. Curr Opin Psychiatry 2014;27:32-7.
10. Whiteside SP, Port JD, Abramowitz JS. A meta–analysis of functional neuroimaging in obsessive–compulsive disorder. Psychiatry Res Neuroimaging 2004;132:69-79.
11. Rotge JY, Guehl D, Dilharreguy B, et al. Meta-analysis of brain volume changes in obsessive-compulsive disorder. Biol Psychiatry 2009;65:75-83.
12. Menzies L, Chamberlain SR, Laird AR, et al. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: the orbitofronto-striatal model revisited. Neurosci Biobehav Rev 2008;32:525-49.
13. Thorsen AL, Hagland P, Radua J, et al. Emotional processing in obsessive-compulsive disorder: a systematic review and meta-analysis of 25 functional neuroimaging studies. Biol. Psychiatry Cogn. Neurosci Neuroimaging 2018;3:563-71.
14. Gürsel DA, Avram M, Sorg C, et al. Frontoparietal areas link impairments of large-scale intrinsic brain networks with aberrant fronto-striatal interactions in OCD: a meta-analysis of resting-state functional connectivity. Neurosci Biobehav Rev 2018;87:151-60.
15. de Wit SJ, Alonso P, Schweren L, et al. Multicenter voxel-based morphometry mega-analysis of structural brain scans in obsessive-compulsive disorder. Am J Psychiatry 2014;171:340-9.
16. Piras F, Piras F, Caltagirone C, Spalletta G. Brain circuitries of obsessive compulsive disorder: A systematic review and meta-analysis of diffusion tensor imaging studies. Neurosci Biobehav Rev 2013;37:2856-77.