Objectifs thérapeutiques
Malgré la multiplicité des traitements disponibles, de très nombreux patients ne bénéficient pas des options thérapeutiques qui leur permettraient d’obtenir une rémission complète de leur maladie. Ainsi, il existe, malheureusement, souvent une inadéquation entre la sévérité de la maladie et les traitements proposés. L’étude MAPP incluant 3 426 patients atteints de psoriasis au niveau international (États-Unis, Canada, France, Allemagne, Italie, Espagne, Grande-Bretagne) illustrait cette discordance en objectivant que seulement 10 % des patients ayant une surface cutanée atteinte supérieure à 10 % étaient sous traitement par voie générale, et que seulement 41 % des patients atteints de rhumatisme psoriasique étaient sous traitement systémique.3
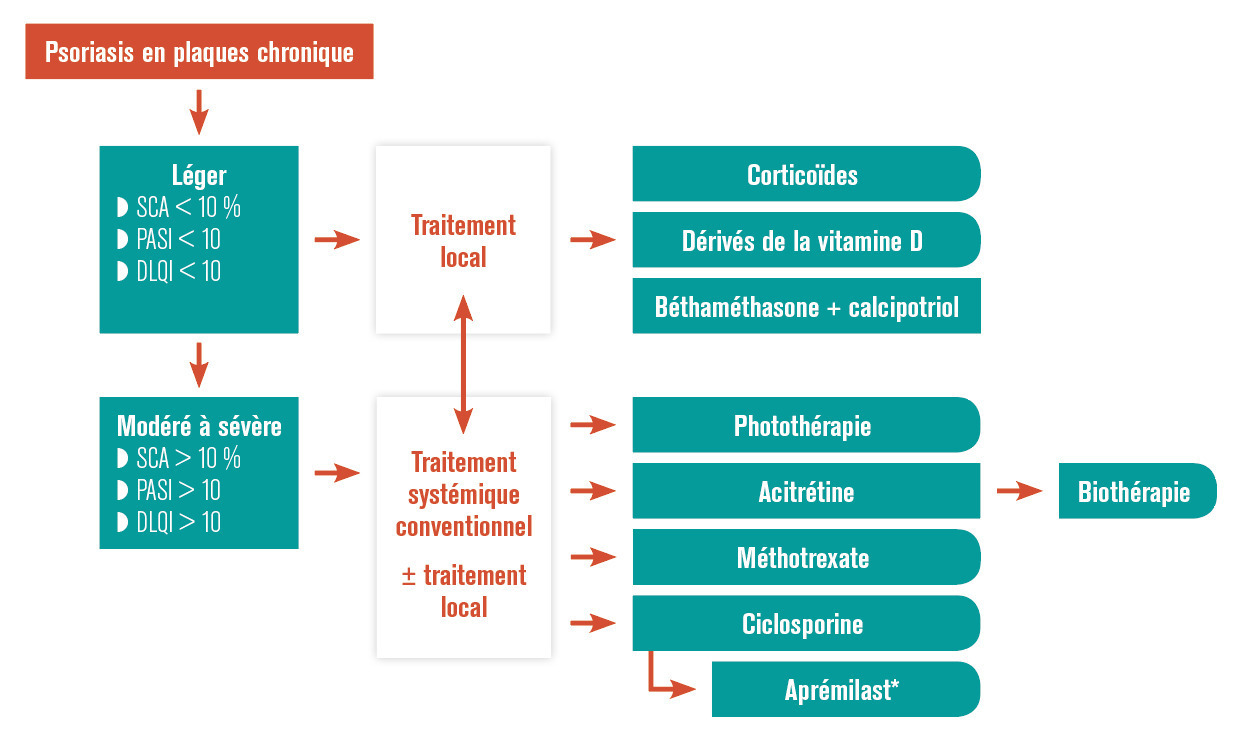
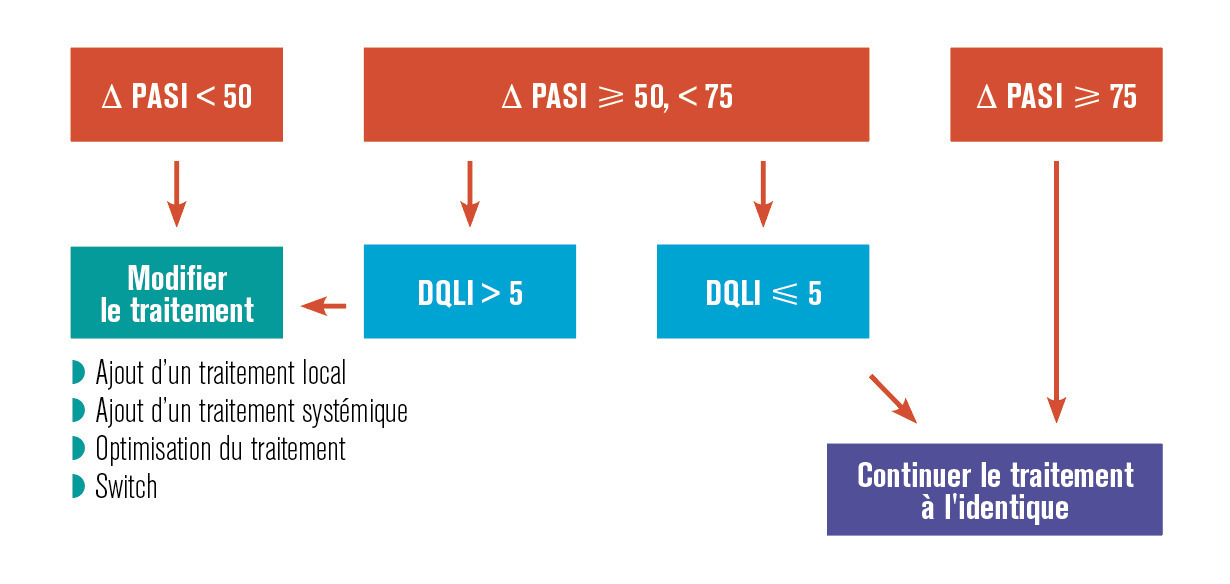
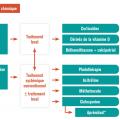
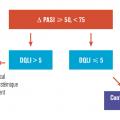
La sévérité du psoriasis est de manière consensuelle définie en trois stades : léger, modéré et sévère. Cette évaluation étant fondée sur la surface cutanée atteinte par le psoriasis, un score composite de sévérité, le psoriasis area and severity index (PASI) et l’impact sur la qualité de vie estimé par le dermatology life quality index (DLQI). En cas de score PASI supérieur à 10 et/ou de surface cutanée atteinte supérieure à 10 % et/ou de score DLQI supérieur à 10 (v. p. 966), le psoriasis est considéré comme de stade modéré à sévère et peut de ce fait justifier un traitement par voie générale.4, 5 Dans le cas contraire, et sauf cas particulier (atteinte sévère des ongles, lésions très affichantes...), un traitement local doit être proposé (fig. 1).
Traitements locaux
Dermocorticoïdes
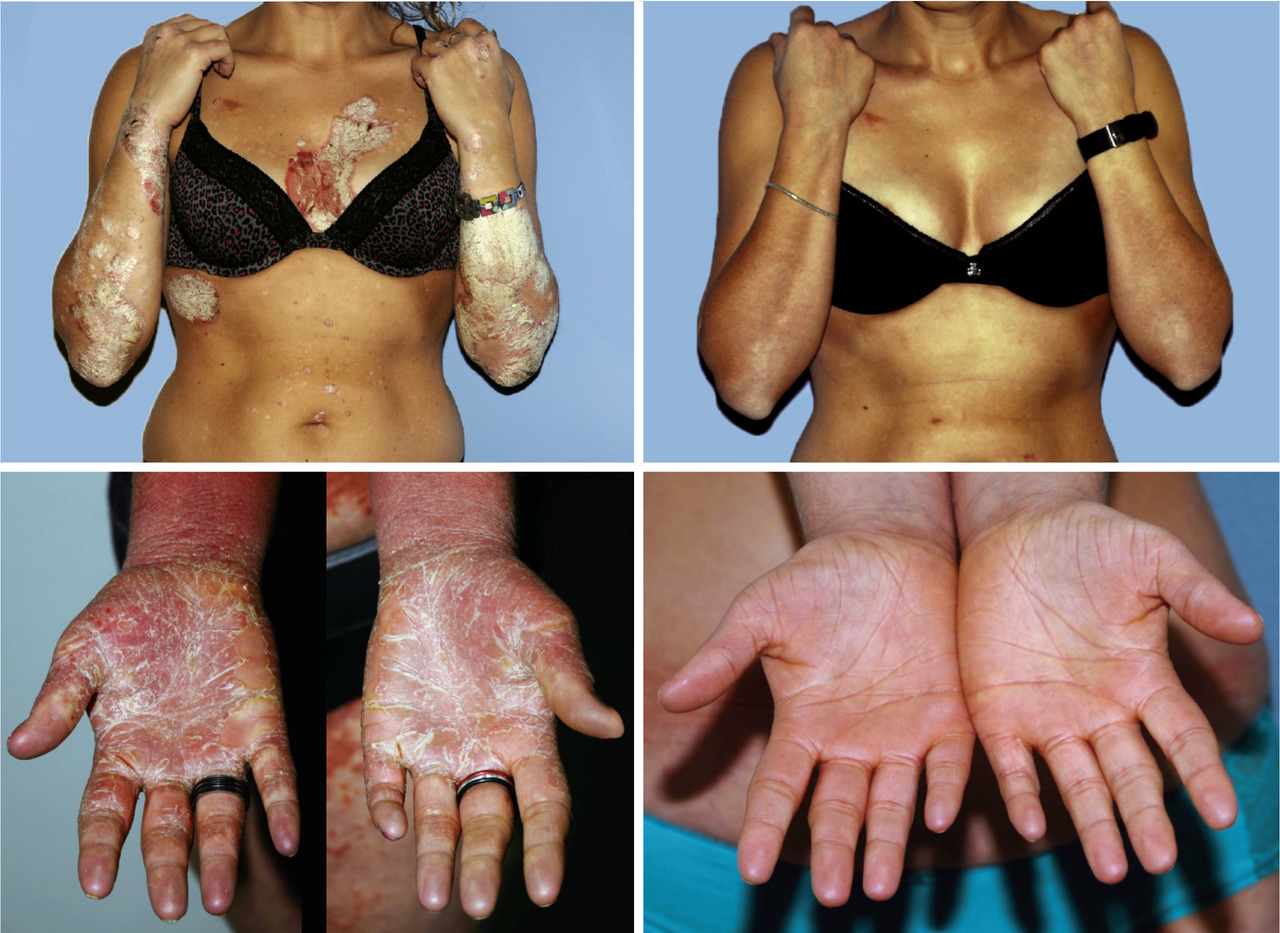
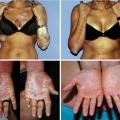
Cas particulier de l’atteinte unguéale
Traitements systémiques conventionnels
Photothérapie
Acitrétine
Méthotrexate
Ciclosporine
Inhibiteurs de la phosphodiestérase
Biothérapies
Le bilan préthérapeutique doit comporter (v. tableau) :
– un examen clinique complet, à la recherche notamment d’élément en faveur d’une néoplasie cutanée ou d’autre origine ;
– la recherche de signes en faveur d’une infection active ou ancienne ; radiographie pulmonaire, sérologie pour les virus de l’immunodéficience humaine et les hépatites B et C ; dépistage de la tuberculose (intradermoréaction ou dosage du QuantiFeron), examen dentaire ; les autres examens complémentaires se discutant en fonction des points d’appel cliniques ;
– la recherche d’un antécédent personnel ou familial de sclérose en plaques (contre-indiquant les anti-TNFα), de maladie inflammatoire intestinale (contre-indiquant les anti-IL-17) ou de cancer dans les 5 ans (contre-indiquant toutes les biothérapies) ;
– la vérification des vaccinations ; les vaccinations antipneumococcique et antigrippale sont recommandées ; les vaccins vivants sont contre-indiqués sous biothérapies (fièvre jaune, rougeole-oreillons-rubéole, BCG, varicelle).
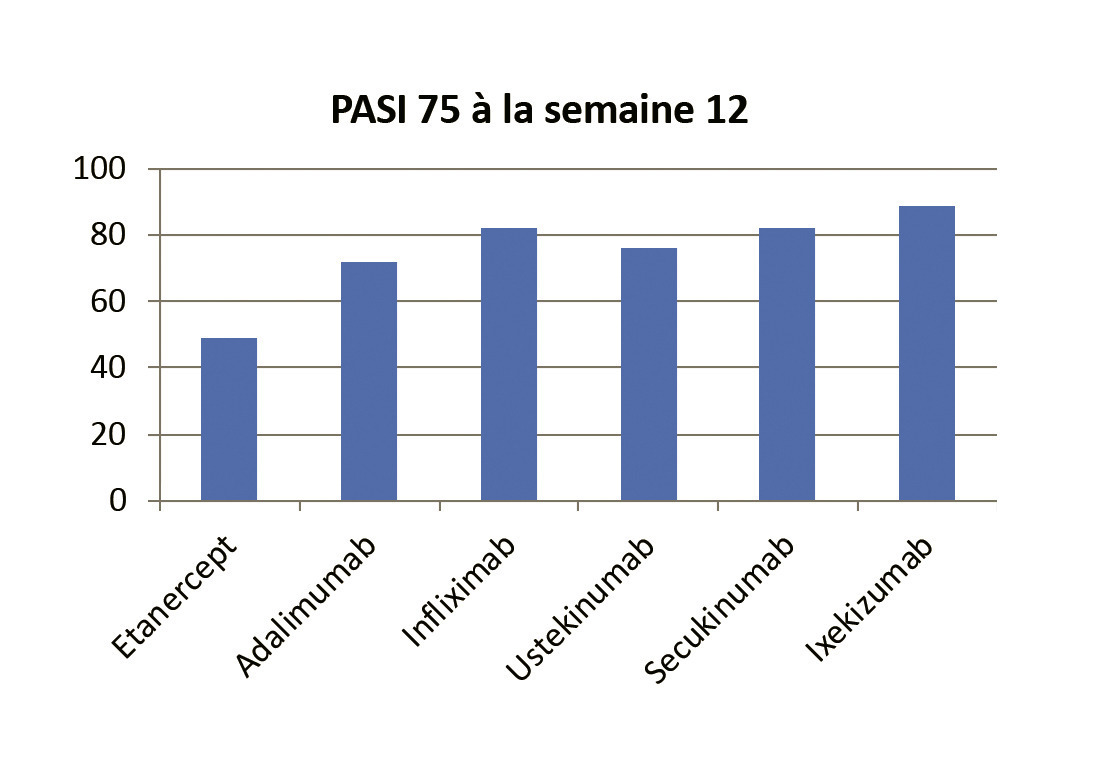
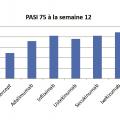
Seul l’infliximab qui est réalisé par voie intraveineuse nécessite des hospitalisations toutes les 8 semaines pour la réalisation des perfusions (après un schéma d’induction initiale J0, J15, S6). Toutes les autres biothérapies sont réalisées en ambulatoire. En schéma de maintenance, la fréquence des injections varie de 1 fois par semaine (étanercept) à 1 fois toutes les 2 semaines (adalimumab), à 1 fois toutes les 4 semaines (sécukinumab, ixékizumab) et à 1 fois toutes les 12 semaines pour l’ustékinumab. L’efficacité de ces biothérapies pour la prise en charge du psoriasis est remarquable (fig. 3 et 4). Ces traitements doivent cependant être poursuivis sur le long terme puisque la récidive du psoriasis à l’arrêt des traitements est quasi constante (au moins 90 % dans les 2 ans après la dernière injection du traitement).
Des données de tolérance sur le long terme sur de larges effectifs de patients traités sont disponibles, avec un recul de plus de 10 ans pour les plus anciennes biothérapies (anti-TNFα et ustékinumab), notamment par le biais de registres. Ces données sont rassurantes en termes de risque de cancers, d’infections (surtout présentes au cours des 4 à 6 premiers mois de traitements) ou d’événements cardiovasculaires. De nombreuses études ont même montré que le contrôle prolongé de l’inflammation chronique réduisait ce risque cardiovasculaire, notamment avec le méthotrexate et les anti-TNFα.
DES OBJECTIFS THÉRAPEUTIQUES PLUS AMBITIEUX
Sa prise en charge a complètement été révolutionnée au cours des 10 dernières années par l’émergence des biothérapies, permettant des objectifs de plus en plus ambitieux et standardisés. Le contrôle de l’inflammation chronique, l’amélioration de la qualité de vie et une prise en charge globale du patient, de ses symptômes et de ses comorbidités deviennent un enjeu crucial du traitement. L’émergence de nouvelles classes thérapeutiques et les gains d’efficacité et de maniabilité qu’elles apportent devraient encore permettre, dans un futur proche, d’affiner les stratégies de traitement.
1. Takeshita J, Grewal S, Langan SM, et al. Psoriasis and comorbid diseases: Epidemiology. J Am Acad Dermatol 2017;76:377-90.
2. Organisation mondiale de la santé. Psoriasis. In : Soixante-septième assemblée mondiale de la santé. Genève, 24 mai 2014. Rapport OMS, 2019:19-20. http://www.who.int/nmh/fr/ ou https://bit.ly/2JhRQPK
3. van de Kerkhof PC, Reich K, Kavanaugh A, et al. Physician perspectives in the management of psoriasis and psoriatic arthritis: results from the population-based Multinational Assessment of Psoriasis and Psoriatic Arthritis survey. J Eur Acad Dermatol Venereol 2015;29:2002-10.
4. Mrowietz U, Kragballe K, Reich K, et al, Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res 2011;303:1-10.
5. Armstrong A, Siegel M, Bagel J, et al. From the Medical Board of the National Psoriasis Foundation: Treatment targets for plaque psoriasis. J Am Acad Dermatol 2017;76:290-8.
6. Mason AR, Mason J, Cork M, et al. Topical treatments for chronic plaque psoriasis. Cochrane Database Syst Rev 2009;2:CD005028.
7. Kragballe K, van de Kerkhof PC. Consistency of data in six phase III clinical studies of a two-compound product containing calcipotriol and betamethasone dipropionate ointment for the treatment of psoriasis. J Eur Acad Dermatol Venereol 2006;20:39-44.
8. Paul C, Stein Gold L, Cambazard F, et al. Calcipotriol plus betamethasone dipropionate aerosol foam provides superior efficacy vs. gel in patients with psoriasis vulgaris: randomized,controlled PSO-ABLE study. J Eur Acad Dermatol Venereol 2017;31:119-26.
9. Pasch MC. Nail psoriasis: a review of treatment options. Drugs 2016;76:675-705.
10. Mrowietz U, Kragballe K, Reich K, et al. Definition of treatment goals for moderate to severe psoriasis: a European consensus. Arch Dermatol Res 2011;303:1-10.
11. Carretero G, Puig L, Carrascosa JM, et al. Redefining the therapeutic objective in psoriatic patients candidates for biological therapy. J Dermatolog Treat 2018;29:334-41.
12. Olsen EA, Weed VW, Meyer CJ, et al. A double-blind, placebo-controlled trial of acitretin for the treatment of psoriasis. J Am Acad Dermatol 1989;21:681-6.
13. Nast A, Gisondi P, Ormerod AD, et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris – Update 2015. J Eur Acad Dermatol Venereol 2015;29:2277-94.
14. Warren RB, Mrowietz U, von Kiedrowski R, et al. An intensified dosing schedule of subcutaneous methotrexate in patients with moderate to severe plaque-type psoriasis (METOP): a 52 week, multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017;389:528-37.
15. Ho VC, Griffiths CE, Albrecht G, et al. Intermittent short courses of cyclosporin for psoriasis unresponsive to topical therapy: a 1-year multicentre, randomized study. The PISCES Study Group. Br J Dermatol 1999;141:283-91.
16. Papp K, Reich K, Leonardi CL, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). J Am Acad Dermatol 2015;73:37-49.