Bien que d’autres facteurs de risque de glaucome aient été identifiés, réduire la pression intraoculaire demeure le principal objectif des thérapeutiques actuelles. Au-delà des traitements médicaux ou par laser, utilisés en première ligne, de nouvelles techniques micro-invasives contribuent à réduire le risque de complications associé aux méthodes chirurgicales conventionnelles.
Le glaucome est une neuropathie optique d’évolution progressive due à une apoptose accélérée des cellules constituant le nerf optique : les cellules ganglionnaires rétiniennes. Il se traduit anatomiquement par une excavation pathologique de la papille optique (examen du fond d’œil) et, fonctionnellement, par une altération du champ visuel pouvant aboutir, à un stade tardif, à la cécité.1, 2 Les mécanismes physiopathologiques de la neuropathie optique glaucomateuse ne sont pas encore parfaitement connus. Cependant, de nombreux facteurs associés à un risque élevé d’apparition ou d’aggravation d’un glaucome ont été clairement identifiés. Le facteur de risque le plus fréquent et le plus accessible à un traitement est l’élévation de la pression intraoculaire (hypertonie intra-oculaire). D’autres facteurs tels l’âge, le caractère mélanoderme, les antécédents familiaux de glaucome, la myopie, les variations de pression artérielle, les syndromes exfoliatif ou de dispersion pigmentaire (anomalies du segment antérieur de l’œil avec accumulation de matériel exfoliatif ou pigmenté dans l’angle irido-cornéen) sont bien caractérisés mais moins facilement, voire non accessibles à une intervention thérapeutique.
Un traitement médical ou laser en première ligne
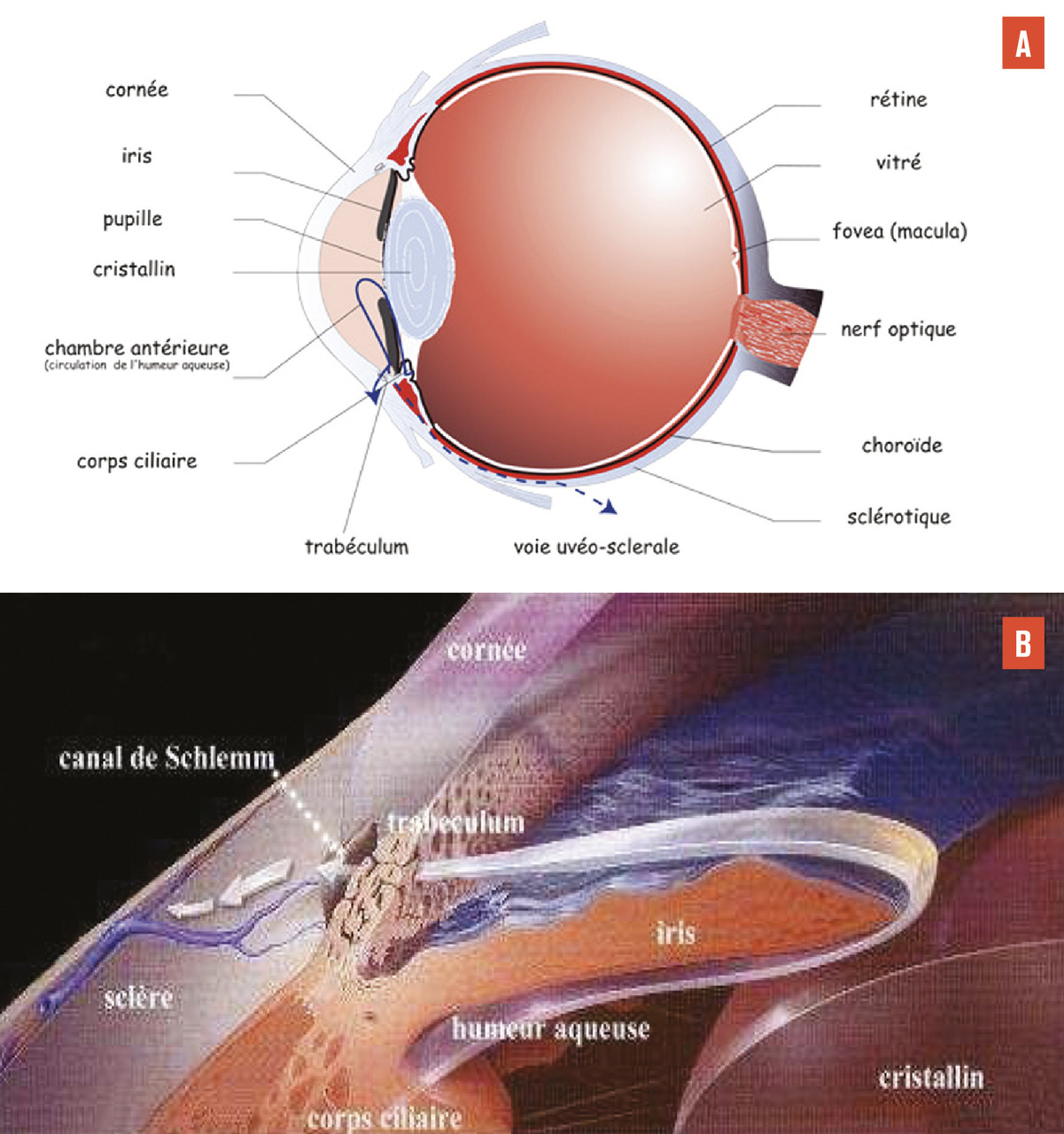
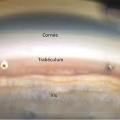
Le traitement actuel d’un glaucome, quelle que soit la méthode, consiste à abaisser la pression intraoculaire (PIO), seul facteur de risque pouvant être corrigé. Les traitements disponibles agissent soit en diminuant la production de l’humeur aqueuse (liquide occupant la partie antérieure de l’œil et déterminant le niveau de pression intra-oculaire, fig. 1 ), soit en facilitant son drainage en dehors de l’œil. Le traitement de première ligne est médical (pharmacologique). Il existe environ 4 ou 5 classes thérapeutiques, aux modes d’action variés, administrées généralement par voie topique (collyre). Des études estiment que 30 à 50 % des patients ne répondent pas suffisamment aux traitements médicaux. Des traitements lasers (trabéculoplasties) peuvent être utilisés pour faciliter l’évacuation de l’humeur aqueuse en dehors de l’œil. Le laser est souvent réalisé soit en première intention (en alternative à un traitement médical), soit en deuxième intention lorsqu’un traitement par collyre ne suffit pas à ralentir l’évolution de la neuropathie glaucomateuse.
Lorsque le glaucome évolue trop rapidement malgré des traitements médicaux et/ou lasers bien conduits, lorsque le traitement médical est mal toléré et ne peut donc pas être poursuivi, ou lorsque l’observance des patients aux traitements par collyre n’est pas satisfaisante, une chirurgie du glaucome est envisagée. Le recours à un traitement chirurgical est fréquent, avec par exemple environ 20 000 procédures chaque année en France.2
Lorsque le glaucome évolue trop rapidement malgré des traitements médicaux et/ou lasers bien conduits, lorsque le traitement médical est mal toléré et ne peut donc pas être poursuivi, ou lorsque l’observance des patients aux traitements par collyre n’est pas satisfaisante, une chirurgie du glaucome est envisagée. Le recours à un traitement chirurgical est fréquent, avec par exemple environ 20 000 procédures chaque année en France.2
Les chirurgies filtrantes conventionnelles
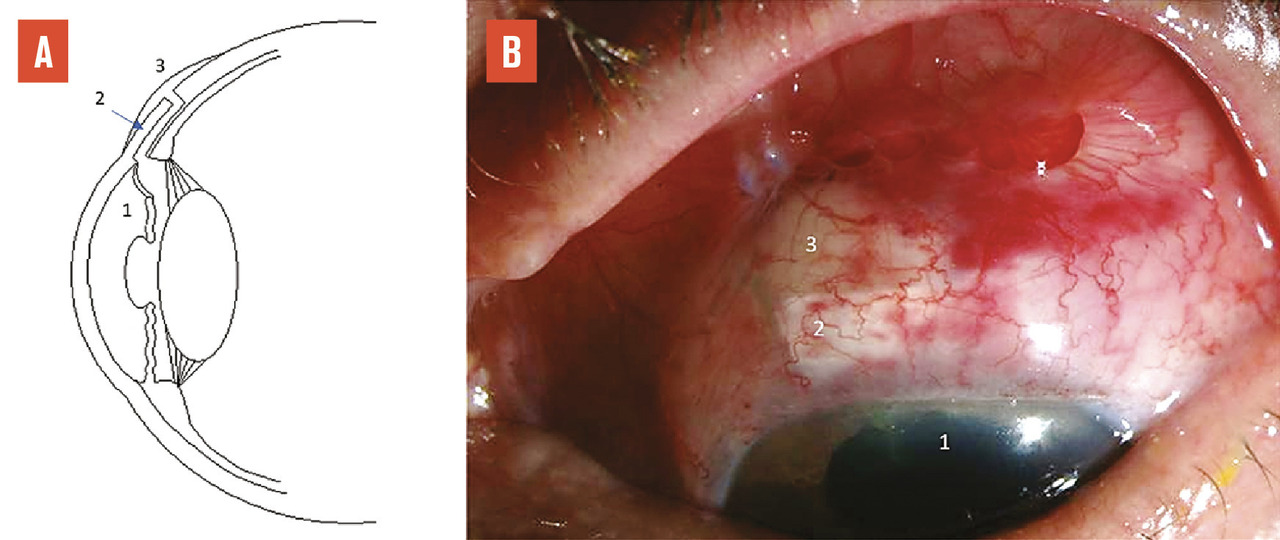
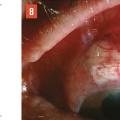
Le traitement chirurgical du glaucome consiste à créer une petite fistule au travers de la paroi oculaire (la sclère, donc le « blanc » de l’œil), afin que l’humeur aqueuse puisse s’écouler de l’intérieur de l’œil vers l’espace sous-conjonctival.3 Celle-ci s’élimine ensuite au travers de la conjonctive ou par voie veineuse. On décomprime ainsi l’œil (« soupape de décompression »), ces techniques sont appelées chirurgies filtrantes car elles permettent de filtrer l’humeur aqueuse en dehors de l’œil. L’abord est réalisé sous la paupière supérieure, afin que le site de résorption (bulle de filtration : voussure qui se forme en regard du site opératoire et qui témoigne de l’évacuation de l’humeur aqueuse sous la conjonctive, fig. 2 ) soit protégé et non visible. Il existe principalement deux types de chirurgie : la sclérectomie, où la paroi de l’œil est amincie à l’extrême sans être complètement ouverte (chirurgie non perforante), et la trabéculectomie, où la paroi de l’œil est ouverte complètement (chirurgie perforante). Après sclérectomie, l’humeur aqueuse filtre au travers d’une fine membrane résiduelle. La filtration est donc modérée, mais progressive et régulière. Après trabéculectomie, l’humeur aqueuse circule librement dans l’incision créée. La baisse pressionnelle est donc plus importante, mais parfois brutale et irrégulière.
La chirurgie expose à des risques significatifs de complications
Hémorragie intraoculaire, infection, aggravation des déficits du champ visuel, baisse d’acuité visuelle, pression postopératoire trop basse : ces complications ne sont pas rares, et les plus sévères peuvent entraîner une altération importante et définitive de la vision. Elles nécessitent souvent des reprises chirurgicales ou de prolonger les hospitalisations.
Un autre écueil de la trabéculectomie et de la sclérectomie est la cicatrisation conjonctivale excessive, induisant l’échec de la chirurgie et une remontée de la pression. Paradoxalement, un individu en bonne santé cicatrise rapidement et complètement après la création d’une fistule, ce qui aboutit à l’inverse de l’effet recherché. Les facteurs favorisant la fibrose précoce et anarchique de la bulle de filtration sont bien connus : le jeune âge (moins de 40 ans), le caractère mélanoderme, l’aphakie (absence de cristallin) ou la pseudophakie (présence d’un cristallin artificiel, ou implant)2, les antécédents d’échec de chirurgie filtrante ou de chirurgie du segment postérieur qui ont nécessité une désinsertion conjonctivale, les inflammations intraoculaires (uvéites chroniques) et l’utilisation au long cours de collyres antiglaucomateux contenant des conservateurs.2, 3
Les difficultés techniques et les complications inhérentes à la chirurgie filtrante expliquent en partie que celle-ci est actuellement réservée aux cas les plus avancés résistants au traitement médical bien conduit ou à la trabéculoplastie par laser.
Un autre écueil de la trabéculectomie et de la sclérectomie est la cicatrisation conjonctivale excessive, induisant l’échec de la chirurgie et une remontée de la pression. Paradoxalement, un individu en bonne santé cicatrise rapidement et complètement après la création d’une fistule, ce qui aboutit à l’inverse de l’effet recherché. Les facteurs favorisant la fibrose précoce et anarchique de la bulle de filtration sont bien connus : le jeune âge (moins de 40 ans), le caractère mélanoderme, l’aphakie (absence de cristallin) ou la pseudophakie (présence d’un cristallin artificiel, ou implant)2, les antécédents d’échec de chirurgie filtrante ou de chirurgie du segment postérieur qui ont nécessité une désinsertion conjonctivale, les inflammations intraoculaires (uvéites chroniques) et l’utilisation au long cours de collyres antiglaucomateux contenant des conservateurs.2, 3
Les difficultés techniques et les complications inhérentes à la chirurgie filtrante expliquent en partie que celle-ci est actuellement réservée aux cas les plus avancés résistants au traitement médical bien conduit ou à la trabéculoplastie par laser.
Les nouvelles chirurgies micro-invasives du glaucome
Ces dernières années, une kyrielle de nouvelles techniques chirurgicales ou de nouveaux dispositifs implantables ont été développés de façon à réduire la pression intraoculaire, en facilitant l’évacuation de l’humeur aqueuse par différentes voies, mais grâce à une incision de plus petite taille et de diamètre mieux contrôlé. Ces techniques doivent permettre d’améliorer la prédictibilité des résultats et de réduire les risques de complications. Le geste chirurgical est plus court, moins douloureux, et de ce fait réalisé sous anesthésie locale, en hospitalisation ambulatoire (pour les sclérectomies/trabéculectomies, l’anesthésie peut être régionale, voire générale, et une surveillance en hospitalisation conventionnelle est parfois nécessaire).3 Ces techniques sont nommées chirurgies micro-invasives du glaucome (minimally invasive glaucoma surgery, MIGS) et peuvent être classées en procédures « ab externo » (sans ouverture de la paroi de l’œil) ou « ab interno » (abord direct de l’angle irido-cornéen par l’intérieur de l’œil, au travers d’une incision cornéenne).2, 3 Elles peuvent également être classées en fonction du mécanisme d’évacuation de l’humeur aqueuse, soit par pontage du trabéculum, soit par filtration vers l’extérieur de l’œil au travers de la conjonctive.
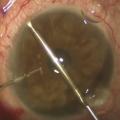
Implanter des stents
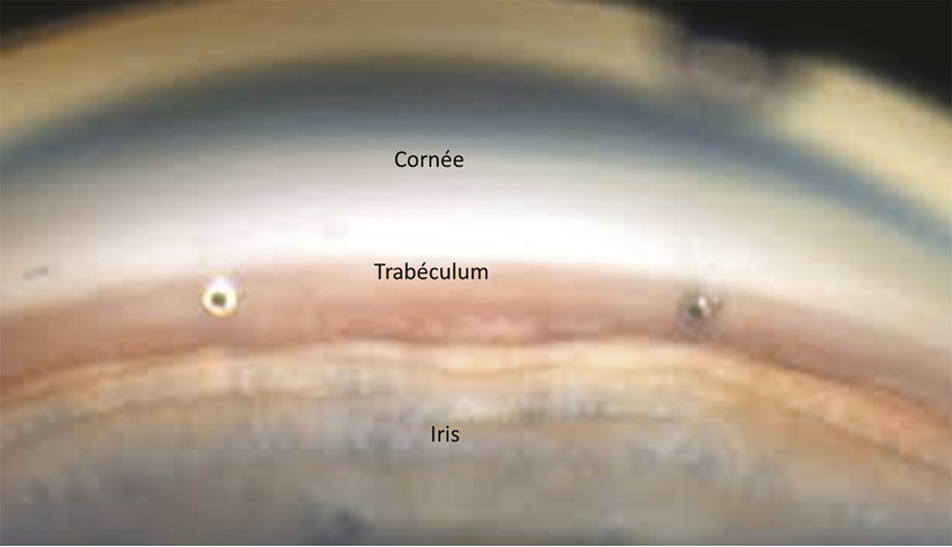
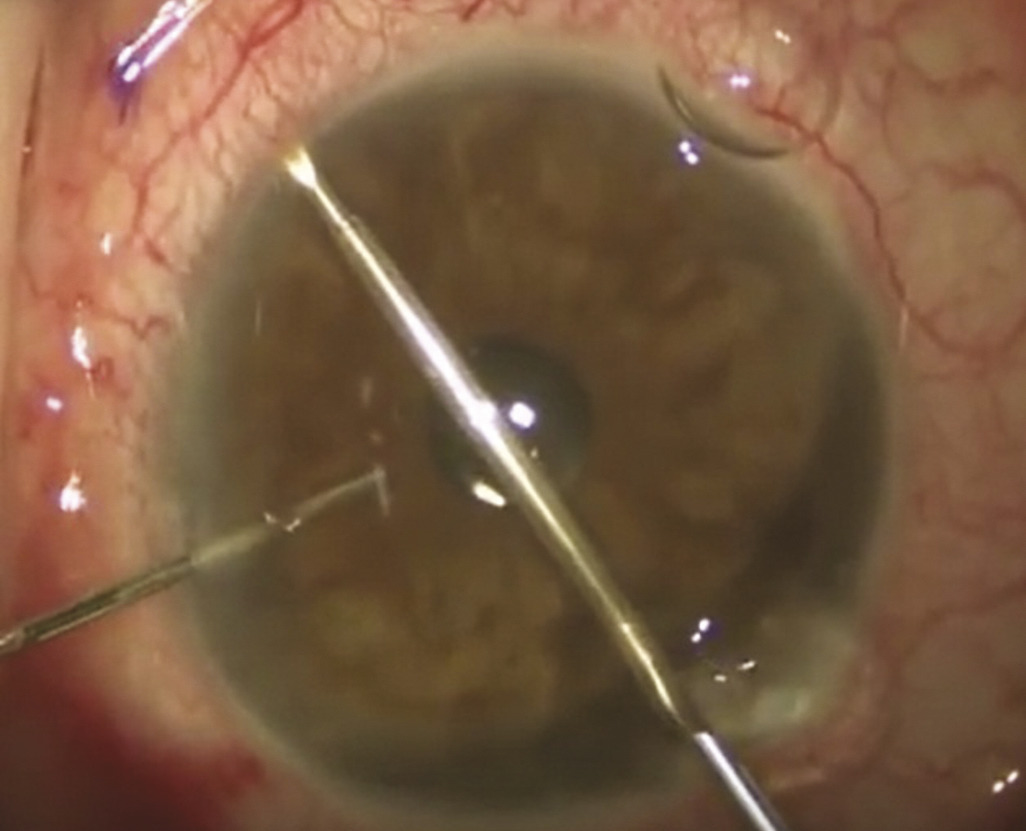
Les stents trabéculaires s’adressent principalement aux patients dont le glaucome est contrôlé et qui doivent bénéficier d’une chirurgie de la cataracte.4 Le stent est inséré ab interno dans le trabéculum, par l’incision cornéenne de la cataracte. Cette technique consiste à améliorer le débit de filtration à travers le trabéculum, en créant un contournement pour que l’humeur aqueuse se déverse directement dans le canal de Schlemm puis dans les vaisseaux collecteurs et la circulation sanguine (fig. 3 ). Ce dispositif permet donc de réduire la pression intraoculaire, en améliorant le débit de filtration, sans passer par la voie transclérale d’une chirurgie filtrante conventionnelle.
Agir sur la voie d’évacuation uvéosclérale
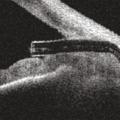
La deuxième approche consiste à améliorer la voie d’évacuation uvéosclérale, qui est normalement accessoire. Il s’agit de dériver l’humeur aqueuse vers la choroïde, tunique vascularisée appartenant à l’uvée, située entre la rétine et la sclère, qui est richement vascularisée et pourra ainsi absorber le volume liquidien dérivé (fig. 4 ).
Autres drains
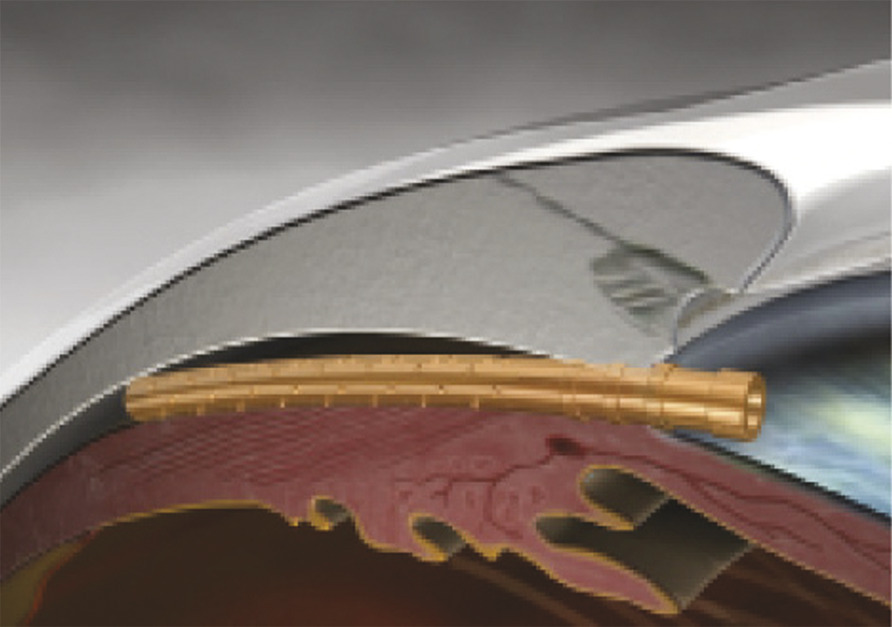
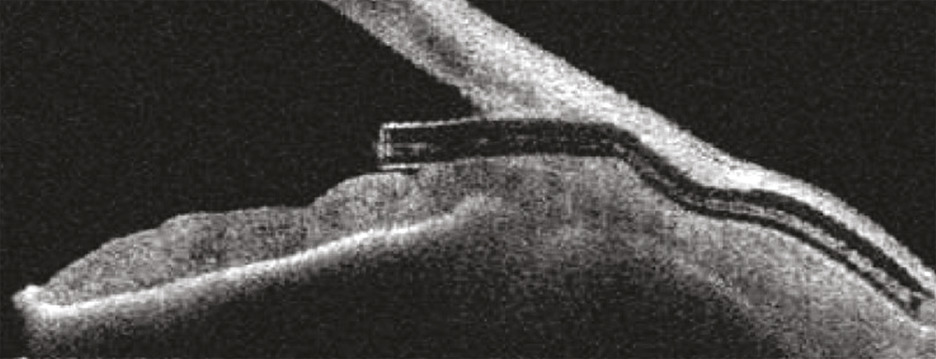
Enfin, de nouveaux dispositifs ont été développés pour améliorer l’évacuation de l’humeur aqueuse par la voie trans-sclérale et sous-conjonctivale, insérés ab interno ou ab externo, mais en évitant une dissection chirurgicale complexe de la paroi oculaire.5 Ces dispositifs sont constitués de tubes de petite taille placés dans la paroi de l’œil, mettant en communication la chambre antérieure et les espaces sous-conjonctivaux (fig. 5 et 6 ).
Mon patient relève d’une chirurgie du glaucome, quelles précautions ?
On peut conseiller aux patients de poursuivre les traitements antiglaucomateux jusqu’à la veille de l’opération, sauf consigne particulière du chirurgien. Les antiagrégants et anticoagulants ne sont pas systématiquement arrêtés, et le patient devra, là encore, se conformer aux recommandations du chirurgien. Les techniques micro-invasives peuvent généralement être réalisées sans qu’un arrêt de ces traitements soit nécessaire. Lorsque le patient souffre d’un glaucome par fermeture de l’angle, les traitements pouvant dilater la pupille sont contre-indiqués tant que la chirurgie n’a pas été réalisée (collyres mydriatiques et certains antalgiques, antidépresseurs, anxiolytiques, antihistaminiques, antiparkinsoniens).
Après la chirurgie, les traitements antiglaucomateux sont générale-ment stoppés et remplacés par un anti-inflammatoire topique (collyre contenant des corticoïdes) pour quelques mois. Ces traitements sont importants car ils réduisent le risque de cicatrisation excessive de la conjonctive, qui empêcherait la filtration de l’humeur aqueuse et aboutirait à l’échec de la chirurgie. L’incision de la paroi de l’œil et la présence d’un trajet mettant en communication les espaces intra- et extra-oculaires augmentent le risque d’infection bactérienne intra-oculaire (endophtalmie). Ces infections après chirurgies filtrantes sont assez rares, mais peuvent se déclarer plusieurs années après l’acte opératoire. De ce fait, lorsqu’un patient opéré de glaucome décrit des signes oculaires tels que des douleurs et/ou rougeurs et/ou une baisse d’acuité visuelle, une infection de la bulle de filtration doit être suspectée, et il doit être adressé en extrême urgence à un ophtalmologiste. Ces infections sont gravissimes, et leur pronostic oculaire est très réservé en cas de prise en charge retardée. Elles ne doivent pas être confondues avec une simple conjonctivite, même si la symptomatologie initiale peut être identique.
Après la chirurgie, les traitements antiglaucomateux sont générale-ment stoppés et remplacés par un anti-inflammatoire topique (collyre contenant des corticoïdes) pour quelques mois. Ces traitements sont importants car ils réduisent le risque de cicatrisation excessive de la conjonctive, qui empêcherait la filtration de l’humeur aqueuse et aboutirait à l’échec de la chirurgie. L’incision de la paroi de l’œil et la présence d’un trajet mettant en communication les espaces intra- et extra-oculaires augmentent le risque d’infection bactérienne intra-oculaire (endophtalmie). Ces infections après chirurgies filtrantes sont assez rares, mais peuvent se déclarer plusieurs années après l’acte opératoire. De ce fait, lorsqu’un patient opéré de glaucome décrit des signes oculaires tels que des douleurs et/ou rougeurs et/ou une baisse d’acuité visuelle, une infection de la bulle de filtration doit être suspectée, et il doit être adressé en extrême urgence à un ophtalmologiste. Ces infections sont gravissimes, et leur pronostic oculaire est très réservé en cas de prise en charge retardée. Elles ne doivent pas être confondues avec une simple conjonctivite, même si la symptomatologie initiale peut être identique.
Réduction du risque d’infection de la bulle de filtration
Les chirurgies filtrantes conventionnelles du glaucome (trabéculectomie, sclérectomie) sont efficaces mais complexes à réaliser. La récupération visuelle est lente, parfois incomplète, et le taux de complications potentiellement sévères est significatif.
En alternative à ces chirurgies filtrantes conventionnelles, une kyrielle de nouvelles techniques micro- invasives ont été développées ces dernières années. Plus courtes, réalisées en hospitalisation ambulatoire et le plus souvent sous anesthésie locale, ces procédures consistent généralement à insérer un micro-drain dans la paroi de l’œil. Elles permettent :
– un écoulement constant et prédictible de l’humeur aqueuse, afin de réduire la pression intraoculaire,
– une récupération visuelle plus rapide,
– une réduction du risque de complications, notamment infectieuses.
En alternative à ces chirurgies filtrantes conventionnelles, une kyrielle de nouvelles techniques micro- invasives ont été développées ces dernières années. Plus courtes, réalisées en hospitalisation ambulatoire et le plus souvent sous anesthésie locale, ces procédures consistent généralement à insérer un micro-drain dans la paroi de l’œil. Elles permettent :
– un écoulement constant et prédictible de l’humeur aqueuse, afin de réduire la pression intraoculaire,
– une récupération visuelle plus rapide,
– une réduction du risque de complications, notamment infectieuses.
Encadre
Association de patients
Si vos patients souhaitent plus de renseignements sur le glaucome ou être aidés pour la prise en charge de leur maladie, vous pouvez les orienter vers une association de patients :
Association France Glaucome (AFG), Institut du Glaucome – Hôpital Saint Joseph – Ophtalmologie - 185, rue Raymond Losserand, 75014 Paris.
Tél. : 06 73 58 93 68 - assofrglaucome@gmail.com
Références
1. Weinreb RN, Khaw PT. Primary open-angle glaucoma. Lancet 2004;363:1711-20.
2. Rapport de la Société française d’ophtalmologie 2014. Le glaucome primitif à angle ouvert (GPAO). Elsevier, 2014.
3. European Glaucoma Society. Guide pour les glaucomes. 4e édition 2012. http://www.eugs.org/preview/fra.pdf
4. Neuhann R, Neuhann T. Second-generation trabecular micro-bypass stent implantation: Retrospective analysis after 12- and 24-month follow-up. Eye Vis (Lond) 2020 Jan 10;7:1.
5. Reitsamer H, Sng C, Vera V, Lenzhofer M, Barton K, Stalmans I ; Apex Study Group. Two-year results of a multicenter study of the ab interno gelatin implant in medically uncontrolled primary open-angle glaucoma. Graefes Arch Clin Exp Ophthalmol 2019 May;257(5):983-96.
2. Rapport de la Société française d’ophtalmologie 2014. Le glaucome primitif à angle ouvert (GPAO). Elsevier, 2014.
3. European Glaucoma Society. Guide pour les glaucomes. 4e édition 2012. http://www.eugs.org/preview/fra.pdf
4. Neuhann R, Neuhann T. Second-generation trabecular micro-bypass stent implantation: Retrospective analysis after 12- and 24-month follow-up. Eye Vis (Lond) 2020 Jan 10;7:1.
5. Reitsamer H, Sng C, Vera V, Lenzhofer M, Barton K, Stalmans I ; Apex Study Group. Two-year results of a multicenter study of the ab interno gelatin implant in medically uncontrolled primary open-angle glaucoma. Graefes Arch Clin Exp Ophthalmol 2019 May;257(5):983-96.

 Encadrés
Encadrés