L’obésité n’est plus synonyme de protection envers toutes les fractures de fragilité osseuse. Elle protège effectivement du risque de fracture de la hanche, mais elle est associée à une augmentation du risque de fracture de la cheville et de l’extrémité proximale de l’humérus.
En 2015, le nombre d’enfants obèses a été établi à 107,7 millions pour 603,7 millions d’obèses adultes à l’échelle mondiale.1 La prévalence de l’obésité semble stagner ; cependant, dans certaines sous-populations comme celle de l’obésité sévère de classe III avec un indice de masse corporelle (IMC) supérieur ou égal à 40 kg/m², elle continue de progresser.2 Si pendant longtemps le surpoids et l’obésité ont été considérés comme des facteurs protecteurs de l’ostéoporose et de fracture, ce paradigme a évolué à la suite des constatations de nombreuses études épidémiologiques.3-6 En effet, jusqu’ici on pensait que le risque de fracture était réduit en raison d’une densité minérale osseuse (DMO) plus élevée, et de l’effet protecteur des tissus sous-cutanés sur l’impact des chutes. En fait, on sait maintenant que les fractures chez les personnes obèses contribuent de façon substantielle à la charge globale des fractures dans nos populations vieillissantes.
Épidémiologie des fractures dans la population obèse
Une relation non linéaire entre l’IMC et le risque de fracture
Récemment encore, l’obésité était considérée comme un facteur protecteur du risque de fracture et, de fait, une vaste méta-analyse évaluant le rôle de l’indice de masse corporelle (IMC) dans la prédiction du risque fracturaire montrait que plus l’IMC était bas, plus le risque de fracture était élevé.7 Cependant, ce paradigme a été bousculé par de nombreuses observations.8 L’association entre IMC et risque fracturaire n’est pas linéaire, le gradient de risque le plus élevé est observé lorsque les valeurs de l’IMC sont inférieures à 20 kg/m2. Seules de faibles diminutions du risque de fracture sont observées lorsque l’IMC augmente au-dessus de 25 kg/m2, un point d’inflexion survient autour de 30 kg/m2 et, après ajustement pour la DMO, un IMC supérieur à 30 kg/m2 est associé à une augmentation du risque fracturaire.9, 10
Dans une vaste étude observationnelle prospective chez des femmes ménopausées, 23 % des fractures observées sont survenues chez des femmes obèses lors d’un suivi de 2 ans. Cette contribution substantielle au fardeau des fractures dans la population plus âgée des fractures survenant chez les personnes obèses s’est confirmée tant chez l’homme que chez la femme. Ainsi, dans l’étude des fractures ostéoporotiques (Study of Osteoporotic Fractures, SOF),11 lors du suivi médian de 11 ans, 37,5 % des femmes obèses ont subi une fracture clinique non vertébrale contre 44 % des femmes non obèses. La prévalence croissante de l’obésité ces dernières années et la diminution de la population des personnes ayant un IMC bas dans la population générale pourraient expliquer en partie l’incapacité des études antérieures à avoir mis en évidence ces caractéristiques épidémiologiques.
Dans une vaste étude observationnelle prospective chez des femmes ménopausées, 23 % des fractures observées sont survenues chez des femmes obèses lors d’un suivi de 2 ans. Cette contribution substantielle au fardeau des fractures dans la population plus âgée des fractures survenant chez les personnes obèses s’est confirmée tant chez l’homme que chez la femme. Ainsi, dans l’étude des fractures ostéoporotiques (Study of Osteoporotic Fractures, SOF),11 lors du suivi médian de 11 ans, 37,5 % des femmes obèses ont subi une fracture clinique non vertébrale contre 44 % des femmes non obèses. La prévalence croissante de l’obésité ces dernières années et la diminution de la population des personnes ayant un IMC bas dans la population générale pourraient expliquer en partie l’incapacité des études antérieures à avoir mis en évidence ces caractéristiques épidémiologiques.
Une relation spécifique de site et de genre entre obésité et fracture
L’analyse des travaux publiés met en évidence qu’un IMC élevé est associé à un risque accru de fractures sur certains sites tout en étant protecteur sur d’autres. La relation entre IMC et fragilité osseuse serait donc spécifique à chaque site.
Ainsi, un risque accru de fracture de la cheville, de l’humérus et de la jambe est observé chez les personnes obèses alors même qu’il semblerait exister une diminution du risque des fractures de l’extrémité supérieur du fémur, du bassin et des fractures du radius/avant-bras.4, 12-14 Les données concernant les fractures vertébrales sont plus controversées, reflétant selon les études les différences liées à la définition morphométrique ou clinique des fractures vertébrales.6 Les différences de risque de fracture selon les sites considérés pourraient être le reflet d’une part de l’effet protecteur des tissus mous (rembourrage) sur certains sites comme la hanche, d’autre part des différences de direction et d’impact des chutes entre les sujets obèses et non obèses.
Ainsi, la mobilité et la vitesse de marche réduite, associées à l’obésité, peuvent prédisposer à tomber en arrière ou sur le côté, plutôt qu’en avant. De plus, les réponses protectrices aux chutes peuvent également être altérées chez les sujets obèses. Pour le cas particulier des fractures de cheville, des forces de contrainte en inversion et éversion plus importantes pourraient jouer un rôle.15
Bien que la question soit imparfaitement résolue, ont également été mises en évidence des différences liées au genre dans la relation IMC et fracture de fragilité, comme en témoignent les données figurant dans letableau 1 .
Ainsi, un risque accru de fracture de la cheville, de l’humérus et de la jambe est observé chez les personnes obèses alors même qu’il semblerait exister une diminution du risque des fractures de l’extrémité supérieur du fémur, du bassin et des fractures du radius/avant-bras.4, 12-14 Les données concernant les fractures vertébrales sont plus controversées, reflétant selon les études les différences liées à la définition morphométrique ou clinique des fractures vertébrales.6 Les différences de risque de fracture selon les sites considérés pourraient être le reflet d’une part de l’effet protecteur des tissus mous (rembourrage) sur certains sites comme la hanche, d’autre part des différences de direction et d’impact des chutes entre les sujets obèses et non obèses.
Ainsi, la mobilité et la vitesse de marche réduite, associées à l’obésité, peuvent prédisposer à tomber en arrière ou sur le côté, plutôt qu’en avant. De plus, les réponses protectrices aux chutes peuvent également être altérées chez les sujets obèses. Pour le cas particulier des fractures de cheville, des forces de contrainte en inversion et éversion plus importantes pourraient jouer un rôle.15
Bien que la question soit imparfaitement résolue, ont également été mises en évidence des différences liées au genre dans la relation IMC et fracture de fragilité, comme en témoignent les données figurant dans le
Obésité et fragilité osseuse : quelle morbidité et mortalité ?
Comme cela a pu être montré de façon paradoxale dans d’autres maladies chroniques comme la polyarthrite rhumatoïde, l’obésité pourrait être associée à une réduction de la mortalité observée après fracture de fragilité osseuse. Certaines études font en effet état d’une mortalité post-fracturaire ne semblant pas augmenter et qui pourrait même diminuer par rapport aux personnes non obèses.16 Cette constatation survient alors même que chez les personnes obèses, il existe un risque accru de mauvaise consolidation des fractures et que la durée de séjour à l’hôpital après fracture est plus longue.
De plus, la période de réadaptation après une fracture est souvent prolongée, l’état fonctionnel et la qualité de vie des femmes ménopausées obèses ayant subi une fracture étant significativement réduits par rapport aux femmes non obèses.17
De plus, la période de réadaptation après une fracture est souvent prolongée, l’état fonctionnel et la qualité de vie des femmes ménopausées obèses ayant subi une fracture étant significativement réduits par rapport aux femmes non obèses.17
Quels mécanismes physiopathogéniques ?
À certains égards, les facteurs de risque de fracture identifiés chez les personnes obèses sont identiques à ceux des personnes non obèses.
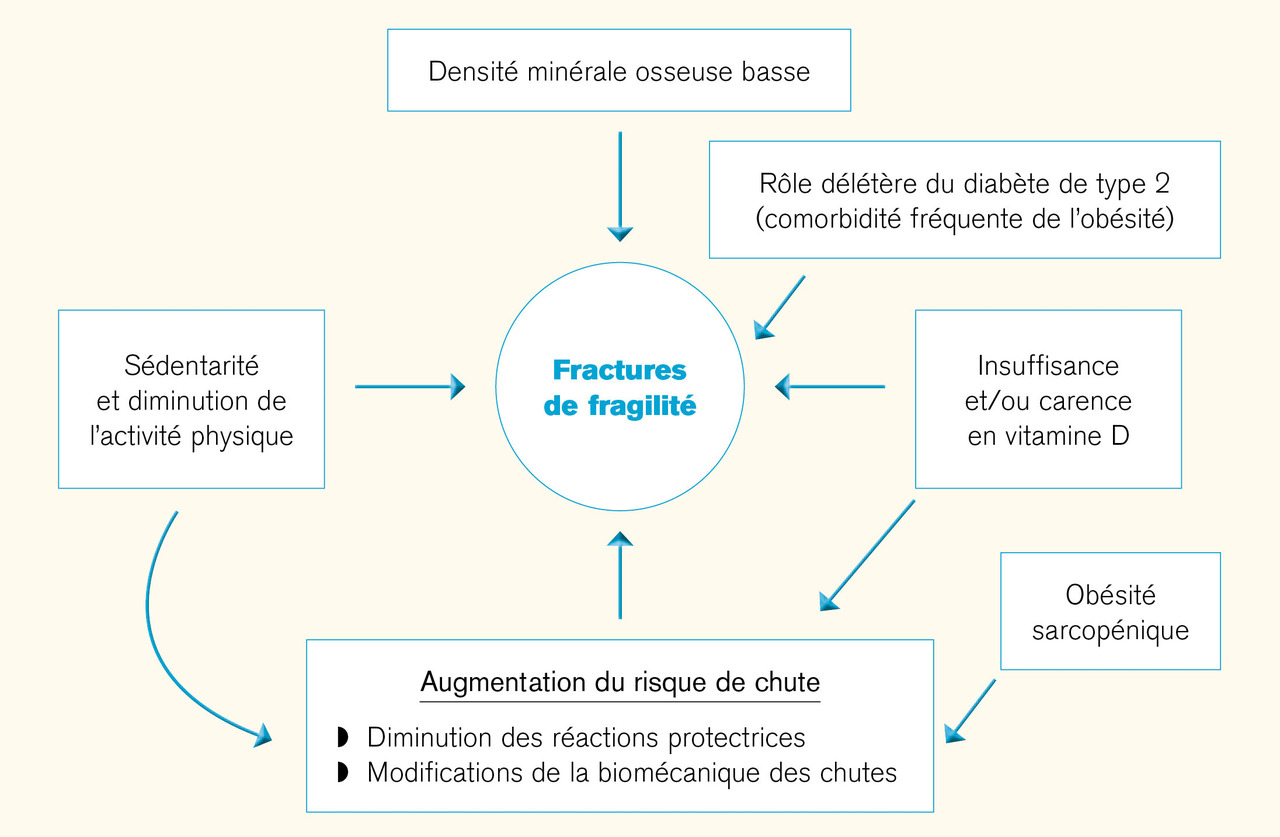
Ainsi les antécédents personnels de fracture, les antécédents parentaux de fracture de l’extrémité supérieure du fémur et la prise de glucocorticoïdes sont identifiés tant chez les femmes obèses que les non obèses comme facteurs de risque de fracture.12 Les femmes ménopausées obèses ayant eu une fracture non vertébrale lors de leur suivi avaient une DMO significativement plus faible au niveau de la hanche et du rachis lombaire par rapport à leurs homologues obèses n’ayant pas eu de fracture.11 Une DMO plus faible peut donc jouer un rôle dans la pathogenèse des fractures chez les sujets obèses. En revanche, le fait d’avoir à utiliser les bras pour s’aider à se lever d’une position assise et des antécédents de deux chutes ou plus au cours des deux dernières années étaient des facteurs plus souvent rapportés chez les femmes obèses fracturées.12 L’obésité sarcopénique, c’est-à-dire l’infiltration et l’augmentation du tissu adipeux intramusculaire, peut prédisposer à un risque accru de chutes. De plus, la direction de la chute et le manque de réaction protectrice à la chute peuvent avoir un effet délétère sur les conséquences de la chute. Il existe des preuves d’une association positive entre le tissu adipeux intramusculaire et le risque de chute.18 Ainsi, dans l’étude sur la santé, le vieillissement en lien avec la composition corporelle, le risque de fracture de la hanche et de toutes fractures cliniques était significativement plus élevé chez les femmes du tertile supérieur de tissu adipeux de la cuisse que chez celles des deux tertiles inférieurs.19, 20 Les chutes contribuent certainement de façon significative à l’augmentation du risque de fractures chez les personnes obèses.
L’insuffisance ou la carence en vitamine D, une hyperparathyroïdie secondaire mais aussi une diminution de l’activité physique et chez l’homme une insuffisance gonadique contribuent, comme dans la population non obèse, à l’augmentation du risque de fragilité osseuse.21, 22 Les effets de l’obésité sur le remodelage osseux et la microstructure de l’os ont été peu étudiés. Des paramètres micro-architecturaux (tant sur l’os cortical que trabéculaire) plus élevés par rapport à des sujets de poids normal ont été mis en évidence ainsi que des biomarqueurs du remodelage osseux à des taux moins élevés (tableau 2 ).23 Il apparaît que les propriétés biomécaniques de l’os chez la femme obèse ne sont pas adaptées en proportion du poids de corps plus élevé.24
Les facteurs pouvant contribuer à accroître la fragilité osseuse chez les personnes obèses sont résumées dans lafigure ci-contre .
Ainsi les antécédents personnels de fracture, les antécédents parentaux de fracture de l’extrémité supérieure du fémur et la prise de glucocorticoïdes sont identifiés tant chez les femmes obèses que les non obèses comme facteurs de risque de fracture.12 Les femmes ménopausées obèses ayant eu une fracture non vertébrale lors de leur suivi avaient une DMO significativement plus faible au niveau de la hanche et du rachis lombaire par rapport à leurs homologues obèses n’ayant pas eu de fracture.11 Une DMO plus faible peut donc jouer un rôle dans la pathogenèse des fractures chez les sujets obèses. En revanche, le fait d’avoir à utiliser les bras pour s’aider à se lever d’une position assise et des antécédents de deux chutes ou plus au cours des deux dernières années étaient des facteurs plus souvent rapportés chez les femmes obèses fracturées.12 L’obésité sarcopénique, c’est-à-dire l’infiltration et l’augmentation du tissu adipeux intramusculaire, peut prédisposer à un risque accru de chutes. De plus, la direction de la chute et le manque de réaction protectrice à la chute peuvent avoir un effet délétère sur les conséquences de la chute. Il existe des preuves d’une association positive entre le tissu adipeux intramusculaire et le risque de chute.18 Ainsi, dans l’étude sur la santé, le vieillissement en lien avec la composition corporelle, le risque de fracture de la hanche et de toutes fractures cliniques était significativement plus élevé chez les femmes du tertile supérieur de tissu adipeux de la cuisse que chez celles des deux tertiles inférieurs.19, 20 Les chutes contribuent certainement de façon significative à l’augmentation du risque de fractures chez les personnes obèses.
L’insuffisance ou la carence en vitamine D, une hyperparathyroïdie secondaire mais aussi une diminution de l’activité physique et chez l’homme une insuffisance gonadique contribuent, comme dans la population non obèse, à l’augmentation du risque de fragilité osseuse.21, 22 Les effets de l’obésité sur le remodelage osseux et la microstructure de l’os ont été peu étudiés. Des paramètres micro-architecturaux (tant sur l’os cortical que trabéculaire) plus élevés par rapport à des sujets de poids normal ont été mis en évidence ainsi que des biomarqueurs du remodelage osseux à des taux moins élevés (
Les facteurs pouvant contribuer à accroître la fragilité osseuse chez les personnes obèses sont résumées dans la
Obésité et ostéoporose : quelle prise en charge ?
Modérer la consommation d’alcool, éviter la consommation de tabac et garantir un niveau d’activité physique approprié sont des mesures relatives au mode de vie qui doivent s’appliquer également dans la population des personnes obèses. Compte tenu du risque de chute accru chez les obèses, l’évaluation de ce risque et des conseils adaptés sont une priorité. Sachant que les sujets obèses ont des besoins de doses de vitamine D plus élevées que les non-obèses pour maintenir des niveaux sériques adéquats de 25-hydroxyvitamine D.21 Il convient de noter que la vitamine D3 est recommandée comme traitement plus puissant que la vitamine D2 en fonction de la fréquence et de la quantité de dosage nécessaire pour la réplétion.
Des apports en calcium suffisants doivent être maintenus, de préférence par le biais de l’alimentation, ou si cela n’est pas possible par une supplémentation de calcium.
L’outil FRAX d’évaluation du risque de fracture semble assez performant chez les femmes ménopausées obèses en dépit d’une DMO et d’un IMC plus élevés. Dans l’étude SOF, les performances du FRAX étaient similaires pour l’évaluation du risque de fracture de la hanche et de fractures majeures chez les femmes obèses ou non.25 Les performances du FRAX ne semblent pas affectées par les variations de la composition corporelle.26 Il faut cependant souligner que les sites de fracture les plus couramment atteints chez les obèses ne sont pas inclus dans l’estimation du FRAX et il est donc probable que ces fractures soient sous-estimées. Ainsi, le calcul du FRAX sous-estime le risque fracturaire, notamment des fractures non vertébrales chez les patientes obèses dont la DMO est élevée.11
L’insuffisance de prise en charge par des interventions pharmacologiques chez les personnes à haut risque de fractures ostéoporotiques dans la population générale27 est encore plus prononcée dans la population obèse*. Ainsi, seules 27 % des femmes obèses, 41 % des femmes non obèses et 57 % des femmes dénutries ont reçu un traitement pharmacologique après la survenue d’une fracture incidente.12
Le niveau de preuves pour la prise en charge pharmacologique des sujets obèses est faible. Dans les essais pivotaux des études antifracturaires, des sous-groupes de l’étude HORIZON avec l’acide zolédronique et de l’étude FREEDOM avec le dénosumab ont été étudiés. La réduction du risque de fracture vertébrale était significativement plus grande chez les femmes obèses que chez les femmes non obèses traitées par acide zolédronique,28 mais aucune interaction n’a été observée pour l’IMC et la réduction du risque de fracture non vertébrale. Une réduction significative des fractures non vertébrales chez les femmes prenant du dénosumab n’a été observée que chez les femmes ayant un IMC inférieur à 25 kg/m2 alors que les réductions des fractures vertébrales n’étaient pas affectées par l’IMC.29 La DMO plus élevée observée chez les femmes obèses pourrait expliquer le manque d’efficacité relative observé pour les fractures non vertébrales.
Des apports en calcium suffisants doivent être maintenus, de préférence par le biais de l’alimentation, ou si cela n’est pas possible par une supplémentation de calcium.
L’outil FRAX d’évaluation du risque de fracture semble assez performant chez les femmes ménopausées obèses en dépit d’une DMO et d’un IMC plus élevés. Dans l’étude SOF, les performances du FRAX étaient similaires pour l’évaluation du risque de fracture de la hanche et de fractures majeures chez les femmes obèses ou non.25 Les performances du FRAX ne semblent pas affectées par les variations de la composition corporelle.26 Il faut cependant souligner que les sites de fracture les plus couramment atteints chez les obèses ne sont pas inclus dans l’estimation du FRAX et il est donc probable que ces fractures soient sous-estimées. Ainsi, le calcul du FRAX sous-estime le risque fracturaire, notamment des fractures non vertébrales chez les patientes obèses dont la DMO est élevée.11
L’insuffisance de prise en charge par des interventions pharmacologiques chez les personnes à haut risque de fractures ostéoporotiques dans la population générale27 est encore plus prononcée dans la population obèse*. Ainsi, seules 27 % des femmes obèses, 41 % des femmes non obèses et 57 % des femmes dénutries ont reçu un traitement pharmacologique après la survenue d’une fracture incidente.12
Le niveau de preuves pour la prise en charge pharmacologique des sujets obèses est faible. Dans les essais pivotaux des études antifracturaires, des sous-groupes de l’étude HORIZON avec l’acide zolédronique et de l’étude FREEDOM avec le dénosumab ont été étudiés. La réduction du risque de fracture vertébrale était significativement plus grande chez les femmes obèses que chez les femmes non obèses traitées par acide zolédronique,28 mais aucune interaction n’a été observée pour l’IMC et la réduction du risque de fracture non vertébrale. Une réduction significative des fractures non vertébrales chez les femmes prenant du dénosumab n’a été observée que chez les femmes ayant un IMC inférieur à 25 kg/m2 alors que les réductions des fractures vertébrales n’étaient pas affectées par l’IMC.29 La DMO plus élevée observée chez les femmes obèses pourrait expliquer le manque d’efficacité relative observé pour les fractures non vertébrales.
Plus de fractures de la cheville et de l’humérus
Si l’obésité apparaît protectrice du risque de fracture de la hanche, elle est en revanche associée à une augmentation du risque de fracture de la cheville et de l’extrémité proximale de l’humérus. En dépit d’une DMO et d’une solidité osseuse plus élevées, il apparaît que ces deux facteurs ne sont pas adaptés aux forces d’impact dans la survenue des fractures dans la population obèse. Les mécanismes expliquant ce manque de proportionnalité pourraient être liés à l’augmentation du risque de chute, à la diminution des capacités protectrices lors des chutes et à la distribution spécifique de site du pannicule adipeux.
* En l’absence d’essais cliniques spécifiques dans cette population, il n’y a aucune recommandation applicable autre que les recommandations concernant la population générale des femmes ménopausées pour instaurer un traitement.
Références
1. The GBD 2015 Obesity Collaborators. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med 2017;377:13-27.
2. Flegal KM, Kruszon-Moran D, Carroll MD, Fryar CD, Ogden CL. Trends in obesity among adults in the United States, 2005 to 2014. JAMA 2016;315:2284.
3. Nielson CM, Srikanth P, Orwoll ES. Obesity and fracture in men and women: An epidemiologic perspective. J Bone Miner Res 2012;27:1-10.
4. Prieto-Alhambra D, Premaor MO, Fina Avilés F, et al. The association between fracture and obesity is site-dependent: A population-based study in postmenopausal women. J Bone Miner Res 2012;27:294-300.
5. Tanaka S, Kuroda T, Saito M, Shiraki M. Overweight/obesity and underweight are both risk factors for osteoporotic fractures at different sites in Japanese postmenopausal women. Osteoporos Int 2013;24:69-76.
6. Laslett LL, Just nee Foley SJ, Quinn SJ, Winzenberg TM, Jones G. Excess body fat is associated with higher risk of vertebral deformities in older women but not in men: a cross-sectional study. Osteoporos Int 2012;23:67-74.
7. De Laet C, Kanis JA, Odén A, et al. Body mass index as a predictor of fracture risk: a meta-analysis. Osteoporos Int 2005;16:1330-8.
8. Lespessailles E, Paccou J, Javier RM, Thomas T, Cortet B, GRIO Scientific Committee. Obesity, bariatric surgery and fractures. J Clin Endocrinol Metab 2019;104:4756-68.
9. Compston JE, Flahive J, Hosmer DW, et al. Relationship of weight, height, and body mass index with fracture risk at different sites in postmenopausal women: the Global Longitudinal Study of Osteoporosis in Women (GLOW): weight, height, BMI, and fracture risk. J Bone Miner Res 2014;29:487-93.
10. Johansson H, Kanis JA, Odén A, et al. A Meta-analysis of the association of fracture risk and body mass index in women: a meta-analysis of the association of fracture risk and BMI in women. J Bone Miner Res 2014;29:223-33.
11. Premaor MO, Ensrud K, Lui L, et al. Risk factors for nonvertebral fracture in obese older women. J Clin Endocrinol Metab 2011;96:2414-21.
12. Compston JE, Watts NB, Chapurlat R, Cooper C, Boonen S, Greenspan S, et al. Obesity Is Not Protective against Fracture in Postmenopausal Women: GLOW. Am J Med 2011;124(11):1043-50.
13. Lacombe J, Cairns BJ, Green J, et al. The effects of age, adiposity, and physical activity on the risk of seven site-specific fractures in postmenopausal women. J Bone Miner Res 2016;31:1559-68.
14. Premaor MO, Compston JE, Fina Avilés F, et al. The association between fracture site and obesity in men: a population-based cohort study: association between fracture site and obesity in men. J Bone Miner Res 2013;28:1771-7.
15. King CM, Cobb M, Collman DR, Lagaay PM, Pollard JD. Bicortical fixation of medial malleolar fractures: a review of 23 cases at risk for complicated bone healing. J Foot Ankle Surg 2012;51:39-44.
16. Prieto-Alhambra D, Premaor MO, Avilés FF, et al. Relationship between mortality and BMI after fracture: a population-based study of men and women aged ≥40 years. J Bone Miner Res 2014;29:1737-44.
17. Compston JE, Flahive J, Hooven FH, et al. Obesity, health-care utilization, and health-related quality of life after fracture in postmenopausal women: Global Longitudinal Study of Osteoporosis in Women (GLOW). Calcif Tissue Int 2014;94:223-31.
18. Inacio M, Ryan AS, Bair WN, Prettyman M, Beamer BA, Rogers MW. Gluteal muscle composition differentiates fallers from non-fallers in community dwelling older adults. BMC Geriatr 2014;14:37.
19. Schafer AL, Vittinghoff E, Lang TF, et al. Fat infiltration of muscle, diabetes, and clinical fracture risk in older adults. J Clin Endocrinol Metab 2010;95:E368-72.
20. Lang T, Cauley JA, Tylavsky F, et al. Computed tomographic measurements of thigh muscle cross-sectional area and attenuation coefficient predict hip fracture: the health, aging, and body composition study. J Bone Miner Res 2010;25:513-9.
21. Lespessailles E, Toumi H. Vitamin D alteration associated with obesity and bariatric surgery. Exp Biol Med 2017;242:1086-94.
22. Grethen E, McClintock R, Gupta CE, et al. Vitamin D and hyperparathyroidism in obesity. J Clin Endocrinol Metab 2011;96:1320-6.
23. Evans AL, Paggiosi MA, Eastell R, Walsh JS. Bone density, microstructure and strength in obese and normal weight men and women in younger and older Adulthood: bone density, microstructure, strength in obese/normal. J Bone Miner Res 2015;30:920-8.
24. Sornay-Rendu E, Boutroy S, Vilayphiou N, Claustrat B, Chapurlat RD. In obese postmenopausal women, bone microarchitecture and strength are not commensurate to greater body weight: the Os des Femmes de Lyon (OFELY) study: bone microarchitecture/strength and body weight in obese women. J Bone Miner Res 2013;28:1679-87.
25. Premaor M, Parker RA, Cummings S, et al. Predictive value of FRAX for fracture in obese older women. J Bone Miner Res 2013;28:188-95.
26. Leslie WD, Orwoll ES, Nielson CM, et al. Estimated lean mass and fat mass differentially affect femoral bone density and strength index but are not FRAX independent risk factors for fracture. J Bone Miner Res 2014;29:2511-9.
27. Lespessailles E. Épidémiologie de l’ostéoporose. Rev Prat 2020;70:1018-21.
28. Eastell R, Black DM, Boonen S, et al. Effect of once-yearly zoledronic acid five milligrams on fracture risk and change in femoral neck bone mineral density. J Clin Endocrinol Metab 2009;94:3215-25.
29. McClung MR, Boonen S, Törring O, et al. Effect of denosumab treatment on the risk of fractures in subgroups of women with postmenopausal osteoporosis. J Bone Miner Res 2012;27:211-8.
2. Flegal KM, Kruszon-Moran D, Carroll MD, Fryar CD, Ogden CL. Trends in obesity among adults in the United States, 2005 to 2014. JAMA 2016;315:2284.
3. Nielson CM, Srikanth P, Orwoll ES. Obesity and fracture in men and women: An epidemiologic perspective. J Bone Miner Res 2012;27:1-10.
4. Prieto-Alhambra D, Premaor MO, Fina Avilés F, et al. The association between fracture and obesity is site-dependent: A population-based study in postmenopausal women. J Bone Miner Res 2012;27:294-300.
5. Tanaka S, Kuroda T, Saito M, Shiraki M. Overweight/obesity and underweight are both risk factors for osteoporotic fractures at different sites in Japanese postmenopausal women. Osteoporos Int 2013;24:69-76.
6. Laslett LL, Just nee Foley SJ, Quinn SJ, Winzenberg TM, Jones G. Excess body fat is associated with higher risk of vertebral deformities in older women but not in men: a cross-sectional study. Osteoporos Int 2012;23:67-74.
7. De Laet C, Kanis JA, Odén A, et al. Body mass index as a predictor of fracture risk: a meta-analysis. Osteoporos Int 2005;16:1330-8.
8. Lespessailles E, Paccou J, Javier RM, Thomas T, Cortet B, GRIO Scientific Committee. Obesity, bariatric surgery and fractures. J Clin Endocrinol Metab 2019;104:4756-68.
9. Compston JE, Flahive J, Hosmer DW, et al. Relationship of weight, height, and body mass index with fracture risk at different sites in postmenopausal women: the Global Longitudinal Study of Osteoporosis in Women (GLOW): weight, height, BMI, and fracture risk. J Bone Miner Res 2014;29:487-93.
10. Johansson H, Kanis JA, Odén A, et al. A Meta-analysis of the association of fracture risk and body mass index in women: a meta-analysis of the association of fracture risk and BMI in women. J Bone Miner Res 2014;29:223-33.
11. Premaor MO, Ensrud K, Lui L, et al. Risk factors for nonvertebral fracture in obese older women. J Clin Endocrinol Metab 2011;96:2414-21.
12. Compston JE, Watts NB, Chapurlat R, Cooper C, Boonen S, Greenspan S, et al. Obesity Is Not Protective against Fracture in Postmenopausal Women: GLOW. Am J Med 2011;124(11):1043-50.
13. Lacombe J, Cairns BJ, Green J, et al. The effects of age, adiposity, and physical activity on the risk of seven site-specific fractures in postmenopausal women. J Bone Miner Res 2016;31:1559-68.
14. Premaor MO, Compston JE, Fina Avilés F, et al. The association between fracture site and obesity in men: a population-based cohort study: association between fracture site and obesity in men. J Bone Miner Res 2013;28:1771-7.
15. King CM, Cobb M, Collman DR, Lagaay PM, Pollard JD. Bicortical fixation of medial malleolar fractures: a review of 23 cases at risk for complicated bone healing. J Foot Ankle Surg 2012;51:39-44.
16. Prieto-Alhambra D, Premaor MO, Avilés FF, et al. Relationship between mortality and BMI after fracture: a population-based study of men and women aged ≥40 years. J Bone Miner Res 2014;29:1737-44.
17. Compston JE, Flahive J, Hooven FH, et al. Obesity, health-care utilization, and health-related quality of life after fracture in postmenopausal women: Global Longitudinal Study of Osteoporosis in Women (GLOW). Calcif Tissue Int 2014;94:223-31.
18. Inacio M, Ryan AS, Bair WN, Prettyman M, Beamer BA, Rogers MW. Gluteal muscle composition differentiates fallers from non-fallers in community dwelling older adults. BMC Geriatr 2014;14:37.
19. Schafer AL, Vittinghoff E, Lang TF, et al. Fat infiltration of muscle, diabetes, and clinical fracture risk in older adults. J Clin Endocrinol Metab 2010;95:E368-72.
20. Lang T, Cauley JA, Tylavsky F, et al. Computed tomographic measurements of thigh muscle cross-sectional area and attenuation coefficient predict hip fracture: the health, aging, and body composition study. J Bone Miner Res 2010;25:513-9.
21. Lespessailles E, Toumi H. Vitamin D alteration associated with obesity and bariatric surgery. Exp Biol Med 2017;242:1086-94.
22. Grethen E, McClintock R, Gupta CE, et al. Vitamin D and hyperparathyroidism in obesity. J Clin Endocrinol Metab 2011;96:1320-6.
23. Evans AL, Paggiosi MA, Eastell R, Walsh JS. Bone density, microstructure and strength in obese and normal weight men and women in younger and older Adulthood: bone density, microstructure, strength in obese/normal. J Bone Miner Res 2015;30:920-8.
24. Sornay-Rendu E, Boutroy S, Vilayphiou N, Claustrat B, Chapurlat RD. In obese postmenopausal women, bone microarchitecture and strength are not commensurate to greater body weight: the Os des Femmes de Lyon (OFELY) study: bone microarchitecture/strength and body weight in obese women. J Bone Miner Res 2013;28:1679-87.
25. Premaor M, Parker RA, Cummings S, et al. Predictive value of FRAX for fracture in obese older women. J Bone Miner Res 2013;28:188-95.
26. Leslie WD, Orwoll ES, Nielson CM, et al. Estimated lean mass and fat mass differentially affect femoral bone density and strength index but are not FRAX independent risk factors for fracture. J Bone Miner Res 2014;29:2511-9.
27. Lespessailles E. Épidémiologie de l’ostéoporose. Rev Prat 2020;70:1018-21.
28. Eastell R, Black DM, Boonen S, et al. Effect of once-yearly zoledronic acid five milligrams on fracture risk and change in femoral neck bone mineral density. J Clin Endocrinol Metab 2009;94:3215-25.
29. McClung MR, Boonen S, Törring O, et al. Effect of denosumab treatment on the risk of fractures in subgroups of women with postmenopausal osteoporosis. J Bone Miner Res 2012;27:211-8.