Connaître les principes du traitement symptomatique des syndromes œdémateux.
Définition
Diagnostic positif
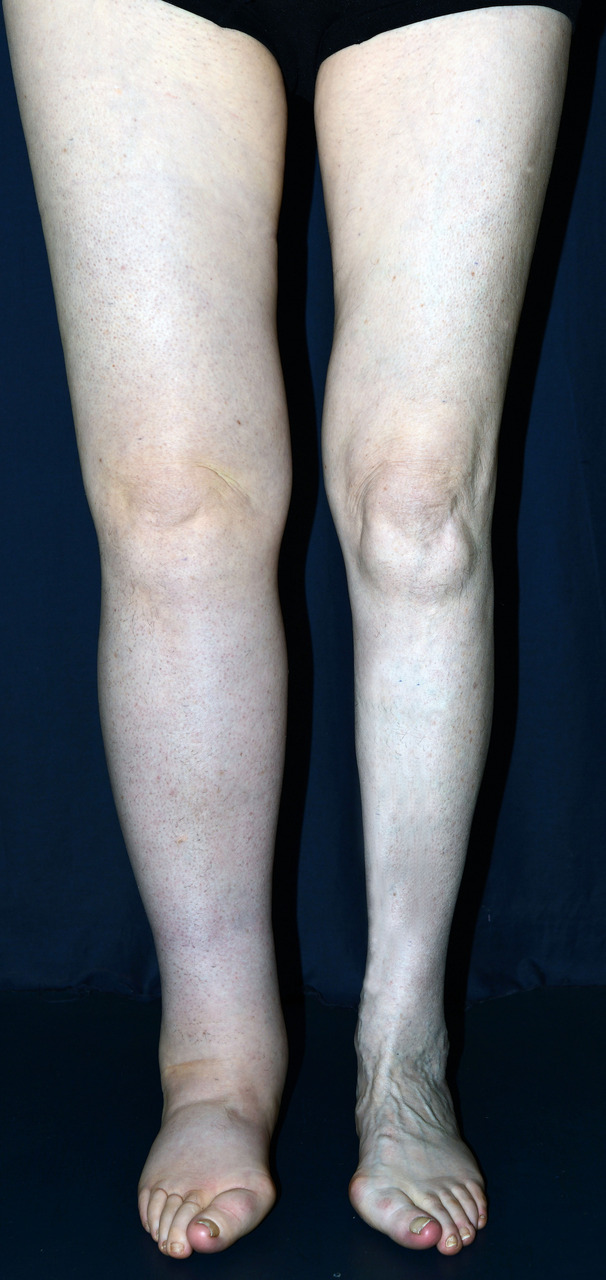
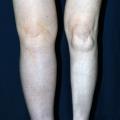
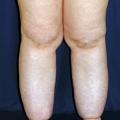
Les OMI sont à différencier des augmentations de volume, où la composante tissulaire est majoritaire par rapport à la composante liquidienne (lymphœdème, lipœdème, hypertrophie tissulaire).
Physiopathologie
Les mouvements de liquides entre les secteurs vasculaires et l’interstitium résultent :
- du gradient de pression hydrostatique entre le capillaire et l’interstitium ;
- du gradient de pression oncotique entre le capillaire et l’interstitium ;
- de la perméabilité capillaire ;
- du drainage des fluides interstitiels, par le biais du système lymphatique.
En situation pathologique, l’augmentation du gradient hydrostatique, la diminution du gradient oncotique ou l’augmentation de la perméabilité vasculaire conduisent à une augmentation du flux liquidien dans l’interstitium avec, pour conséquence, une augmentation de la charge liquidienne prise en charge par la circulation lymphatique. Cette charge s’accompagne d’une dilatation progressive des vaisseaux lymphatiques qui retentit sur le fonctionnement des valves lymphatiques puis de la création d’un cercle vicieux de pérennisation de l’accumulation interstitielle de fluides et l’apparition d’œdèmes cliniques.
L’augmentation du gradient hydrostatique est observée lors de l’augmentation du volume intravasculaire ou de la diminution du retour veineux central, avec comme conséquence une hyperpression veineuse. La diminution du gradient oncotique est observée en cas d’hypoalbuminémie profonde ou d’augmentation de la pression oncotique interstitielle (situation spécifique du myxœdème et du lymphœdème).
Des œdèmes « physiologiques » – non pathologiques – se rencontrent lors de situations hormonales physiologiques, en particulier lors du syndrome prémenstruel et de la grossesse, de contraintes mécaniques (station debout prolongée, position assise prolongée, gêne mécanique abdominale au retour veineux lors de la grossesse) ou en cas de températures extérieures élevées.
Physiopathologie des œdèmes dans l’insuffisance cardiaque
Physiopathologie des œdèmes dans le syndrome néphrotique
Physiopathologie des œdèmes dans les hépatopathies avancées
Diagnostic étiologique
OMI liés à une cause générale
Œdèmes d’origine cardiaque
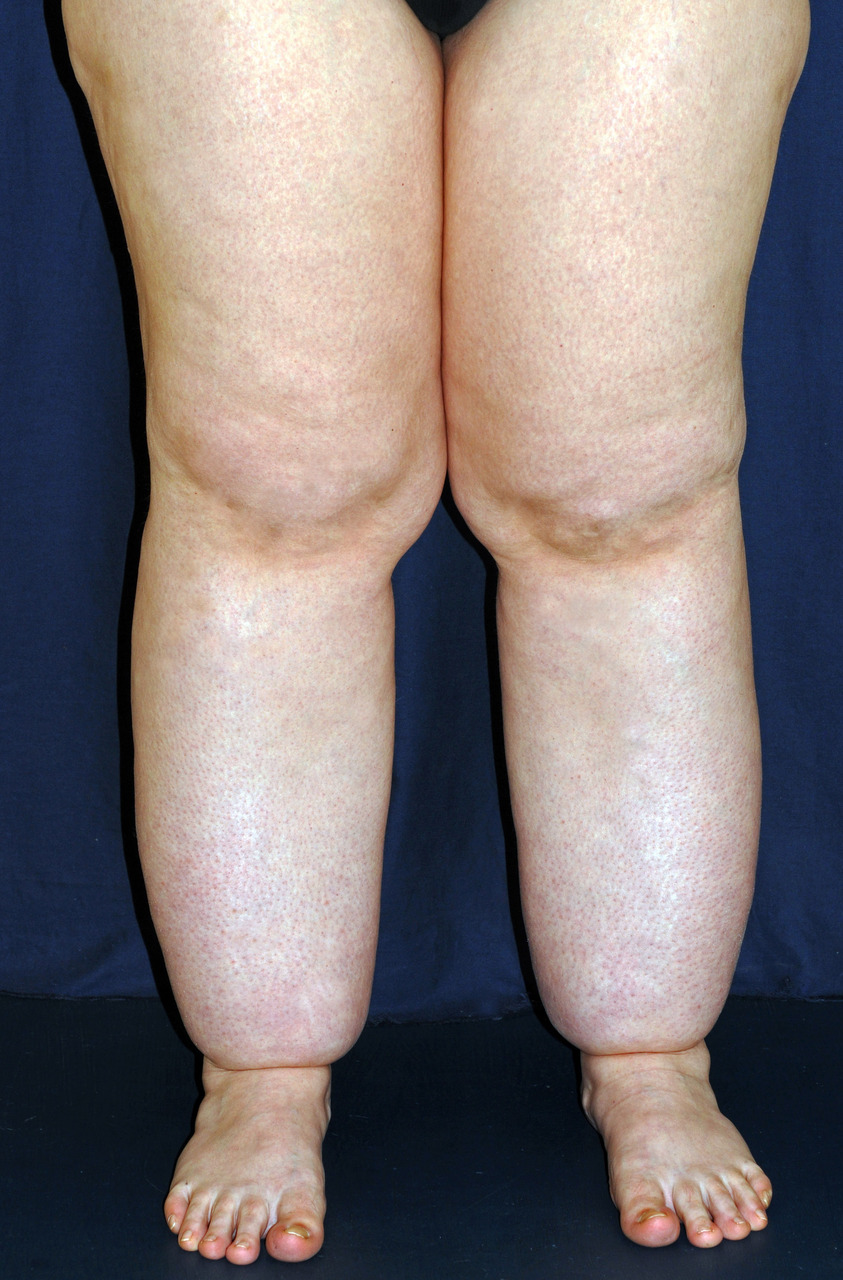
Il s’agit d’une des premières causes d’OMI en France. La plupart du temps, le diagnostic est facile lorsqu’il existe un antécédent de cardiopathie. L’examen clinique peut mettre en évidence :- des œdèmes mous, indolores, déclives (touchant les lombes si le patient est allongé, et des OMI en orthostatisme), prenant le godet, bilatéraux et symétriques, parfois associés à des épanchements des séreuses (plèvre) ;
- des signes d’insuffisance ventriculaire droite (hépatomégalie, reflux hépatojugulaire, turgescence jugulaire, souffle d’insuffisance tricuspidienne à l’auscultation cardiaque) ;
- des signes d’insuffisance ventriculaire gauche (crépitants à l’auscultation pulmonaire, bruit de galop à l’auscultation cardiaque).
Causes
- l’insuffisance cardiaque gauche à fraction d’éjection ventriculaire gauche (FEVG) abaissée (insuffisance cardiaque systolique) ou conservée (insuffisance cardiaque diastolique) ;
- l’insuffisance cardiaque droite (hypertension artérielle pulmonaire, cœur pulmonaire postembolique ou secondaire aux bronchopathies chroniques obstructives) ;
- plus rarement, des œdèmes peuvent être observés lors d’une insuffisance cardiaque à débit cardiaque élevé (fistules artérioveineuses à haut débit, béribéri par carence en vitamine B1, ou hyperthyroïdie) ou en cas de péricardite chronique due à un épaississement péricardique responsable d’une constriction cardiaque et d’une adiastolie progressive.
Examens complémentaires
- dosage du peptide natriurétique NT-proBNP, dont l’élévation traduit la distension des cavités cardiaques ;
- électrocardiogramme (ECG), qui ne montre pas de signes spécifiques de l’insuffisance cardiaque mais peut orienter vers une cause (cardiopathie ischémique, rythmique, etc.) ;
- échocardiographie, qui est l’examen clé du bilan initial d’une insuffisance cardiaque avec l’analyse des éléments suivants :
- géométrie des cavités gauches et fonction segmentaire et globale du ventricule gauche, mesure de la FEVG, évaluation des pressions de remplissage ventriculaire gauche, mesure du débit cardiaque ;
- recherche de valvulopathies ;
- géométrie des cavités droites et fonction du ventricule droit, évaluation des pressions pulmonaires, notamment de la pression artérielle pulmonaire systolique par mesure du flux d’insuffisance tricuspide, évaluation des pressions de remplissage ventriculaire droite ;
- analyse du péricarde ;
- coronarographie, pour rechercher une cause ischémique à l’insuffisance cardiaque ;
- IRM cardiaque ; c’est un examen de plus en plus fréquemment demandé dans le bilan d’une insuffisance cardiaque pour l’évaluation cardiaque chez les patients anéchogènes ou porteurs de cardiomyopathie complexe, et pour la caractérisation du tissu myocardique, en particulier en cas de suspicion d’amylose cardiaque ;
- radiographie thoracique de face ; elle reste un examen complémentaire utile en cas de suspicion d’insuffisance cardiaque et peut montrer une cardiomégalie, une surcharge vasculaire bilatérale, des épanchements pleuraux, voire des calcifications péricardiques en faveur d’une péricardite chronique ;
- cathétérisme droit ; c’est l’examen clé lors dans la situation d’hypertension artérielle pulmonaire ; il permet de confirmer l’existence d’une hypertension pulmonaire pré- ou post-capillaire, ou la présence d’un dip-plateau lors des péricardites chroniques.
Œdèmes d’origine rénale
Les OMI sont l’une des caractéristiques cliniques des néphropathies d’origine glomérulaire ou lors de la diminution de l’excrétion sodée associée à la progression de la maladie rénale chronique. La présence d’œdèmes blancs, mous, indolores, bilatéraux doit impérativement conduire à rechercher une protéinurie très rapidement, par le biais d’une bandelette urinaire ou par un dosage du ratio protéinurie/créatininurie (RPC) sur un échantillon d’urine. L’existence d’une protéinurie significative (RPC > 300 mg/g) signe l’existence d’une anomalie de la barrière de filtration glomérulaire et doit faire réaliser un bilan plus large comprenant une échographie rénale, une mesure de la fonction rénale (créatinine plasmatique), de l’albuminémie et un examen cytobactériologique des urines (ECBU). L’ensemble du tableau syndromique oriente, dès les premiers examens, vers certaines lésions histologiques glomérulaires dont la présence est ensuite le plus souvent confirmée par une biopsie rénale (Œdèmes d’origine hépatique
Ils s’observent au cours des cirrhoses, quelle qu’en soit la cause, et sont souvent associés à une ascite. La cirrhose a pour causes principales la consommation excessive d'alcool, le syndrome métabolique, les hépatites virales B ou C, des maladies génétiques comme l’hémochromatose ou la maladie de Wilson, ou des maladies dysimmunitaires comme les hépatites auto-immunes ou la cirrhose biliaire primitive. Le diagnostic est fondé sur l’histoire de la pathologie hépatique chronique, les signes d’insuffisance hépatique et d’hypertension portale (ictère, angiomes stellaires, hépatomégalie, ascite, circulation veineuse collatérale, signes d’insuffisance hépatocellulaire : baisse du TP, diminution du facteur V, hypoalbuminémie). Des OMI peuvent aussi s’observer en cas d’hypertension portale sans cirrhose au cours des thromboses des veines hépatiques (syndrome de Budd-Chiari) ou des maladies veino-occlusives associées à la greffe de cellules souches hématopoïétiques.Œdèmes d’origine carentielle ou digestive
Des OMI peuvent survenir en cas de dénutrition profonde ou de pathologies digestives associées à une hypoalbuminémie. Cette hypoalbuminémie conduit à la formation d’œdèmes par les biais de la diminution de la pression oncotique. Dans les malnutritions prolongées protéino-énergétiques des enfants dans les pays en développement, les œdèmes sont constants et constituent le tableau clinique du kwashiorkor. Dans les pays développés, une carence d’apports peut être observée au cours de l’anorexie mentale, chez des patients gastrectomisés, après chirurgie bariatrique (sleeve, by-pass), chez des sujets âgés et isolés ou chez des personnes en grande précarité.Les principales causes de gastro-entéropathies exsudatives et malabsorption sont résumées dans le
Œdèmes d’origine médicamenteuse
De nombreuses classes médicamenteuses sont responsable d’OMI, par des mécanismes physiopathologiques très divers (Œdèmes par augmentation de la perméabilité capillaire
L’augmentation de la perméabilité capillaire est une situation rare, le plus souvent brutale, sous la forme de crises paroxystiques qui peuvent être généralisées ou locales. Dans les crises paroxystiques généralisées (syndrome d’hyperperméabilité capillaire idiopathique ou syndrome de Clarkson), les OMI sont un signe clinique secondaire en regard de la gravité du tableau clinique général qui est dominé par un état de choc sévère qui nécessite un remplissage massif pour maintenir l’hémodynamique. L’origine de cette pathologie est encore inconnue, mais il faut systématiquement rechercher une gammapathie monoclonale.Causes des œdèmes locorégionaux
Œdèmes locorégionaux sans signe inflammatoire, diagnostics différentiels
Œdèmes d’origine veineuse
- les thromboses veineuses profondes : un œdème récent unilatéral non inflammatoire doit faire suspecter une thrombose veineuse profonde. Le diagnostic doit être confirmé par un écho-doppler veineux. Les D-dimères ont une bonne valeur prédictive négative. Un œdème bilatéral asymétrique peut être lié à une thrombose de la veine cave inférieure ;
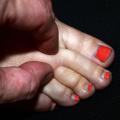
- l’insuffisance veineuse chronique : l’œdème d’origine veineuse est classé en stade C3 de la classification CEAP (C : clinique, fondée sur des signes objectifs ; E : étiologie ; A : anatomique des reflux et obstructions dans les veines superficielles, profondes et perforantes ; P : physiopathologie sous-jacente). L’œdème est le plus souvent bilatéral, parfois asymétrique, prédominant au niveau des chevilles sans atteinte de l’avant-pied (à la différence du lymphœdème), réversible après décubitus. Les signes et symptômes cliniques associés peuvent comprendre : sensation de jambes lourdes, télangiectasies/varicosités (stade C1), varices (stade C2), troubles trophiques cutanés (pigmentation, eczéma, hypodermite : dermite ocre) [C4], ulcère veineux cicatrisé (C5), ulcère veineux actif (C6). L’écho-doppler veineux est l’examen clé pour évaluer la fonction veineuse (reflux, dilatation veineuse, séquelles de thrombose veineuse profonde) ;
- l’insuffisance veineuse post-thrombotique : le syndrome post-thrombotique correspond aux séquelles anatomiques et hémodynamiques de thromboses veineuses profondes ;
- les compressions veineuses par un kyste poplité, compression de la veine iliaque commune gauche par l’artère iliaque commune droite et la surface osseuse du sacrum appelé syndrome de Cockett (ou de May-Thurner), compression des veines du petit bassin ou de la veine cave par des adénopathies, une tumeur, un anévrisme artériel ou une fibrose rétropéritonéale (médicaments, cancers…).
Lymphœdèmes
Les lymphœdèmes sont des augmentations de volume d’un ou des deux membres inférieurs classés en formes primaires, d’origine constitutionnelle, parfois familiale (maladie de Milroy, liée à un variant pathogène du gène VEGFR-3), et en formes secondaires, en France essentiellement après traitements de cancers (pelviens : col utérin, endomètre, ovaires, prostate, anus, mélanome des membres inférieurs…) comprenant un curage ganglionnaire, parfois associé à de la radiothérapie (externe, curiethérapie). Dans le monde, la cause la plus fréquente des lymphœdèmes secondaires est la filariose lymphatique.
Avant de poser le diagnostic de lymphœdème primaire, il est nécessaire d’avoir éliminé toutes les autres causes d’œdèmes citées plus haut et un syndrome compressif abdominopelvien (scanner/IRM pelvien, TEP-scan). Il s’agit davantage d’un diagnostic différentiel que d’une cause d’œdème puisqu’il s’agit d’une maladie chronique, en grande partie irréversible, dont l’augmentation de volume est d’abord due à un épaississement cutané et une accumulation de tissu adipeux induits par la stase lymphatique, qui est minoritaire (
Dans les lymphœdèmes secondaires, l’atteinte peut être uni- ou bilatérale (le traitement du cancer étant souvent médian), asymétrique et ne pas toucher le pied.
Le diagnostic est habituellement clinique, avec l’anamnèse, l’examen clinique, mais dans les formes primaires, la lymphoscintigraphie des membres inférieurs peut confirmer le diagnostic. Une injection intradermique de colloïdes d’albumine marqués au Tc99m est faite dans le premier espace interdigital des deux pieds avec des images prises après trente minutes de marche. Elle permet d’analyser la fixation ganglionnaire inguinale (absence/diminution), de voir un éventuel reflux sous-dermique (dermal backflow) et un passage dans le réseau lymphatique profond par la visualisation de ganglions poplités (normalement non visibles).
La principale complication des lymphœdèmes est la dermohypodermite bactérienne non nécrosante (érysipèle).
Lipœdème
Myxœdème prétibial
Syndromes hypertrophiques
Œdèmes locorégionaux avec signes inflammatoires
Cinq causes sont décrites :- la dermohypodermite bactérienne non nécrosante, avec des signes généraux de survenue brutale (fièvre élevée, frissons), puis rougeur, douleur, augmentation de volume du membre inférieur, avec signes cutanés inflammatoires correspond au tableau clinique d’une grosse jambe rouge fébrile. Le terme d’érysipèle est associé au streptocoque, mais les dermohypodermites peuvent être liées à d’autres agents bactériens comme le staphylocoque ou les germes anaérobies ; l’arthrite : un œdème périarticulaire peut accompagner les arthrites, d’origine infectieuse, microcristalline ou auto-immune ;
- le syndrome RS3PE (remittive seronegative symmetrical synovitis with pitting edema) ou polyarthrite aiguë œdémateuse bénigne récidivante du sujet âgé ; il associe des arthrites prédominant au niveau des poignets et des mains, un syndrome inflammatoire, une évolution par poussées. L’évolution est favorable avec une petite dose de corticoïdes et il est plus fréquemment observé chez les hommes de plus de 65 ans ;
- le syndrome douloureux régional complexe (algodystrophie) : la face chaude de l’algodystrophie se caractérise par un œdème d’aspect pseudo-inflammatoire avec une augmentation de la chaleur locale, une peau luisante et rouge et une hyperhidrose, alors que lors de la phase froide l’œdème est froid ;
- la myonécrose qui correspond à une augmentation de la pression à l’intérieur d’un compartiment fermé par les aponévroses inextensibles compromettant la vitalité musculaire, observée principalement au cours du syndrome des loges.
Bilan et attitude thérapeutique
Conclusion
Le terme « œdème » désigne toute accumulation anormale de liquide dans un compartiment de l’organisme, plus particulièrement dans son secteur interstitiel.
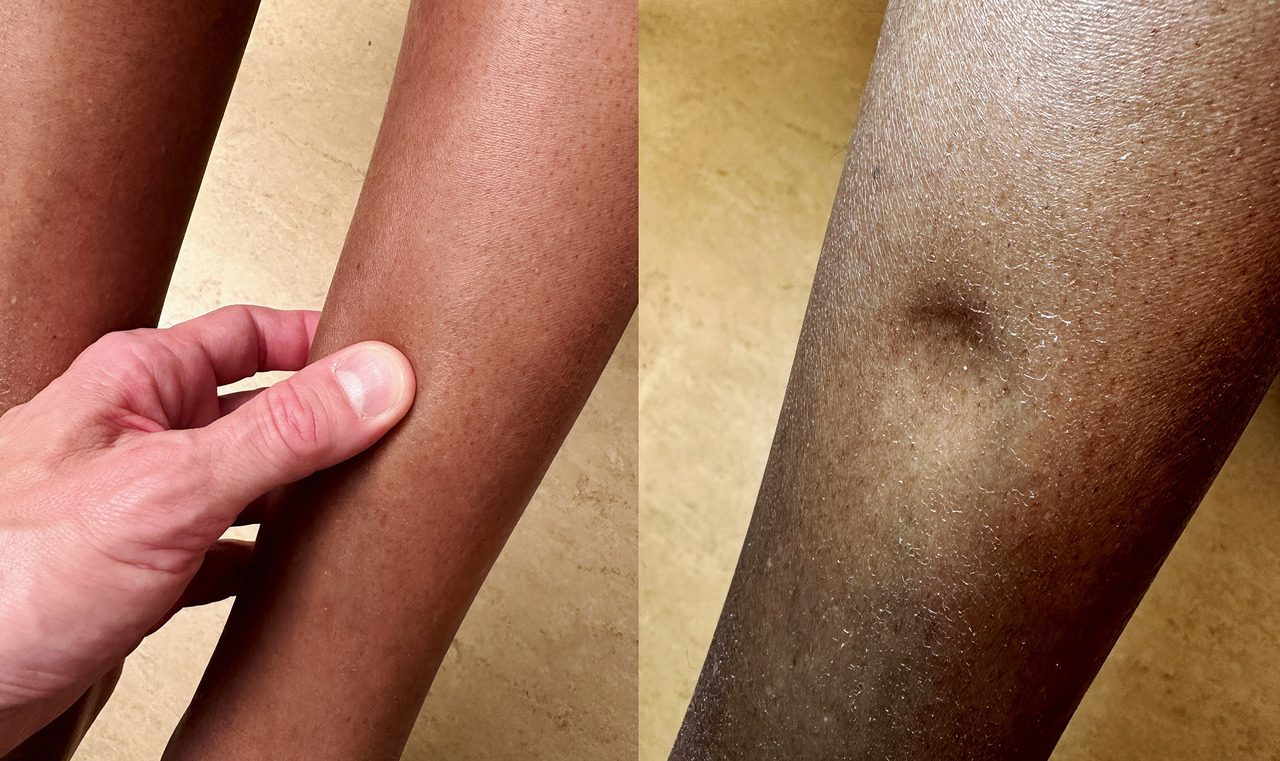
Le diagnostic positif d’œdème des membres inférieurs est clinique, avec la présence du signe du godet.
Il existe des causes générales et loco-régionales.
Plusieurs mécanismes physiologiques, parfois intriqués, sont en cause dans les œdèmes des membres inférieurs.
Un interrogatoire et un examen clinique permettent d’orienter le diagnostic.
Il existe quatre principales causes : cardiopathies, néphropathies, hépatopathies, insuffisance veineuse chronique.
Parmi les autres causes plus rares une hypoalbuminémie (carentielle, perte digestive) ou une cause médicamenteuse est à rechercher en premier lieu.
Les principaux diagnostics différentiels des œdèmes des membres inférieurs chroniques sont les lymphœdèmes et les lipœdèmes.
Le traitement est avant tout celui de la cause, le plus souvent associé à un régime peu salé, à un diurétique et à des compressions élastiques.

 Encadrés
Encadrés