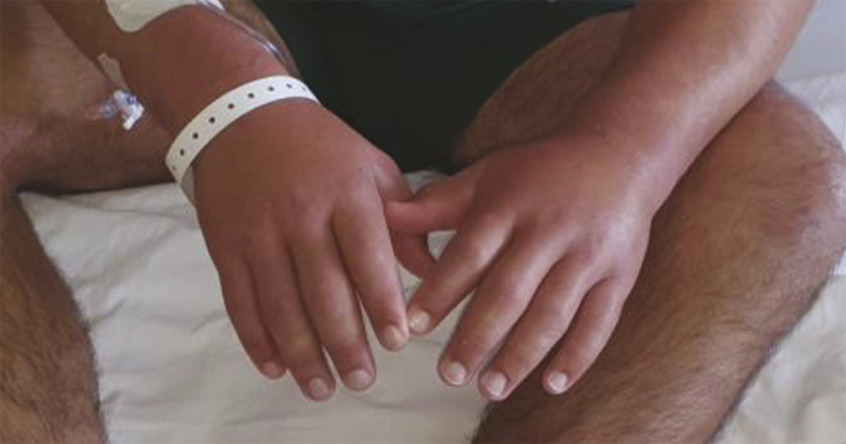
Observation. Un patient de 21 ans d’origine brésilienne, engagé dans la Légion étrangère, présente lors d’un séjour à Djibouti des œdèmes bilatéraux douloureux prenant le godet au niveau des quatre membres, d’aggravation progressive et remontant jusqu’aux coudes et aux genoux (fig. 1 ). L’examen clinique met en évidence des paresthésies des orteils et des mains, sans déficit moteur associé. Une dissociation entre la sensibilité thermo-algique (abolie) et sensitive (conservée) est constatée au niveau des territoires ulnaires.
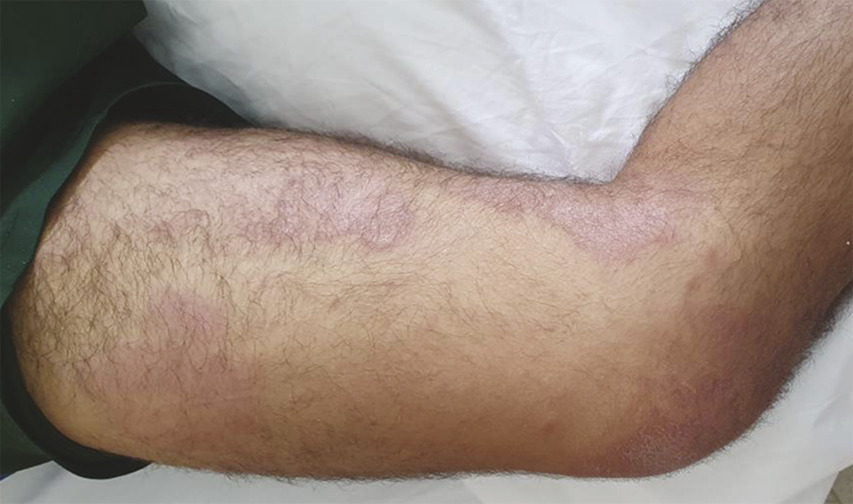
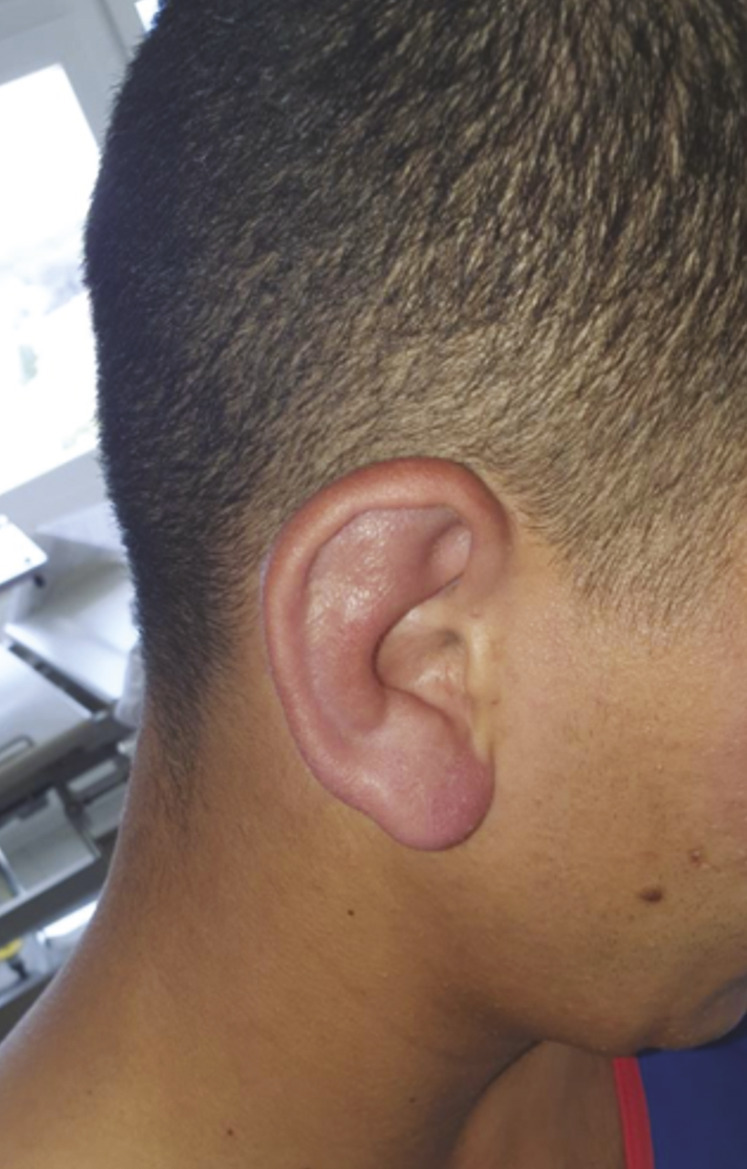
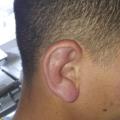
Des lésions cutanées maculeuses d’allure urticarienne légèrement prurigineuses siègent au niveau des membres (fig. 2 ), du visage, du tronc et des oreilles (fig. 3 ). Le bilan étiologique initial est sans anomalie (hémogramme, ionogramme, bilan rénal, hépatique, CRP, CPK, paludisme, dengue, VHB, VHC, VIH, arboviroses, EBV, CMV, syphilis). Une tentative de traitement par anti-inflammatoires non stéroïdiens par voie orale puis parentérale se solde par un échec. Puis une corticothérapie probabiliste (1 mg/kg) permet une nette amélioration clinique.
Les examens complémentaires (ponction articulaire, imagerie et bilan immunologique) réalisés lors de l’hospitalisation à la suite du rapatriement sanitaire sont dans les limites de la normale. La biopsie cutanée pose le diagnostic de lèpre paucibacillaire (borderline tuberculoïde). Il n’y a pas de réaction immunitaire de type 2 ni de vascularite ou de présence de polynucléaires neutrophiles associée. Le bilan d’extension par électroneuromyogramme montre une polyneuropathie axonale asymétrique avec atteintes multiples.
Une réunion de concertation pluridisciplinaire nationale conclut à une lèpre paucibacillaire avec réaction immunitaire de type 1 et met en place un traitement selon le protocole de l’OMS, reposant sur une tri-antibiothérapie (rifampicine 600 mg/mois, Disulone [dapsone et oxalate de fer] 100 mg/j, clofazimine 50 mg/j + clofazimine 300 mg/mois) pour une durée théorique d’un an, associée à une corticothérapie à forte dose (1,5 mg/kg) pendant un mois, puis une décroissance progressive sur cinq mois au vu de la sévérité de l’atteinte neurologique.
À trois mois, on note une amélioration des atteintes sensitives mais l’apparition d’une acné cortico-induite, tandis que la surveillance biologique (hématologique, hépatique et de la méthémoglobinémie) est normale.
Des lésions cutanées maculeuses d’allure urticarienne légèrement prurigineuses siègent au niveau des membres (
Les examens complémentaires (ponction articulaire, imagerie et bilan immunologique) réalisés lors de l’hospitalisation à la suite du rapatriement sanitaire sont dans les limites de la normale. La biopsie cutanée pose le diagnostic de lèpre paucibacillaire (borderline tuberculoïde). Il n’y a pas de réaction immunitaire de type 2 ni de vascularite ou de présence de polynucléaires neutrophiles associée. Le bilan d’extension par électroneuromyogramme montre une polyneuropathie axonale asymétrique avec atteintes multiples.
Une réunion de concertation pluridisciplinaire nationale conclut à une lèpre paucibacillaire avec réaction immunitaire de type 1 et met en place un traitement selon le protocole de l’OMS, reposant sur une tri-antibiothérapie (rifampicine 600 mg/mois, Disulone [dapsone et oxalate de fer] 100 mg/j, clofazimine 50 mg/j + clofazimine 300 mg/mois) pour une durée théorique d’un an, associée à une corticothérapie à forte dose (1,5 mg/kg) pendant un mois, puis une décroissance progressive sur cinq mois au vu de la sévérité de l’atteinte neurologique.
À trois mois, on note une amélioration des atteintes sensitives mais l’apparition d’une acné cortico-induite, tandis que la surveillance biologique (hématologique, hépatique et de la méthémoglobinémie) est normale.
La lèpre est une infection non fébrile associant des lésions cutanées et nerveuses due à Mycobacterium leprae. La multiplication de cette bactérie est lente, favorisée par une température entre 33 et 35 °C, d’où sa localisation préférentiellement périphérique dans les zones « froides » du corps (nez, oreilles) avec une incubation entre trois et vingt ans. La contagiosité est faible et la contamination se fait dans l’enfance avec une transmission par gouttelettes. L’homme est le seul réservoir de la maladie en dehors du tatou sauvage d’Amérique, et le déclenchement de la maladie nécessite une prédisposition génétique.1 En 2019, l’incidence de la lèpre était de 202 256 cas avec 90 % des contaminations en Amérique du Sud, en Inde et en Indonésie. Près de 2,8 millions de patients sont dénombrés dans le monde.2
La nouvelle classification distingue deux formes de lèpre : pauci- et multibacillaire.3
Lorsque la réponse cellulaire est suffisamment efficace, la réplication du bacille est inhibée, permettant de limiter les lésions. En revanche, lorsque la réponse cellulaire est prise en défaut (prédisposition génétique), le bacille se réplique de manière lente mais importante au niveau des macrophages, induisant de nombreuses lésions. Les caractéristiques des deux formes polaires sont décrites dans letableau 1 .4 Par ailleurs, l’atteinte neurologique s’explique par la réaction immuno-inflammatoire étranglant le nerf dans sa gaine inextensible.3-6
Cela permet d’expliquer la dissociation entre la sensibilité thermo-algique (abolie) et la sensibilité au tact (conservée initialement), qui est quasi pathognomonique.
Le diagnostic, parfois évident lors d’une lèpre lépromateuse avancée, repose principalement sur le trépied suivant : lésions cutanées (macules/papules hypochromiques parfois associées à une abolition de la sensibilité thermo-algique), palpation des troncs nerveux périphériques (cubital, médian, sciatique poplité externe) et mise en évidence du bacille lors d’un écouvillonnage nasal, d’un prélèvement du suc dermique des oreilles ou d’une biopsie cutanée.4 En outre, on observe une disparition de la sueur par destruction des glandes sudoripares5 au niveau des lésions dans la lèpre tuberculoïde, ainsi qu’une perte des sourcils et une infiltration diffuse orangée (ou cuivrée selon le phototype) pour la lèpre lépromateuse.
Les diagnostics différentiels à évoquer sont la leishmaniose cutanée, la sarcoïdose, et la neurofibromatose de Recklinghausen.
De manière analogue au diabète, la perte de la sensibilité peut entraîner des maux perforants plantaires, des amputations et des ulcérations. On retrouve aussi des atteintes oculaires, oto-rhino-laryngologiques et ostéoarticulaires. La lèpre peut se compliquer de manifestations inflammatoires aiguës chez 25 % des patients en cours ou au décours du traitement.
Le traitement repose sur une tri-antibiothérapie par dapsone, rifampicine et clofazimine dont les schémas d’administration sont décrits dans le tableau 2 .4 Seule la durée de traitement diffère entre les lèpres pauci- et multibacillaires. Lors des atteintes réactionnelles ou pour des atteintes nerveuses importantes, une corticothérapie (0,5-1 mg/kg) est ajoutée.4
Une surveillance rapprochée (hebdomadaire puis mensuelle) est nécessaire pour éliminer une anémie hémolytique ou une méthémoglobinémie sous dapsone ainsi que pour contrôler le retentissement hépatique de la rifampicine.4
Le vaccin BCG réalisé dans l’enfance permettrait une protection, variant entre 20 et 80 % selon les études.3 Dans le cadre d’une stratégie mondiale, une chimioprophylaxie par rifampicine 600 mg est recommandée pour le cercle proche (familial) lors d’une infection multibacillaire.4 Face à l’apparition de résistances aux traitements antibiotiques classiques (rifampicine et dapsone), des polychimiothérapies associant ofloxacine, minocycline ou clarithromycine seraient une alternative intéressante.1
La nouvelle classification distingue deux formes de lèpre : pauci- et multibacillaire.3
Lorsque la réponse cellulaire est suffisamment efficace, la réplication du bacille est inhibée, permettant de limiter les lésions. En revanche, lorsque la réponse cellulaire est prise en défaut (prédisposition génétique), le bacille se réplique de manière lente mais importante au niveau des macrophages, induisant de nombreuses lésions. Les caractéristiques des deux formes polaires sont décrites dans le
Cela permet d’expliquer la dissociation entre la sensibilité thermo-algique (abolie) et la sensibilité au tact (conservée initialement), qui est quasi pathognomonique.
Le diagnostic, parfois évident lors d’une lèpre lépromateuse avancée, repose principalement sur le trépied suivant : lésions cutanées (macules/papules hypochromiques parfois associées à une abolition de la sensibilité thermo-algique), palpation des troncs nerveux périphériques (cubital, médian, sciatique poplité externe) et mise en évidence du bacille lors d’un écouvillonnage nasal, d’un prélèvement du suc dermique des oreilles ou d’une biopsie cutanée.4 En outre, on observe une disparition de la sueur par destruction des glandes sudoripares5 au niveau des lésions dans la lèpre tuberculoïde, ainsi qu’une perte des sourcils et une infiltration diffuse orangée (ou cuivrée selon le phototype) pour la lèpre lépromateuse.
Les diagnostics différentiels à évoquer sont la leishmaniose cutanée, la sarcoïdose, et la neurofibromatose de Recklinghausen.
De manière analogue au diabète, la perte de la sensibilité peut entraîner des maux perforants plantaires, des amputations et des ulcérations. On retrouve aussi des atteintes oculaires, oto-rhino-laryngologiques et ostéoarticulaires. La lèpre peut se compliquer de manifestations inflammatoires aiguës chez 25 % des patients en cours ou au décours du traitement.
Le traitement repose sur une tri-antibiothérapie par dapsone, rifampicine et clofazimine dont les schémas d’administration sont décrits dans le
Une surveillance rapprochée (hebdomadaire puis mensuelle) est nécessaire pour éliminer une anémie hémolytique ou une méthémoglobinémie sous dapsone ainsi que pour contrôler le retentissement hépatique de la rifampicine.4
Le vaccin BCG réalisé dans l’enfance permettrait une protection, variant entre 20 et 80 % selon les études.3 Dans le cadre d’une stratégie mondiale, une chimioprophylaxie par rifampicine 600 mg est recommandée pour le cercle proche (familial) lors d’une infection multibacillaire.4 Face à l’apparition de résistances aux traitements antibiotiques classiques (rifampicine et dapsone), des polychimiothérapies associant ofloxacine, minocycline ou clarithromycine seraient une alternative intéressante.1
Références
1. Reibel F, Cambau E, Aubry A. Update on the epidemiology, diagnosis, and treatment of leprosy. Med Mal Infect 2015;45(9):383-93.
2. World Health Organization. Vers zéro lèpre. Stratégie mondiale de lutte contre la lèpre (maladie de Hansen) 2021-2030. 2021.
3. Ramaratnam S. Leprosy neuropathy. Medscape 2017 update 2023.
4. Ajana F, Baril L, Del Giudice P, Develoux M, Epelboin L, Faucher JF. ePilly Trop. Maladies infectieuses tropicales. 3e Ed. web. Alinéa Plus, 2022.
5. Lewis F. Dermatologic manifestations of leprosy clinical presentation. Medscape 2018.
6. Bourée P, de Carsalade GY. Aspects actuels de la lèpre. Rev Prat 2012;62:751-5.
2. World Health Organization. Vers zéro lèpre. Stratégie mondiale de lutte contre la lèpre (maladie de Hansen) 2021-2030. 2021.
3. Ramaratnam S. Leprosy neuropathy. Medscape 2017 update 2023.
4. Ajana F, Baril L, Del Giudice P, Develoux M, Epelboin L, Faucher JF. ePilly Trop. Maladies infectieuses tropicales. 3e Ed. web. Alinéa Plus, 2022.
5. Lewis F. Dermatologic manifestations of leprosy clinical presentation. Medscape 2018.
6. Bourée P, de Carsalade GY. Aspects actuels de la lèpre. Rev Prat 2012;62:751-5.