Le retentissement, parfois majeur, sur la qualité de vie justifie un traitement efficace.
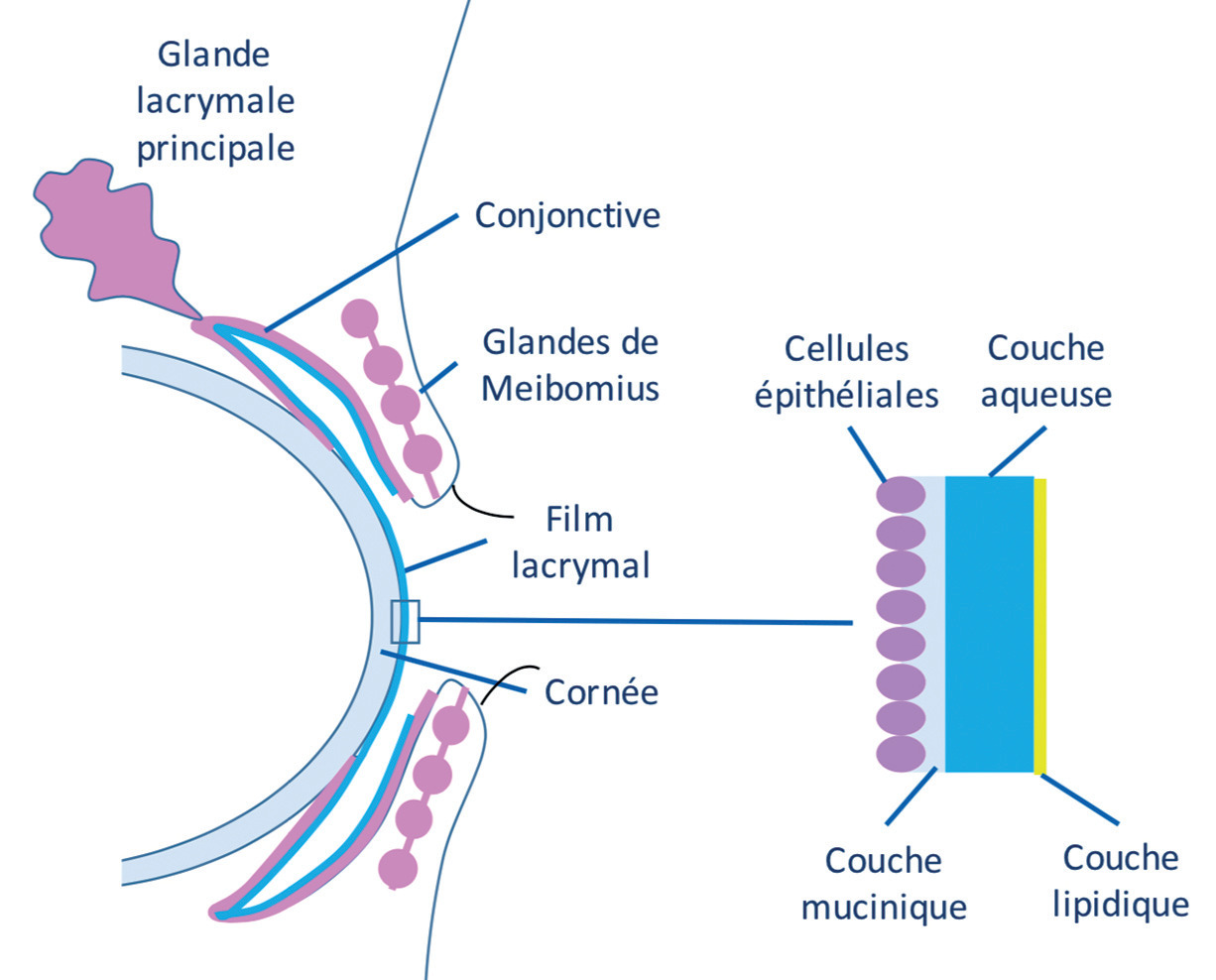
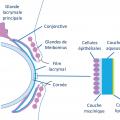
Le film lacrymal normal est composé schématiquement de trois couches :
– mucinique, synthétisée par les cellules à mucus, qui permet d’ancrer les larmes à la surface oculaire ;
– aqueuse, sécrétée par les glandes lacrymales ;
– lipidique, produite par les glandes de Meibomius, qui stabilise l’ensemble et limite l’évaporation (fig. 1 ).
– mucinique, synthétisée par les cellules à mucus, qui permet d’ancrer les larmes à la surface oculaire ;
– aqueuse, sécrétée par les glandes lacrymales ;
– lipidique, produite par les glandes de Meibomius, qui stabilise l’ensemble et limite l’évaporation (
Physiopathologie
On distingue deux grandes catégories de sécheresse : par hyperévaporation dont la cause la plus fréquente est la dysfonction meibomienne ; par hyposécrétion, lors d’une maladie de Gougerot-Sjögren ou secondaire à la prise de médicaments diminuant la sécrétion des larmes.
Elles aboutissent à la même altération de tous les composants du film lacrymal. Conséquence : une déshydratation des cellules épithéliales et une perturbation de l’équilibre osmotique local, qui a mené au concept d’hyperosmolarité lacrymale.1
Celle-ci entraîne souffrance et mort cellulaires, à l’origine d’une réaction inflammatoire de la surface oculaire. Un certain degré d’inflammation est quasiment toujours présent dans la kératoconjonctivite sèche (KCS), même si cela n’est pas toujours facile à identifier cliniquement : les yeux ne sont pas forcément rouges.
De nombreux éléments le confirment : infiltrat de cellules inflammatoires, marqueurs HLA de type 2 en surface de l’épithélium.2 L’imagerie microscopique in vivo de la surface oculaire montre la réaction inflammatoire et ses conséquences : cellules de Langherans et raréfaction des mucocytes.
L’examen clinique et l’imagerie oculaire moderne permettent de mieux cerner l’implication fréquente des glandes de Meibomius, notamment dans des sécheresses initialement considérées comme secondaires à une hyposécrétion lacrymale isolée.
Au total, les différentes causes de sécheresse oculaire conduisent à des troubles communs, combinant instabilité du film lacrymal, inflammation, hyperosmolarité et mort cellulaire, ces grands mécanismes s’auto-entretenant en un cercle vicieux.3
Elles aboutissent à la même altération de tous les composants du film lacrymal. Conséquence : une déshydratation des cellules épithéliales et une perturbation de l’équilibre osmotique local, qui a mené au concept d’hyperosmolarité lacrymale.1
Celle-ci entraîne souffrance et mort cellulaires, à l’origine d’une réaction inflammatoire de la surface oculaire. Un certain degré d’inflammation est quasiment toujours présent dans la kératoconjonctivite sèche (KCS), même si cela n’est pas toujours facile à identifier cliniquement : les yeux ne sont pas forcément rouges.
De nombreux éléments le confirment : infiltrat de cellules inflammatoires, marqueurs HLA de type 2 en surface de l’épithélium.2 L’imagerie microscopique in vivo de la surface oculaire montre la réaction inflammatoire et ses conséquences : cellules de Langherans et raréfaction des mucocytes.
L’examen clinique et l’imagerie oculaire moderne permettent de mieux cerner l’implication fréquente des glandes de Meibomius, notamment dans des sécheresses initialement considérées comme secondaires à une hyposécrétion lacrymale isolée.
Au total, les différentes causes de sécheresse oculaire conduisent à des troubles communs, combinant instabilité du film lacrymal, inflammation, hyperosmolarité et mort cellulaire, ces grands mécanismes s’auto-entretenant en un cercle vicieux.3
Impact sur la qualité de vie
La sécheresse oculaire souffrait de l’image d’une maladie sans grande conséquence fonctionnelle (risque faible ou nul de perte de vision définitive), avec finalement peu d’options thérapeutiques franchement efficaces. De nombreuses études ont battu en brèche ces idées reçues.
Les nouveaux moyens d’évaluation (telle l’aberrométrie), bien plus sensibles, expliquent le flou visuel dont se plaignent les patients, alors qu’ils ont le plus souvent 10/10 d’acuité visuelle. L’irrégularité et l’instabilité du film lacrymal se traduisent en effet par des aberrations optiques de haut degré qui augmentent avec le temps entre chaque clignement.4
Plusieurs études ont démontré l’impact majeur tant sur la vie privée que professionnelle des patients. Par exemple, les perturbations engendrées par la KCS seraient comparables à celles de l’angine de poitrine.5 Les symptômes anxiodépressifs sont en outre significativement plus fréquents chez les sujets souffrant de sécheresse oculaire.6
Les nouveaux moyens d’évaluation (telle l’aberrométrie), bien plus sensibles, expliquent le flou visuel dont se plaignent les patients, alors qu’ils ont le plus souvent 10/10 d’acuité visuelle. L’irrégularité et l’instabilité du film lacrymal se traduisent en effet par des aberrations optiques de haut degré qui augmentent avec le temps entre chaque clignement.4
Plusieurs études ont démontré l’impact majeur tant sur la vie privée que professionnelle des patients. Par exemple, les perturbations engendrées par la KCS seraient comparables à celles de l’angine de poitrine.5 Les symptômes anxiodépressifs sont en outre significativement plus fréquents chez les sujets souffrant de sécheresse oculaire.6
évaluation et suivi
Ces données et de nouveaux traitements plus efficaces (cf. infra) ont changé la manière d’évaluer et de suivre cette pathologie. Les rapports du DEWS I (Dry Eye WorkShop) en 2007 et DEWS II en 2017 ont permis, dans une certaine mesure, d’homogénéiser les pratiques.1
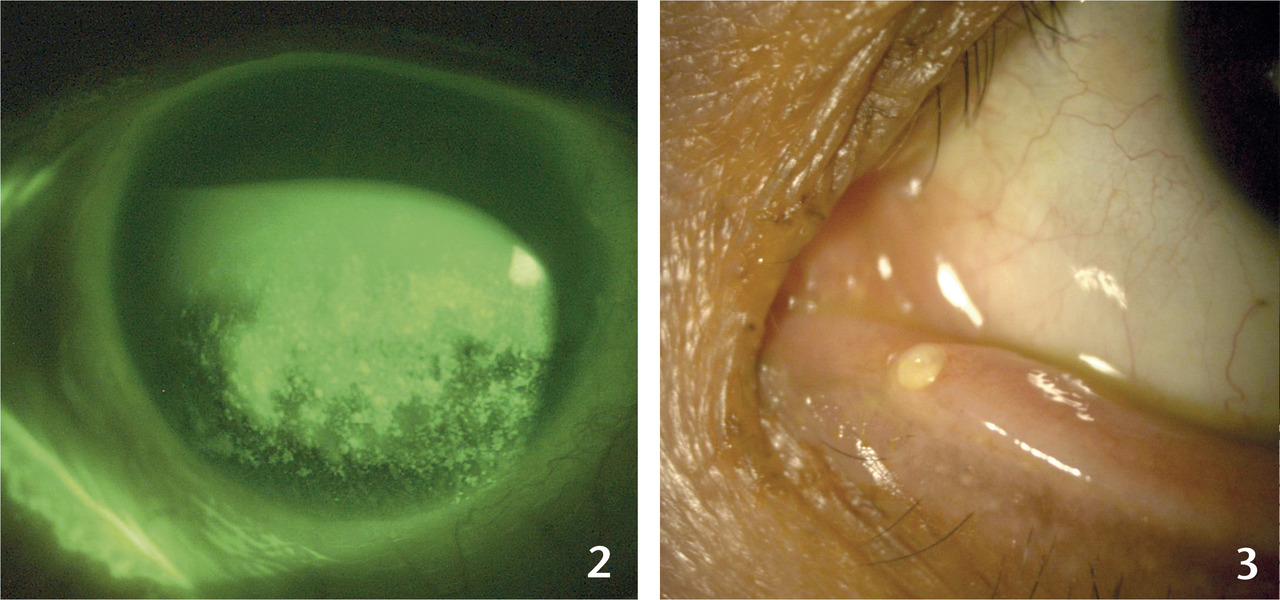
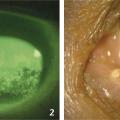
évaluation objective : cotation du marquage conjonctival et cornéen (score d’Oxford), après instillation de fluorescéine (kératite ponctuée superficielle ;fig. 2 ) ; temps de rupture du film lacrymal (diminué), mesure de la sécrétion lacrymale par test de Schirmer (papier buvard placé dans le cul-de-sac inférieur, sans anesthésie), étude de la morphologie et de la fonction des glandes de Meibomius au bord palpébral (à la lampe à fente ou à l’aide de photographie en lumière infrarouge).
S’y ajoute désormais l’appréciation du retentissement fonctionnelvia des questionnaires (le plus fréquemment utilisé étant l’OSDI ou Ocular Surface Disease Index) ou, plus simplement, à l’aide d’une échelle visuelle analogique.
évaluation objective : cotation du marquage conjonctival et cornéen (score d’Oxford), après instillation de fluorescéine (kératite ponctuée superficielle ;
S’y ajoute désormais l’appréciation du retentissement fonctionnelvia des questionnaires (le plus fréquemment utilisé étant l’OSDI ou Ocular Surface Disease Index) ou, plus simplement, à l’aide d’une échelle visuelle analogique.
Substituts lacrymaux
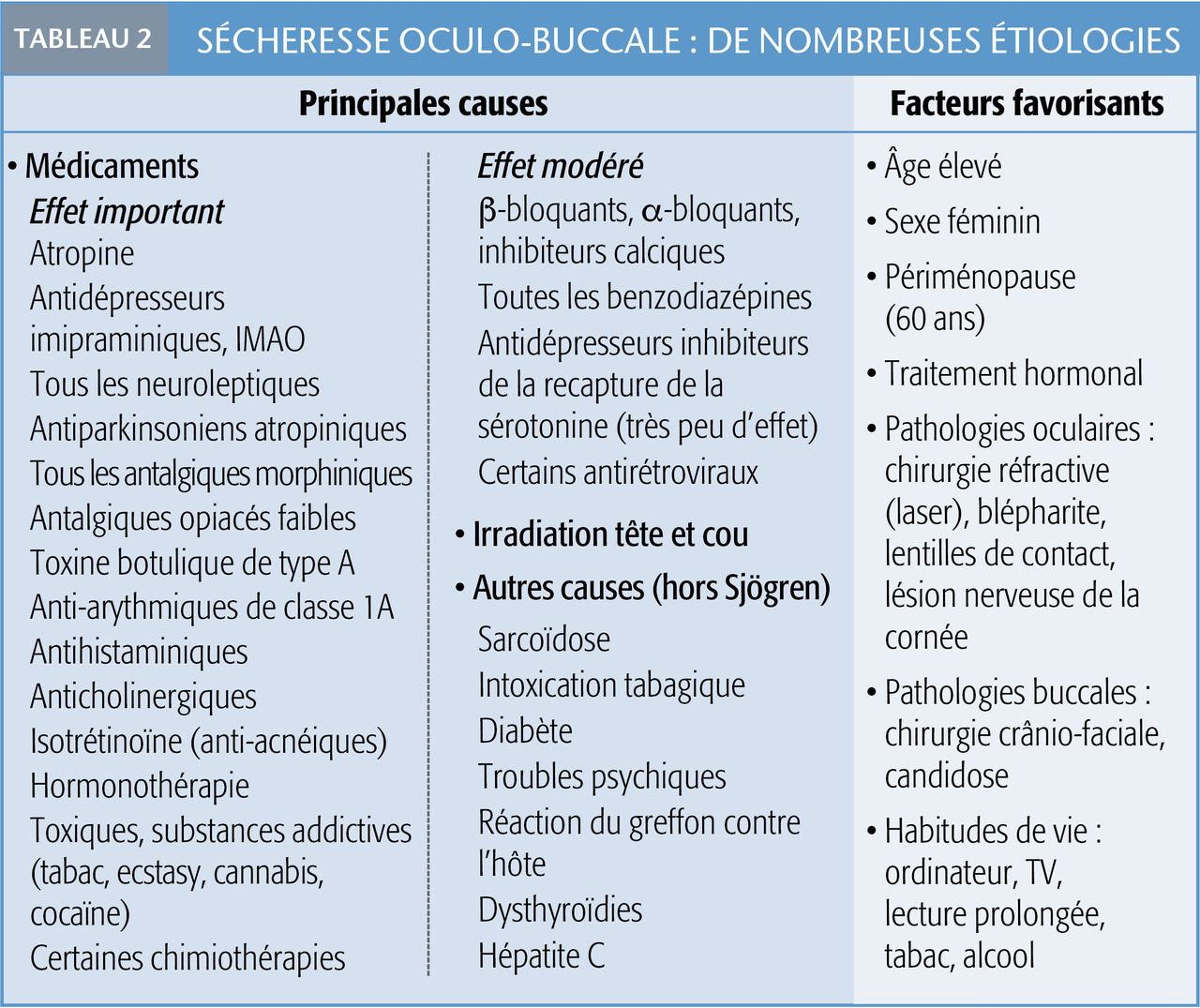
Les émollients, tels que les polymères de vinyl, les dérivés cellulosiques, les carbomères, l’HP-guar ou l’acide hyaluronique, confèrent la viscosité, par conséquent la rémanence sur la surface oculaire.7
Certaines molécules (carbomères, acide hyaluronique) forment des réseaux qui retiennent les molécules d’eau.
L’avantage d’une persistance importante du produit sur la cornée est un soulagement prolongé. A contrario, l’inconvénient des composés visqueux est un flou visuel à l’instillation, et certains d’entre eux forment des cristaux collant aux cils en séchant.
Ces composés peuvent être combinés à des osmorégu- lateurs, comme le tréhalose, la lévocarnitine ou l’érythritol, protégeant contre les dégâts de l’hyperosmolarité lacrymale.
D’autres substituts comportent des émulsions lipidiques qui remplacent le film protecteur défaillant (tableau 1 ).
On recommande d’en prescrire plusieurs de classes différentes, que les patients adaptent à leur activité et à leur ressenti subjectif. Les formules ne contenant pas de conservateurs sont préférables, puisque ces derniers (en particulier le chlorure de benzalkonium) sont toxiques pour la surface oculaire.
Certaines molécules (carbomères, acide hyaluronique) forment des réseaux qui retiennent les molécules d’eau.
L’avantage d’une persistance importante du produit sur la cornée est un soulagement prolongé. A contrario, l’inconvénient des composés visqueux est un flou visuel à l’instillation, et certains d’entre eux forment des cristaux collant aux cils en séchant.
Ces composés peuvent être combinés à des osmorégu- lateurs, comme le tréhalose, la lévocarnitine ou l’érythritol, protégeant contre les dégâts de l’hyperosmolarité lacrymale.
D’autres substituts comportent des émulsions lipidiques qui remplacent le film protecteur défaillant (
On recommande d’en prescrire plusieurs de classes différentes, que les patients adaptent à leur activité et à leur ressenti subjectif. Les formules ne contenant pas de conservateurs sont préférables, puisque ces derniers (en particulier le chlorure de benzalkonium) sont toxiques pour la surface oculaire.
Autres traitements
Collyre à la ciclosporine
Intervenant sur la part inflammatoire des KCS, il est indiqué dans les formes sévères résistant au traitement de substitution bien prescrit et suivi. Dans ces cas, les corticoïdes locaux peuvent être efficaces, mais leurs effets secondaires (principalement cataracte et glaucome) limitent leur utilisation à des cures courtes, à l’effet transitoire.
En raison d’un passage systémique négligeable, l’administration topique de l’immunosuppresseur n’entraîne aucun des effets secondaires de la forme systémique. Des essais ont établi son innocuité, notamment l’absence de cancérogenèse locale.
Les ophtalmologistes n’ont longtemps eu le choix qu’entre une préparation de pharmacie hospitalière (concentrations variables) et Restasis à 0,05 % en autorisation temporaire d’utilisation.
Ikervis dosé à 0,1 % de ciclo-sporine est le premier traitement de cette catégorie ayant reçu l’AMM dans l’Union européenne (mars 2015). à la posologie d’une goutte par jour, il réduit l’inflammation de la surface oculaire et les lésions de KCS. Toutefois, il est préférable d’expliquer aux patients que l’amélioration clinique n’est pas immédiate (parfois retardée de plusieurs semaines) et que l’instillation peut occasionner une rougeur et des brûlures transitoires. Sa délivrance est encore réservée aux pharmacies hospitalières. Requérant une bonne connaissance des outils d’évaluation et de suivi de l’œil sec, sa prescription est réservée au spécialiste.
En raison d’un passage systémique négligeable, l’administration topique de l’immunosuppresseur n’entraîne aucun des effets secondaires de la forme systémique. Des essais ont établi son innocuité, notamment l’absence de cancérogenèse locale.
Les ophtalmologistes n’ont longtemps eu le choix qu’entre une préparation de pharmacie hospitalière (concentrations variables) et Restasis à 0,05 % en autorisation temporaire d’utilisation.
Ikervis dosé à 0,1 % de ciclo-sporine est le premier traitement de cette catégorie ayant reçu l’AMM dans l’Union européenne (mars 2015). à la posologie d’une goutte par jour, il réduit l’inflammation de la surface oculaire et les lésions de KCS. Toutefois, il est préférable d’expliquer aux patients que l’amélioration clinique n’est pas immédiate (parfois retardée de plusieurs semaines) et que l’instillation peut occasionner une rougeur et des brûlures transitoires. Sa délivrance est encore réservée aux pharmacies hospitalières. Requérant une bonne connaissance des outils d’évaluation et de suivi de l’œil sec, sa prescription est réservée au spécialiste.
Sérum autologue en collyre
Ce traitement d’exception, réservé aux formes rebelles, est préparé dans certaines pharmacies hospitalières à partir du sang du patient. Récupéré après centrifugation, dilué et conditionné en flacons, il peut soulager les cas les plus sévères mais reste contraignant sur le plan logistique.
Bouchons lacrymaux
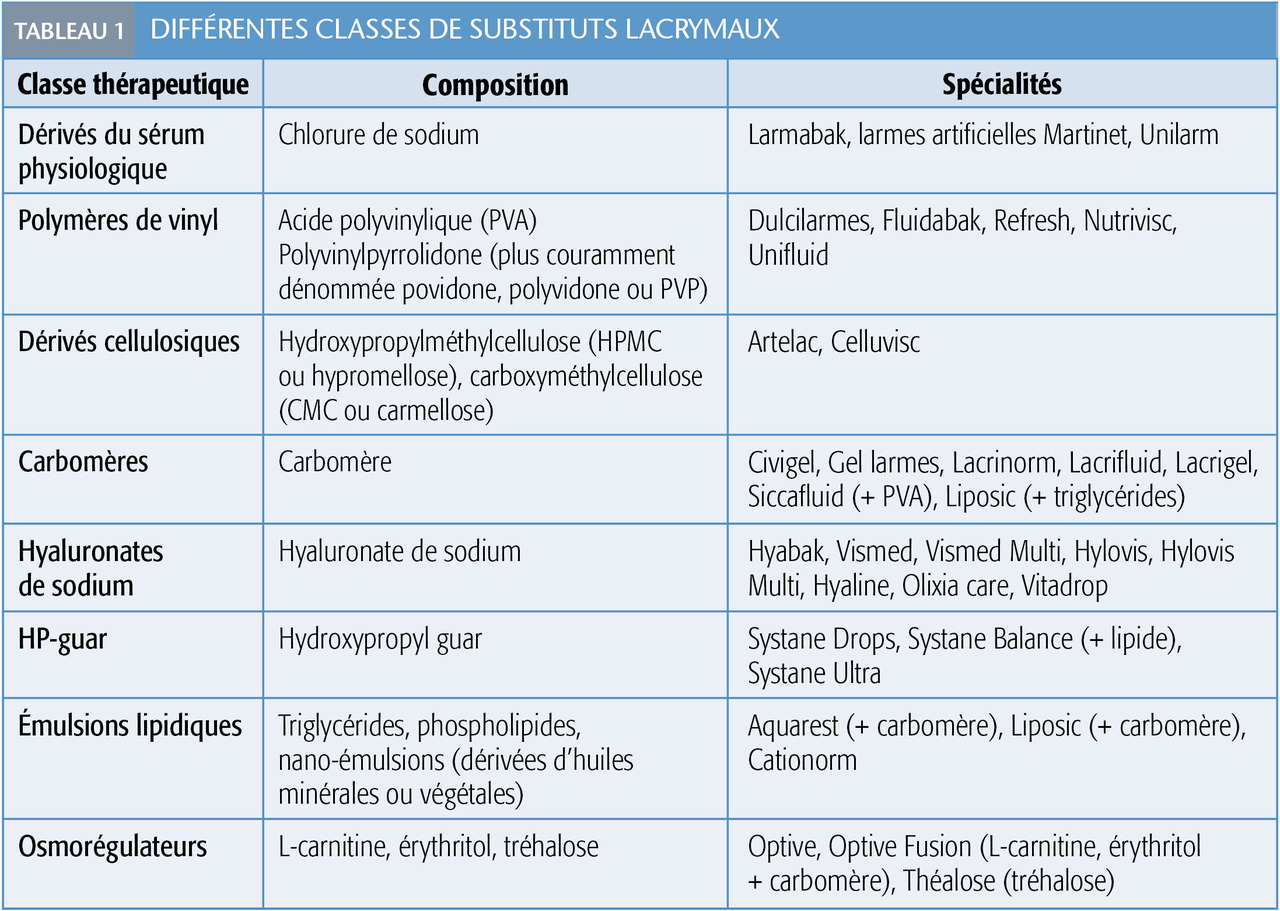
Ce ne sont pas vraiment des nouveautés, mais leur place dans le traitement de la KCS a gagné du terrain. Ces petits dispositifs, le plus souvent en silicone, se posent en quelques minutes en consultation : ils obstruent le canal lacrymal, bloquant l’évacuation des larmes (fig. 3 ).8 Ce moyen simple en augmente le volume et prolonge l’effet des substituts lacrymaux.
Ils sont très utiles pour traiter la KCS accompagnant de nombreuses pathologies : maladies systémiques (syndrome de Sjögren, atteinte oculaire de la maladie du greffon contre l’hôte), suites de chirurgie réfractive ou incidents de contactologie. Plusieurs modèles sont disponibles, classés selon leur positionnement (méatique ou intracanaliculaire) et leur caractère résorbable ou non.
Ils sont très utiles pour traiter la KCS accompagnant de nombreuses pathologies : maladies systémiques (syndrome de Sjögren, atteinte oculaire de la maladie du greffon contre l’hôte), suites de chirurgie réfractive ou incidents de contactologie. Plusieurs modèles sont disponibles, classés selon leur positionnement (méatique ou intracanaliculaire) et leur caractère résorbable ou non.
Lentilles sclérales
Elles ont un diamètre plus important que les lentilles de contact classiques. Elles s’appuient sur la sclère pour former une voûte au-dessus de la cornée, dont elles sont séparées par un intervalle libre rempli de sérum physiologique.
Ce réservoir maintient l’hydratation de surface et protège de l’irritation mécanique.
L’adaptation de ces lentilles, autrefois très technique, est facilitée par des modèles plus ergonomiques et de diamètre réduit.
Elles sont une option de choix dans les sécheresses très sévères résistantes aux autres traitements.9 Dans notre expérience, la tolérance et les résultats, tant sur les symptômes que sur la KCS, sont impressionnants.
Ce réservoir maintient l’hydratation de surface et protège de l’irritation mécanique.
L’adaptation de ces lentilles, autrefois très technique, est facilitée par des modèles plus ergonomiques et de diamètre réduit.
Elles sont une option de choix dans les sécheresses très sévères résistantes aux autres traitements.9 Dans notre expérience, la tolérance et les résultats, tant sur les symptômes que sur la KCS, sont impressionnants.
Dysfonctions meibomiennes
Cause très fréquente de KCS, leur traitement repose classiquement sur les soins de paupière visant à vidanger les glandes : application de chaleur, suivie d’un massage digital et rinçage oculaire au sérum physiologique, puis administration de sub-stituts lacrymaux.
Des dispositifs plus sophistiqués combinant chaleur et compression (Lipiflow) ont été développés : lumière pulsée appliquée au bord paupébral (e-eye) ou lunettes chauffantes à chambre humide (Blephasteam). Les résultats sont très encourageants, mais le prix et l’absence de remboursement limitent leur diffusion.
Le collyre à l’azithromycine (Azyter), en cures mensuelles ou bimensuelles à visée immunomodulatrice, peut également être utile.10
Dans les cas sévères ou si la dysfonction meibomienne est due à une rosacée avec atteinte cutanée associée, un traitement par doxycycline per os peut être proposé (100 g/j pendant plusieurs semaines). l
Des dispositifs plus sophistiqués combinant chaleur et compression (Lipiflow) ont été développés : lumière pulsée appliquée au bord paupébral (e-eye) ou lunettes chauffantes à chambre humide (Blephasteam). Les résultats sont très encourageants, mais le prix et l’absence de remboursement limitent leur diffusion.
Le collyre à l’azithromycine (Azyter), en cures mensuelles ou bimensuelles à visée immunomodulatrice, peut également être utile.10
Dans les cas sévères ou si la dysfonction meibomienne est due à une rosacée avec atteinte cutanée associée, un traitement par doxycycline per os peut être proposé (100 g/j pendant plusieurs semaines). l
références
1. Bron AJ, de Paiva CS, Chauhan SK, et al. TFOS DEWS II pathophysiology report. Ocul Surf 2017;15:438-510.
2. Brignole F, Pisella PJ, Goldschild M, De Saint Jean M, Goguel A, Baudouin C. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000; 41:1356-63.
3. Baudouin C, Aragona P, Messmer EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease: proceedings of the OCEAN group meeting. Ocul Surf 2013;11:246-58.
4. Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012;119:1811-8.
5. Schiffman RM, Walt JG, Jacobsen G, Doyle JJ, Lebovics G, Sumner W. Utility assessment among patients with dry eye disease. Ophthalmology 2003;110:1412-9.
6. Labbe A, Wang YX, Jie Y, Baudouin C, Jonas JB, Xu L. Dry eye disease, dry eye symptoms and depression: the Beijing Eye Study. Br J Ophthalmol 2013;97:1399-403.
7. Rousseau A, M’Garrech M, Barreau E, Bonin L, Labetoulle M. Les substituts lacrymaux. In: Pisella PJ, Baudouin C, Hoang-Xuan T, ed. Surface oculaire. Paris: Masson; 2015: 521-36.
8. Bourkiza R, Lee V. A review of the complications of lacrimal occlusion with punctal and canalicular plugs. Orbit 2012;31:86-93.
9. Rossi P, Delcampe A, Gueudry J, et al. Traitement des sécheresses oculaires sévères secondaires à la maladie du greffon contre l’hôte chronique par lentilles sclérales perméables à l’oxygène. J Fr Ophtalmol 2015;38:793-9.
10. Jones L, Downie LE, Korb D, et al. TFOS DEWS II Management and Therapy Report. Ocul Surf 2017;15:575-628.
2. Brignole F, Pisella PJ, Goldschild M, De Saint Jean M, Goguel A, Baudouin C. Flow cytometric analysis of inflammatory markers in conjunctival epithelial cells of patients with dry eyes. Invest Ophthalmol Vis Sci 2000; 41:1356-63.
3. Baudouin C, Aragona P, Messmer EM, et al. Role of hyperosmolarity in the pathogenesis and management of dry eye disease: proceedings of the OCEAN group meeting. Ocul Surf 2013;11:246-58.
4. Denoyer A, Rabut G, Baudouin C. Tear film aberration dynamics and vision-related quality of life in patients with dry eye disease. Ophthalmology 2012;119:1811-8.
5. Schiffman RM, Walt JG, Jacobsen G, Doyle JJ, Lebovics G, Sumner W. Utility assessment among patients with dry eye disease. Ophthalmology 2003;110:1412-9.
6. Labbe A, Wang YX, Jie Y, Baudouin C, Jonas JB, Xu L. Dry eye disease, dry eye symptoms and depression: the Beijing Eye Study. Br J Ophthalmol 2013;97:1399-403.
7. Rousseau A, M’Garrech M, Barreau E, Bonin L, Labetoulle M. Les substituts lacrymaux. In: Pisella PJ, Baudouin C, Hoang-Xuan T, ed. Surface oculaire. Paris: Masson; 2015: 521-36.
8. Bourkiza R, Lee V. A review of the complications of lacrimal occlusion with punctal and canalicular plugs. Orbit 2012;31:86-93.
9. Rossi P, Delcampe A, Gueudry J, et al. Traitement des sécheresses oculaires sévères secondaires à la maladie du greffon contre l’hôte chronique par lentilles sclérales perméables à l’oxygène. J Fr Ophtalmol 2015;38:793-9.
10. Jones L, Downie LE, Korb D, et al. TFOS DEWS II Management and Therapy Report. Ocul Surf 2017;15:575-628.