Indispensable à la vie mais aux fonctions exactes encore mal comprises, le sommeil a des caractéristiques très stables chez un individu donné, avec toutefois des variations liées à l’âge, aux habitudes et aux contraintes environnementales.
Selon une définition comportementale, le sommeil est un état physiologique périodique et réversible caractérisé par une diminution de l’état de conscience et une limitation des processus perceptuels. Chez l’homme, le sommeil normal se produit en position assise ou déclive, s’accompagne d’une fermeture des yeux, d’une quiescence comportementale et de manifestations physiologiques cérébrales, métaboliques et cardiovasculaires qui lui sont propres.
Étonnamment, les fonctions exactes du sommeil sont encore incomplètement élucidées. D’un point de vue phylogénétique, le sommeil est un état physiologique observable chez tous les organismes vivants disposant d’un réseau neuronal et glial, du nématode Caenorhabditis elegans jusqu’aux primates. Certains réseaux très élémentaires de neurones peuvent induire un état de sommeil, ainsi sa survenue ne nécessite pas une organisation anatomique hautement spécialisée du système nerveux central. Plusieurs hypothèses non mutuellement exclusives ont été avancées pour expliquer les fonctions du sommeil.1 Le sommeil aurait premièrement une fonction de conservation de l’énergie, permettant à l’organisme une consommation calorique modulable pour accomplir les besoins physiologiques nécessaires à la survie et à son adaptation à l’environnement. Le sommeil pourrait également avoir une fonction de régulation de notre système immunitaire, et permettrait de réguler la synthèse de nombreuses hormones et protéines. D’autres hypothèses avancent des fonctions plus spécifiques au fonctionnement du système nerveux central, comme la mémorisation, la restauration des dépenses énergétiques liées au fonctionnement cérébral permettant de compenser la dégradation des performances induites par la veille. Parmi les hypothèses les plus documentées, le sommeil aurait une fonction majeure dans la modulation de l’organisation des réseaux neuronaux et de leur plasticité, via une action spécifique au niveau synaptique. Enfin, des travaux plus récents soulignent le rôle majeur du tissu glial au cours du sommeil, via le système glymphatique qui permettrait d’éliminer des substances plus ou moins toxiques accumulées lors de la veille.2
Cet article résume ici les grands principes physiologiques qui régissent l’organisation du sommeil normal, sa répartition au cours des 24 heures, la régulation de son alternance avec la veille et son évolution en fonction de l’âge.
Étonnamment, les fonctions exactes du sommeil sont encore incomplètement élucidées. D’un point de vue phylogénétique, le sommeil est un état physiologique observable chez tous les organismes vivants disposant d’un réseau neuronal et glial, du nématode Caenorhabditis elegans jusqu’aux primates. Certains réseaux très élémentaires de neurones peuvent induire un état de sommeil, ainsi sa survenue ne nécessite pas une organisation anatomique hautement spécialisée du système nerveux central. Plusieurs hypothèses non mutuellement exclusives ont été avancées pour expliquer les fonctions du sommeil.1 Le sommeil aurait premièrement une fonction de conservation de l’énergie, permettant à l’organisme une consommation calorique modulable pour accomplir les besoins physiologiques nécessaires à la survie et à son adaptation à l’environnement. Le sommeil pourrait également avoir une fonction de régulation de notre système immunitaire, et permettrait de réguler la synthèse de nombreuses hormones et protéines. D’autres hypothèses avancent des fonctions plus spécifiques au fonctionnement du système nerveux central, comme la mémorisation, la restauration des dépenses énergétiques liées au fonctionnement cérébral permettant de compenser la dégradation des performances induites par la veille. Parmi les hypothèses les plus documentées, le sommeil aurait une fonction majeure dans la modulation de l’organisation des réseaux neuronaux et de leur plasticité, via une action spécifique au niveau synaptique. Enfin, des travaux plus récents soulignent le rôle majeur du tissu glial au cours du sommeil, via le système glymphatique qui permettrait d’éliminer des substances plus ou moins toxiques accumulées lors de la veille.2
Cet article résume ici les grands principes physiologiques qui régissent l’organisation du sommeil normal, sa répartition au cours des 24 heures, la régulation de son alternance avec la veille et son évolution en fonction de l’âge.
Organisation du sommeil normal
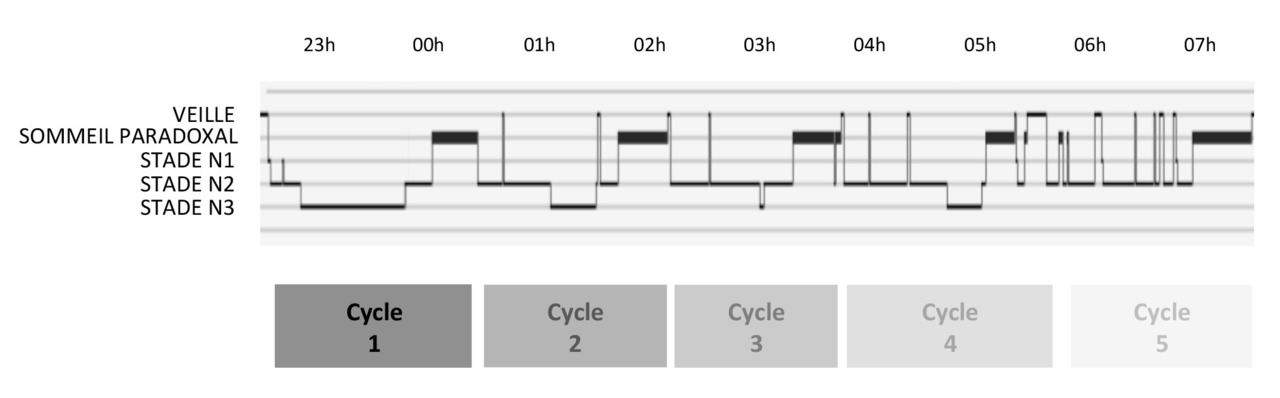
Le sommeil est un état dynamique qui répond à une organisation cyclique marquée par la succession d’états physiologiques de nature et d’intensité variables au fur et à mesure de son déroulement (fig. 1 ).3 En effet, le sommeil de l’homme est caractérisé par deux états distincts, le sommeil lent et le sommeil paradoxal. D’un point de vue phylogénétique, ces états peuvent être individualisés chez les mammifères et les oiseaux. Ils sont mutuellement exclusifs et résultent de l’activation et de l’inhibition de réseaux neuronaux spécifiques. Le sommeil lent et le sommeil paradoxal sont définis sur un ensemble de caractéristiques physiologiques propres, avec des rôles physiologiques distincts.
Sommeil lent
Le sommeil lent (ou sommeil « non-rapid eye movement ») de l’enfant et de l’adulte est par convention divisé en trois stades d’intensité graduelle, principalement définis par les caractéristiques de l’activité électro-encéphalographique (EEG) recueillie lors d’enregistrements de sommeil : le stade 1 du sommeil léger (ou N1), le stade 2 du sommeil léger (ou N2), et le sommeil lent profond (ou N3). Le sommeil lent est remarquable par l’alternance de synchronisation et de désynchronisation de l’activité EEG, définissant les tracés alternants cycliques. Chez l’adulte jeune, le sommeil lent représente de 75 à 85 % du temps total de sommeil nocturne. Le stade 2 est majoritaire, avec une proportion comprise entre 45 et 60 % du temps total de sommeil. Le stade 1 du sommeil lent représente moins de 5 % du temps total de sommeil, le sommeil lent profond est quant à lui compris entre 15 et 25 %. Ces proportions sont néanmoins très variables d’un individu à un autre, et au cours de la vie. Le sommeil lent s’associe généralement à une activité mentale minimale, peu complexe, correspondant volontiers à des pensées plutôt qu’à un rêve.
Sommeil paradoxal
Le sommeil paradoxal occupe généralement entre 15 et 25 % du temps total du sommeil de nuit. Il est caractérisé par une activité EEG essentiellement désynchronisée, proche de celle observée lors de la veille. Lors du sommeil paradoxal, il est observé une atonie musculaire ponctuée d’activations intermittentes des muscles oculomoteurs (les mouvements oculaires rapides) et des muscles striés (appelés twitches).4 Ces activations intermittentes s’accompagnent fréquemment de modifications transitoires de l’activité EEG (les ondes en dents de scie), définissant le sommeil paradoxal dit phasique, à l’inverse du sommeil paradoxal tonique. Le sommeil paradoxal s’accompagne volontiers d’une activité mentale intense, correspondant classiquement à l’activité onirique ou rêve.
Architecture du sommeil nocturne
L’organisation normale du sommeil est variable d’un individu à l’autre, sous l’influence d’une prédisposition génétique, de l’âge et de facteurs environnementaux.
L’organisation du sommeil de nuit est cyclique, caractérisée par la répétition de périodes de durée variable (les cycles de sommeil) au cours desquelles vont se succéder les différents stades de sommeil lent et paradoxal. Le stade N1 est un état de sommeil transitionnel observé dans les minutes suivant l’endormissement. Rapidement, le sommeil lent évolue vers le stade N2. Le sommeil lent s’approfondit progressivement vers du sommeil lent profond (stade N3). Un cycle de sommeil se conclut généralement par une phase de sommeil paradoxal. La durée et le nombre de cycles de sommeil varient d’un individu à l’autre et au cours de la vie pour un même individu. Ils sont en général au nombre de 4 à 6 chez l’adulte jeune et d’âge moyen, pour une durée comprise entre 60 et 120 minutes. Les cycles de sommeil sont souvent plus nombreux et plus courts chez l’enfant que chez le sujet âgé.
La proportion relative des différents stades de sommeil contenus dans un cycle évolue au cours de la nuit. Les premiers cycles de sommeil comportent une proportion plus importante de sommeil lent profond que les cycles de fin de nuit. À l’inverse, la proportion de sommeil paradoxal est faible sur les premiers cycles (parfois même absente) et augmente progressivement au fil de la nuit.
L’organisation du sommeil de nuit est cyclique, caractérisée par la répétition de périodes de durée variable (les cycles de sommeil) au cours desquelles vont se succéder les différents stades de sommeil lent et paradoxal. Le stade N1 est un état de sommeil transitionnel observé dans les minutes suivant l’endormissement. Rapidement, le sommeil lent évolue vers le stade N2. Le sommeil lent s’approfondit progressivement vers du sommeil lent profond (stade N3). Un cycle de sommeil se conclut généralement par une phase de sommeil paradoxal. La durée et le nombre de cycles de sommeil varient d’un individu à l’autre et au cours de la vie pour un même individu. Ils sont en général au nombre de 4 à 6 chez l’adulte jeune et d’âge moyen, pour une durée comprise entre 60 et 120 minutes. Les cycles de sommeil sont souvent plus nombreux et plus courts chez l’enfant que chez le sujet âgé.
La proportion relative des différents stades de sommeil contenus dans un cycle évolue au cours de la nuit. Les premiers cycles de sommeil comportent une proportion plus importante de sommeil lent profond que les cycles de fin de nuit. À l’inverse, la proportion de sommeil paradoxal est faible sur les premiers cycles (parfois même absente) et augmente progressivement au fil de la nuit.
Transitions entre veille et sommeil
L’endormissement correspond au passage de l’état de veille au sommeil. La définition de l’endormissement est complexe selon l’utilisation de critères comportementaux ou électrophysiologiques. D’un point de vue comportemental, l’endormissement peut être défini par la rupture de l’état de conscience lié à la veille (discontinuité de la pensée fluide, absence de réactivité aux stimulus perceptuels) survenant les yeux fermés. Cette définition est cependant insuffisante, dépendante de l’expérience vécue par le sujet. Aussi, l’endormissement peut ne pas être perçu par l’individu, parfois même en situation active, lors par exemple de la conduite automobile. En pratique clinique, la mesure de l’endormissement repose exclusivement sur des critères électrophysiologiques reproductibles et mesurables (obtenus via un enregistrement polysomnographique la nuit, ou des tests diurnes comme le test itératif de latence d’endormissement et le test de maintien de l’éveil). L’endormissement est défini par un ralentissement de l’activité EEG sur une durée suffisante (au moins 15 secondes). Cette définition électrophysiologique a cependant varié au cours des années et fait toujours actuellement l’objet de débats. En effet, des données d’enregistrements intracérébraux multisites suggèrent que l’activité cérébrale lors de l’endormissement n’est pas uniforme sur l’ensemble du cerveau.5 L’endormissement résulterait d’une transition progressive et hétérogène de différentes structures cérébrales d’un état de veille vers le sommeil.
L’endormissement s’effectue le plus souvent chez l’adulte sain de la veille vers le sommeil lent. L’endormissement en sommeil paradoxal est plus rare, hormis chez le nouveau-né et le nourrisson. Chez l’enfant et l’adulte, l’endormissement en sommeil paradoxal peut s’observer lors d’éveils brefs au cours d’une phase de sommeil paradoxal, surtout en fin de nuit et au petit matin. Des contraintes environnementales conduisant à un besoin anormalement élevé de sommeil paradoxal (comme dans le cadre d’une privation chronique de sommeil ou d’une levée brutale d’inhibition du sommeil paradoxal à la suite d’un sevrage médicamenteux en anti-dépresseur) peuvent également favoriser une transition directe de la veille vers ce stade de sommeil. L’endormissement en sommeil paradoxal peut enfin être le témoin d’un dysfonctionnement primaire des systèmes de régulation du sommeil et de la veille. Il s’observe notamment dans la cadre de la narcolepsie.
D’un point de vue comportemental, le réveil est défini par un retour à un état de conscience, de ses capacités perceptuelles et d’interaction avec son environnement. D’un point de vue électrophysiologique, le réveil est défini par la transition d’un état de sommeil à un état de veille, caractérisé par une accélération brutale de l’activité EEG et une augmentation du tonus musculaire pendant au moins 3 secondes. Il est classique de distinguer le réveil du micro-éveil, définis selon leur durée, plus ou moins de 15 secondes, respectivement. L’individu n’a généralement pas conscience de la survenue d’un micro-éveil, pouvant survenir jusqu’à 10 fois par heure de sommeil en l’absence de conditions pathologiques.
De même que pour l’endormissement, la transition du sommeil vers la veille ne s’effectue pas de façon homogène pour l’ensemble des structures cérébrales.6 Cette dissociation peut expliquer le phénomène d’inertie du sommeil, caractérisée par une difficulté à se sentir pleinement éveillé et opérationnel dans les minutes qui suivent le réveil.7 Des anomalies plus marquées de la transition sommeil-veille peuvent conduire à des états dissociés où coexistent à la fois des éléments relatifs à la veille et au sommeil.8 On peut citer par exemple le somnambulisme (état dissocié entre le sommeil lent profond et la veille) ou la paralysie de sommeil (état dissocié entre le sommeil paradoxal et la veille).
L’endormissement s’effectue le plus souvent chez l’adulte sain de la veille vers le sommeil lent. L’endormissement en sommeil paradoxal est plus rare, hormis chez le nouveau-né et le nourrisson. Chez l’enfant et l’adulte, l’endormissement en sommeil paradoxal peut s’observer lors d’éveils brefs au cours d’une phase de sommeil paradoxal, surtout en fin de nuit et au petit matin. Des contraintes environnementales conduisant à un besoin anormalement élevé de sommeil paradoxal (comme dans le cadre d’une privation chronique de sommeil ou d’une levée brutale d’inhibition du sommeil paradoxal à la suite d’un sevrage médicamenteux en anti-dépresseur) peuvent également favoriser une transition directe de la veille vers ce stade de sommeil. L’endormissement en sommeil paradoxal peut enfin être le témoin d’un dysfonctionnement primaire des systèmes de régulation du sommeil et de la veille. Il s’observe notamment dans la cadre de la narcolepsie.
D’un point de vue comportemental, le réveil est défini par un retour à un état de conscience, de ses capacités perceptuelles et d’interaction avec son environnement. D’un point de vue électrophysiologique, le réveil est défini par la transition d’un état de sommeil à un état de veille, caractérisé par une accélération brutale de l’activité EEG et une augmentation du tonus musculaire pendant au moins 3 secondes. Il est classique de distinguer le réveil du micro-éveil, définis selon leur durée, plus ou moins de 15 secondes, respectivement. L’individu n’a généralement pas conscience de la survenue d’un micro-éveil, pouvant survenir jusqu’à 10 fois par heure de sommeil en l’absence de conditions pathologiques.
De même que pour l’endormissement, la transition du sommeil vers la veille ne s’effectue pas de façon homogène pour l’ensemble des structures cérébrales.6 Cette dissociation peut expliquer le phénomène d’inertie du sommeil, caractérisée par une difficulté à se sentir pleinement éveillé et opérationnel dans les minutes qui suivent le réveil.7 Des anomalies plus marquées de la transition sommeil-veille peuvent conduire à des états dissociés où coexistent à la fois des éléments relatifs à la veille et au sommeil.8 On peut citer par exemple le somnambulisme (état dissocié entre le sommeil lent profond et la veille) ou la paralysie de sommeil (état dissocié entre le sommeil paradoxal et la veille).
Durée et répartition du sommeil de nuit
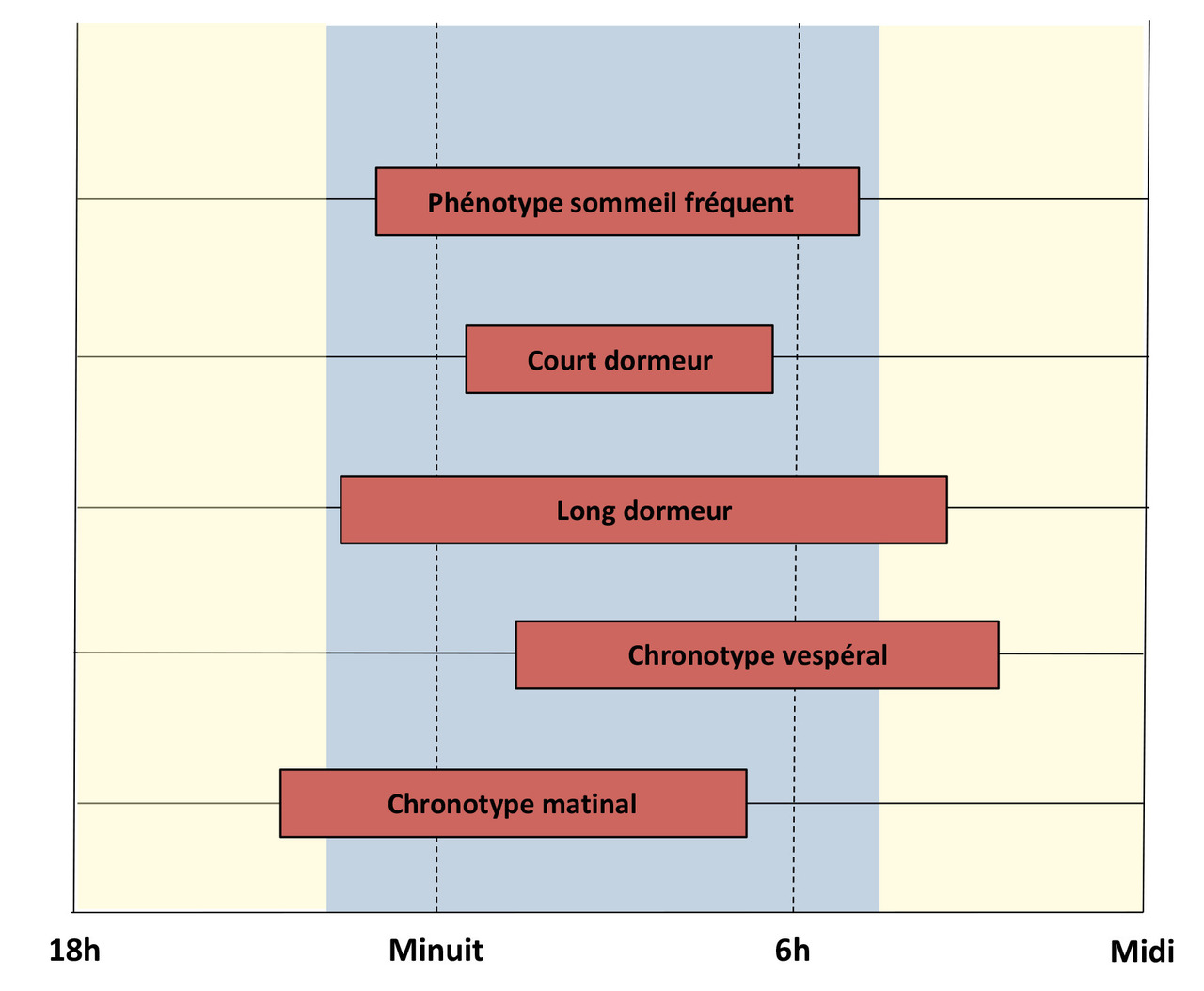
Chez l’adulte jeune, le besoin de sommeil est globalement de 7 h 30 les jours de semaine et de 8 h 30 les jours de repos, avec cependant une grande variabilité interindividuelle. Les variantes extrêmes de durée de sommeil de nuit définissent les sujets « courts dormeurs » (moins de 6 heures) et les sujets « longs dormeurs » (plus de 9 heures) [fig. 2 ]. Contrairement à l’insomnie et l’hypersomnie, ces deux conditions sont considérées comme non pathologiques dans la mesure où elles n’induisent pas de perturbations du fonctionnement diurne. La durée du sommeil de nuit dépend de facteurs comportementaux, environnementaux, physiologiques et génétiques. Le contrôle volontaire par la personne apparaît comme le plus important. La durée de sommeil pour un individu donné dépend aussi de son besoin intrinsèque de sommeil, déterminé en fonction de l’âge mais également sous l’influence de facteurs génétiques. Des études menées au sein de cohortes de jumeaux révèlent que la durée de sommeil est un trait dont l’héritabilité est estimée entre 30 et 44 % chez l’adulte et jusqu’à 66 % chez l’enfant.9-11 Des variants alléliques de plusieurs gènes ont été reliés à la durée du sommeil avec cependant des effets modérés rapportés à ce jour.
Chez l’adulte jeune et d’âge moyen, le sommeil nocturne se répartit préférentiellement dans une plage horaire comprise entre 23 h et 8 h du matin. Comme la durée du sommeil, sa répartition préférentielle au cours des 24 heures est sous l’influence conjointe de facteurs comportementaux, environnementaux et de l’âge. Certains sujets se définissent comme étant du matin, alors que d’autres sont plutôt du soir (fig. 2 ). Cette préférence nycthémérale définit le chronotype matinal ou vespéral qui apparaît être fortement associé à des variants alléliques de gènes dits « horloges », responsables de la régulation du rythme circadien comme CLOCK, PER2, CSNK1D ou PER3. L’altération du fonctionnement de l’individu en lien avec son chronotype extrême définit les troubles des rythmes veille-sommeil, classiquement le syndrome d’avance ou de retard de phase du sommeil.
Chez l’adulte jeune et d’âge moyen, le sommeil nocturne se répartit préférentiellement dans une plage horaire comprise entre 23 h et 8 h du matin. Comme la durée du sommeil, sa répartition préférentielle au cours des 24 heures est sous l’influence conjointe de facteurs comportementaux, environnementaux et de l’âge. Certains sujets se définissent comme étant du matin, alors que d’autres sont plutôt du soir (f
Sommeil de jour et somnolence diurne
À l’image de la faim et de la soif, la somnolence est un état participant à la régulation du besoin de sommeil de l’individu. Elle est caractérisée par une expérience subjective et/ou des manifestations comportementales dont la présence et l’intensité modulent la propension à l’endormissement et le maintien du sommeil. Chez le sujet sain, la somnolence est un état réversible qui diminue après obtention d’un temps de sommeil adéquat.
La somnolence diurne excessive peut être définie comme une incapacité à rester éveillé et alerte pendant les périodes de veille durant la journée, ce qui entraîne des épisodes de besoin irrépressible de dormir ou des accès de sommeil non intentionnels, survenant à des horaires ou dans des circonstances inadaptés.12 Sa sévérité est variable, la somnolence diurne excessive peut survenir dans des situations monotones ou passives (transport en commun, réunions, etc.), mais aussi en pleine activité et notamment lors de la conduite automobile. La somnolence diurne excessive doit être différenciée de la fatigue, même si ces deux symptômes peuvent être associés. La fatigue est une sensation d’affaiblissement physique ou psychique, qui n’est pas toujours réversible par la mise au repos, du moins à court terme. La somnolence est un symptôme fréquent en population générale, souvent physiologique, parfois associé à une simple privation de sommeil, mais elle peut aussi être le symptôme principal de maladies fréquentes tel le syndrome d’apnées du sommeil ou des maladies rares comme les hypersomnies centrales dont la narcolepsie.13
La somnolence diurne excessive peut être définie comme une incapacité à rester éveillé et alerte pendant les périodes de veille durant la journée, ce qui entraîne des épisodes de besoin irrépressible de dormir ou des accès de sommeil non intentionnels, survenant à des horaires ou dans des circonstances inadaptés.12 Sa sévérité est variable, la somnolence diurne excessive peut survenir dans des situations monotones ou passives (transport en commun, réunions, etc.), mais aussi en pleine activité et notamment lors de la conduite automobile. La somnolence diurne excessive doit être différenciée de la fatigue, même si ces deux symptômes peuvent être associés. La fatigue est une sensation d’affaiblissement physique ou psychique, qui n’est pas toujours réversible par la mise au repos, du moins à court terme. La somnolence est un symptôme fréquent en population générale, souvent physiologique, parfois associé à une simple privation de sommeil, mais elle peut aussi être le symptôme principal de maladies fréquentes tel le syndrome d’apnées du sommeil ou des maladies rares comme les hypersomnies centrales dont la narcolepsie.13
Régulation des états de veille et de sommeil
Le sommeil est un processus dynamique et adaptable aux besoins de l’organisme. La régulation des cycles veille-sommeil, le moment où l’on dort, ainsi que la continuité et la durée du sommeil et de l’éveil sont sous l’influence de trois processus en interaction mutuelle : homéostatique (processus S), circadien (processus C), et ultradien.
Régulation homéostatique
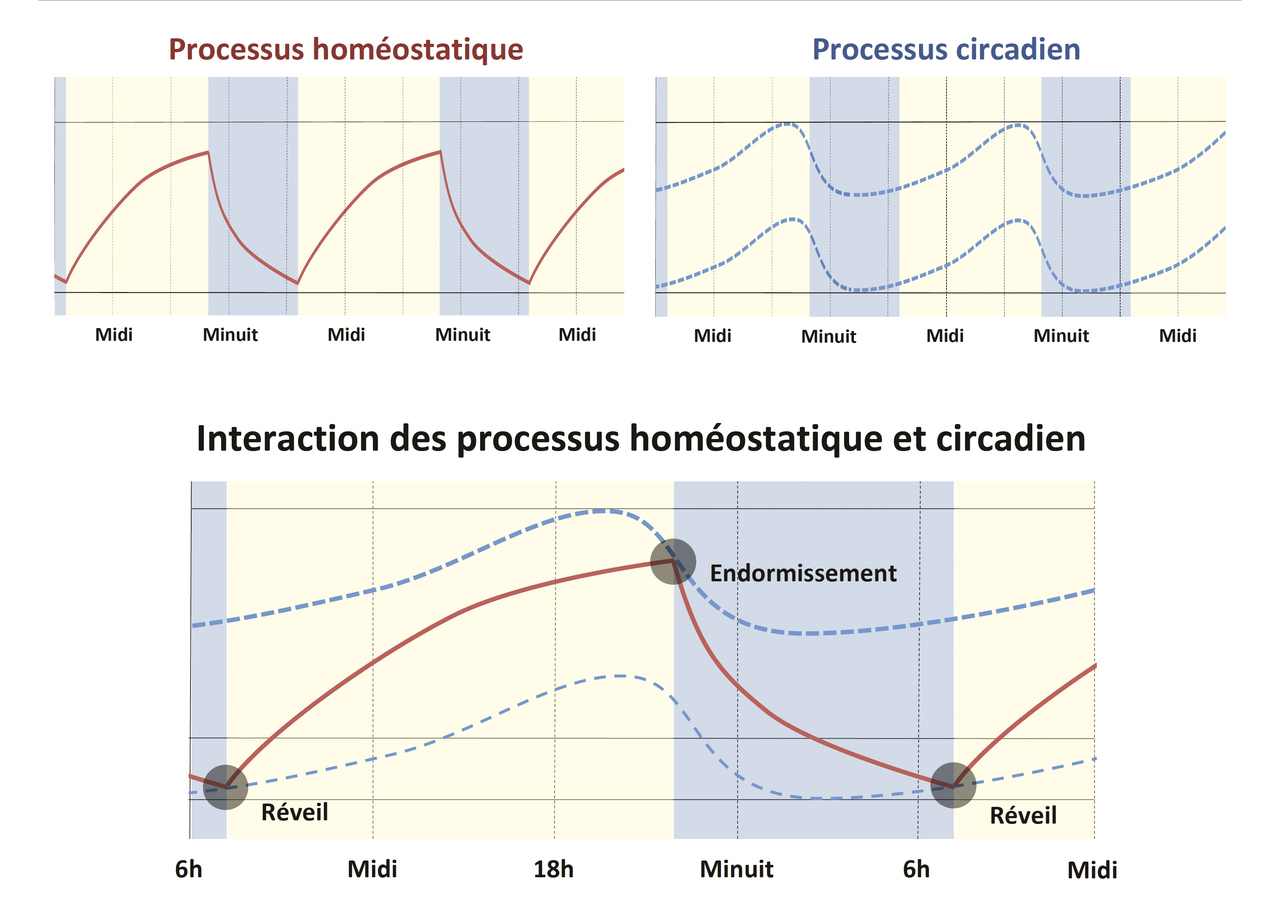
Le processus S correspond au besoin de sommeil accumulé progressivement au cours de la veille. Il augmente en fonction du temps d’éveil et diminue ainsi durant le sommeil. Ses effets sont particulièrement visibles lors de situations de privation de sommeil. Le lendemain d’une nuit blanche, on observe notamment un rebond compensateur de sommeil caractérisé par une augmentation de la durée du sommeil, avec en particulier une augmentation de l’intensité du sommeil lent profond (mesurée par l’activité à ondes lentes) lors du sommeil de récupération. D’un point de vue physiologique, les acteurs du système de la régulation homéostatique sont complexes, nombreux et encore mal connus. Parmi eux, le système adénosinergique,14 certaines prostaglandines et neuropeptides comme la cortistatine semblent jouer un rôle important dans cette régulation.
Régulation circadienne
Le processus C est indépendant du sommeil, mais influence sa survenue, sa durée et sa qualité, par la phase du rythme circadien. Cette phase est déterminée par l’horloge biologique dont le rythme est endogène et proche de 24 heures, mais entraîné par des synchroniseurs externes, le principal étant l’alternance lumière/obscurité. L’oscillateur circadien module ainsi la propension au sommeil au cours des 24 heures. La somnolence augmente ainsi en début d’après-midi, et elle est majeure au milieu de la nuit, entre 2 h et 5 h du matin. À l’inverse, le processus C détermine un niveau d’éveil maximal en fin de journée, entre 17 h et 20 h.
Le système circadien (du latin circa qui signifie « proche de », et dies « jour ») existe chez presque tous les organismes vivants. Ce système régule non seulement le cycle veille-sommeil mais aussi de nombreuses autres fonctions. Parmi celles-ci, on peut citer : les performances physiques et intellectuelles (performances cognitives, mémoire), les activités biologiques comme certaines sécrétions hormonales (cortisol, mélatonine), la régulation de la température interne, le système nerveux autonome, et, à une autre échelle, le contrôle de la division cellulaire et la réparation de l’ADN.
L’horloge biologique interne se situe chez les mammifères dans l’hypothalamus, au niveau des noyaux suprachiasmatiques. Il s’agit d’une structure paire contenant approximati-vement 20 000 neurones. Cette horloge sert de chef d’orchestre favorisant la synchronisation des horloges cellulaires périphériques, présentes dans chacune des cellules de l’organisme. Elle est constituée par l’interaction de plusieurs gènes dits « gènes horloge » responsables d’une activité cyclique, proche de 24 heures qui, via la synthèse d’ARNm et de protéines, déterminent des boucles moléculaires d’autorégulation. En résumé, les protéines BMAL1 et CLOCK forment un hétérodimère qui active la transcription des gènes de l’horloge PER, CRY, RORγ et REV-ERBα. Les protéines PER et CRY s’accumulent progressivement jusqu’à un niveau critique, et elles forment alors un complexe avec le dimère BMAL1-CLOCK, ce qui inhibe leur propre transcription.15 La vitesse à laquelle ces boucles moléculaires sont exécutées détermine la période endogène de l’horloge, caractéristique de chaque individu. Le prix Nobel de physiologie et de médecine 2017 a récompensé trois chercheurs américains, Jeffrey Hall, Michael Rosbash et Michael Young, qui ont découvert et décrit ces mécanismes moléculaires à l’origine des rythmes circadiens.
La période endogène de l’horloge est proche de 24 heures : en moyenne de 24,2 heures chez l’homme. Cette horloge doit être constamment « remise à l’heure » par des synchroniseurs externes pour fonctionner sur 24 heures. En l’absence de ceux-ci, quand l’organisme est placé dans des conditions constantes, l’horloge fonctionne en libre cours, oscillant selon sa propre période endogène, et peut donc prendre du retard (le plus fréquent, si la période est au-delà de 24 heures) ou de l’avance (si elle est en-deçà de 24 heures). Près de 95 % de la population a une période entre 23 h 30 et 24 h 30, 75 % des individus ont une période entre 24 h et 24 h 30, et 25 % entre 23 h 30 et 24 h.
Divers types de synchroniseurs externes sont identifiés, comme l’alimentation, l’activité physique ou les rythmes sociaux. Toutefois, le plus important d’entre eux est l’alternance lumière-obscurité (ou synchroniseur photique). Cette information photique emprunte des voies non visuelles depuis les cellules ganglionnaires à mélanopsine de la rétine vers les noyaux suprachiasmatiques. Les effets de la lumière sur le système circadien dépendent de son intensité, de la durée de l’exposition, de son spectre, et de l’heure à laquelle elle est perçue. Plus le stimulus lumineux est intense, plus la durée est longue, plus l’effet est important. Par exemple, pour un stimulus à 10 lux (lumière d’une bougie), l’effet est indétectable. Avec une intensité de 10 000 lux pendant 6,5 heures, on observe un retard de sécrétion de la mélatonine de plus de 2 heures. Le système circadien est surtout sensible à une lumière de longueur d’onde comprise entre 460 et 480 nm, c’est-à-dire la lumière bleue.
Le système circadien (du latin circa qui signifie « proche de », et dies « jour ») existe chez presque tous les organismes vivants. Ce système régule non seulement le cycle veille-sommeil mais aussi de nombreuses autres fonctions. Parmi celles-ci, on peut citer : les performances physiques et intellectuelles (performances cognitives, mémoire), les activités biologiques comme certaines sécrétions hormonales (cortisol, mélatonine), la régulation de la température interne, le système nerveux autonome, et, à une autre échelle, le contrôle de la division cellulaire et la réparation de l’ADN.
L’horloge biologique interne se situe chez les mammifères dans l’hypothalamus, au niveau des noyaux suprachiasmatiques. Il s’agit d’une structure paire contenant approximati-vement 20 000 neurones. Cette horloge sert de chef d’orchestre favorisant la synchronisation des horloges cellulaires périphériques, présentes dans chacune des cellules de l’organisme. Elle est constituée par l’interaction de plusieurs gènes dits « gènes horloge » responsables d’une activité cyclique, proche de 24 heures qui, via la synthèse d’ARNm et de protéines, déterminent des boucles moléculaires d’autorégulation. En résumé, les protéines BMAL1 et CLOCK forment un hétérodimère qui active la transcription des gènes de l’horloge PER, CRY, RORγ et REV-ERBα. Les protéines PER et CRY s’accumulent progressivement jusqu’à un niveau critique, et elles forment alors un complexe avec le dimère BMAL1-CLOCK, ce qui inhibe leur propre transcription.15 La vitesse à laquelle ces boucles moléculaires sont exécutées détermine la période endogène de l’horloge, caractéristique de chaque individu. Le prix Nobel de physiologie et de médecine 2017 a récompensé trois chercheurs américains, Jeffrey Hall, Michael Rosbash et Michael Young, qui ont découvert et décrit ces mécanismes moléculaires à l’origine des rythmes circadiens.
La période endogène de l’horloge est proche de 24 heures : en moyenne de 24,2 heures chez l’homme. Cette horloge doit être constamment « remise à l’heure » par des synchroniseurs externes pour fonctionner sur 24 heures. En l’absence de ceux-ci, quand l’organisme est placé dans des conditions constantes, l’horloge fonctionne en libre cours, oscillant selon sa propre période endogène, et peut donc prendre du retard (le plus fréquent, si la période est au-delà de 24 heures) ou de l’avance (si elle est en-deçà de 24 heures). Près de 95 % de la population a une période entre 23 h 30 et 24 h 30, 75 % des individus ont une période entre 24 h et 24 h 30, et 25 % entre 23 h 30 et 24 h.
Divers types de synchroniseurs externes sont identifiés, comme l’alimentation, l’activité physique ou les rythmes sociaux. Toutefois, le plus important d’entre eux est l’alternance lumière-obscurité (ou synchroniseur photique). Cette information photique emprunte des voies non visuelles depuis les cellules ganglionnaires à mélanopsine de la rétine vers les noyaux suprachiasmatiques. Les effets de la lumière sur le système circadien dépendent de son intensité, de la durée de l’exposition, de son spectre, et de l’heure à laquelle elle est perçue. Plus le stimulus lumineux est intense, plus la durée est longue, plus l’effet est important. Par exemple, pour un stimulus à 10 lux (lumière d’une bougie), l’effet est indétectable. Avec une intensité de 10 000 lux pendant 6,5 heures, on observe un retard de sécrétion de la mélatonine de plus de 2 heures. Le système circadien est surtout sensible à une lumière de longueur d’onde comprise entre 460 et 480 nm, c’est-à-dire la lumière bleue.
Interaction des deux processus
En condition physiologique, les processus circadien et homéostatique sont en phase, les rythmes activité-repos et l’alternance jour-nuit sont concordants. Lorsque les deux processus ne sont plus en phase, les rythmes veille-sommeil se détériorent, à l’origine de symptômes observés lors du décalage horaire et chez les travailleurs postés.
Les processus homéostatique et circadien interagissent entre eux pour réguler l’alternance veille-sommeil. Le modèle original de Borbely postule que ces deux processus sont indépendants et leurs effets additifs.16, 17 Pendant la veille, le processus homéostatique augmente progressivement jusqu’à atteindre le seuil haut du processus circadien, moment de l’endormissement. Pendant le sommeil, le processus homéostatique décroît jusqu’à atteindre le seuil bas du processus circadien, moment du réveil. Le processus C génère une propension à l’éveil et au sommeil en interaction avec celle du processus S. L’accumulation de la pression de sommeil s’oppose à l’augmentation de la « pression de l’éveil » (processus circadien) qui est maximale en fin de journée. Au début de la sécrétion de la mélatonine, la pression de l’éveil diminue brusquement, et l’endormissement survient, car la pression du sommeil est élevée. Au petit matin, la pression de sommeil est au plus bas, mais la pression de l’éveil est basse elle aussi, ce qui permet de prolonger la durée du sommeil. C’est finalement la remontée de la pression de l’éveil le matin qui induit le réveil. Cette interaction complexe permet de maintenir consolidés l’éveil et le sommeil, avec des périodes de sommeil de 7 à 8 heures, puis des périodes d’éveil de plus de 16 heures, et ce malgré l’accumulation de la pression de sommeil.
Les processus homéostatique et circadien interagissent entre eux pour réguler l’alternance veille-sommeil. Le modèle original de Borbely postule que ces deux processus sont indépendants et leurs effets additifs.16, 17 Pendant la veille, le processus homéostatique augmente progressivement jusqu’à atteindre le seuil haut du processus circadien, moment de l’endormissement. Pendant le sommeil, le processus homéostatique décroît jusqu’à atteindre le seuil bas du processus circadien, moment du réveil. Le processus C génère une propension à l’éveil et au sommeil en interaction avec celle du processus S. L’accumulation de la pression de sommeil s’oppose à l’augmentation de la « pression de l’éveil » (processus circadien) qui est maximale en fin de journée. Au début de la sécrétion de la mélatonine, la pression de l’éveil diminue brusquement, et l’endormissement survient, car la pression du sommeil est élevée. Au petit matin, la pression de sommeil est au plus bas, mais la pression de l’éveil est basse elle aussi, ce qui permet de prolonger la durée du sommeil. C’est finalement la remontée de la pression de l’éveil le matin qui induit le réveil. Cette interaction complexe permet de maintenir consolidés l’éveil et le sommeil, avec des périodes de sommeil de 7 à 8 heures, puis des périodes d’éveil de plus de 16 heures, et ce malgré l’accumulation de la pression de sommeil.
Régulation ultradienne
Le sommeil est également sous l’influence d’un oscillateur ultradien, plus rapide que le rythme circadien, d’environ 90 minutes. Il participe en particulier à son organisation cyclique. Ce processus ultradien influence par ailleurs les niveaux de vigilance au cours de la veille, responsable de fluctuations cycliques du niveau d’éveil. Ses mécanismes physiologiques sous-jacents restent encore mal connus.
Évolution du sommeil avec l’âge
Outre les facteurs de prédisposition génétique, l’âge constitue un facteur déterminant majeur de l’organisation normale du sommeil.18 Il implique des facteurs d’ordre neurodéveloppemental chez l’enfant et des facteurs liés au vieillissement normal chez la personne âgée.
Sommeil de l’enfant
Le sommeil de l’enfant est un témoin des diverses étapes de la maturation cérébrale. Sa structure, son organisation, sa durée et sa répartition au cours des 24 heures évolue rapidement de la naissance à l’adolescence.19
L’organisation du sommeil du nouveau-né est très particulière. Les caractéristiques du sommeil lent et du sommeil paradoxal ne sont pas encore acquises, on parle de sommeil calme et de sommeil agité. De plus, ces états ne sont pas encore mutuellement exclusifs, il est ainsi décrit un sommeil dit transitionnel. Le sommeil agité, qui deviendra le sommeil paradoxal, est remarquable par une activité EEG identique à celle de la veille, une activité musculaire phasique abondante prédominant au niveau de la face et des extrémités, des fréquences respiratoire et cardiaque irrégulières. Le sommeil calme se distingue par une activité alternante, caractérisée par des bouffées d’ondes lentes à prédominance antérieure séparées par des phases d’activité irrégulière et de faible amplitude. La maturation des systèmes responsables du sommeil calme conduira à la différenciation progressive du sommeil lent léger et du sommeil lent profond. De façon remarquable, le nouveau-né s’endort en sommeil agité aussi bien le jour que la nuit. Il dort en moyenne 16 à 18 heures, dont 40 à 50 % passées en sommeil agité, 30 à 40 % en sommeil calme et 10 à 15 % en sommeil transitionnel. Les périodes de veille et de sommeil sont également distribuées entre le jour et la nuit pendant les deux premières semaines, du fait de l’absence de régulation circadienne de l’alternance veille-sommeil.
Les caractéristiques du sommeil évoluent ensuite rapidement. La quantité totale de sommeil sur les 24 heures diminue, avec une répartition préférentielle du sommeil sur la nuit. Le tracé alternant du sommeil calme disparaît vers 6 semaines et laisse place à une activité corticale lente, irrégulière et continue. La maturation des voies thalamocorticales se traduit par l’apparition des fuseaux, avec le sommeil lent léger et lent profond qui commencent à s’identifier vers l’âge de 3 mois. Avant 6 mois, le sommeil transitionnel disparaît, et le sommeil agité laisse place au sommeil paradoxal tel qu’on le connaît chez l’enfant et l’adulte. Sa latence d’apparition après l’endormissement augmente progressivement. La proportion de sommeil lent augmente parallèlement à la diminution du sommeil paradoxal.
À l’âge de 1 an, la durée moyenne du sommeil est de 12 à 14 heures comprenant en général deux épisodes de sommeil diurne. Toutefois, cette organisation de la veille et du sommeil est très dépendante de l’environnement, de la relation mère-enfant, de l’alternance jour-nuit et de l’horaire des prises alimentaires. Entre l’âge de 1 et 3 ans, le sommeil lent acquiert ses caractéristiques définitives, avec une différenciation des stades N1, N2 et N3. Avant l’âge de 2 ans, l’enfant n’a généralement plus qu’un seul accès de sommeil diurne. Cette sieste disparaît souvent entre 4 et 6 ans.
L’organisation du sommeil du nouveau-né est très particulière. Les caractéristiques du sommeil lent et du sommeil paradoxal ne sont pas encore acquises, on parle de sommeil calme et de sommeil agité. De plus, ces états ne sont pas encore mutuellement exclusifs, il est ainsi décrit un sommeil dit transitionnel. Le sommeil agité, qui deviendra le sommeil paradoxal, est remarquable par une activité EEG identique à celle de la veille, une activité musculaire phasique abondante prédominant au niveau de la face et des extrémités, des fréquences respiratoire et cardiaque irrégulières. Le sommeil calme se distingue par une activité alternante, caractérisée par des bouffées d’ondes lentes à prédominance antérieure séparées par des phases d’activité irrégulière et de faible amplitude. La maturation des systèmes responsables du sommeil calme conduira à la différenciation progressive du sommeil lent léger et du sommeil lent profond. De façon remarquable, le nouveau-né s’endort en sommeil agité aussi bien le jour que la nuit. Il dort en moyenne 16 à 18 heures, dont 40 à 50 % passées en sommeil agité, 30 à 40 % en sommeil calme et 10 à 15 % en sommeil transitionnel. Les périodes de veille et de sommeil sont également distribuées entre le jour et la nuit pendant les deux premières semaines, du fait de l’absence de régulation circadienne de l’alternance veille-sommeil.
Les caractéristiques du sommeil évoluent ensuite rapidement. La quantité totale de sommeil sur les 24 heures diminue, avec une répartition préférentielle du sommeil sur la nuit. Le tracé alternant du sommeil calme disparaît vers 6 semaines et laisse place à une activité corticale lente, irrégulière et continue. La maturation des voies thalamocorticales se traduit par l’apparition des fuseaux, avec le sommeil lent léger et lent profond qui commencent à s’identifier vers l’âge de 3 mois. Avant 6 mois, le sommeil transitionnel disparaît, et le sommeil agité laisse place au sommeil paradoxal tel qu’on le connaît chez l’enfant et l’adulte. Sa latence d’apparition après l’endormissement augmente progressivement. La proportion de sommeil lent augmente parallèlement à la diminution du sommeil paradoxal.
À l’âge de 1 an, la durée moyenne du sommeil est de 12 à 14 heures comprenant en général deux épisodes de sommeil diurne. Toutefois, cette organisation de la veille et du sommeil est très dépendante de l’environnement, de la relation mère-enfant, de l’alternance jour-nuit et de l’horaire des prises alimentaires. Entre l’âge de 1 et 3 ans, le sommeil lent acquiert ses caractéristiques définitives, avec une différenciation des stades N1, N2 et N3. Avant l’âge de 2 ans, l’enfant n’a généralement plus qu’un seul accès de sommeil diurne. Cette sieste disparaît souvent entre 4 et 6 ans.
Sommeil de la personne âgée
Avec le vieillissement physiologique, le sommeil subit un certain de nombre de modifications, à la fois sur le plan de son architecture, sa durée et sa répartition nycthémérale.20 On observe aussi une altération de la continuité du sommeil caractérisée par une augmentation du nombre d’éveils, une diminution du sommeil lent profond et plus tardive du sommeil paradoxal. Enfin, avec l’âge, on assiste à une avance de phase du sommeil, avec un coucher et un lever plus précoce, ainsi qu’à l’augmentation de nombreuses pathologies du sommeil comme l’insomnie, le syndrome des jambes sans repos et le syndrome d’apnées du sommeil.
NOMBREUX DÉVELOPPEMENTS EN COURS
Au cours des 50 dernières années des avancées majeures ont été réalisées dans la reconnaissance des différents états et stades de sommeil, et l’utilisation d’un système uniforme d’analyse du sommeil a permis l’établissement d’un langage commun entre spécialistes du sommeil, chercheurs ou cliniciens. Ce système d’analyse connaît cependant un certain nombre de limites, d’où la nécessité de développer de nouvelles méthodes d’interprétation du sommeil permettant de se rapprocher des phénomènes physiologiques mais aussi pathologiques. Ces développements sont en cours et devraient s’intensifier avec l’avènement de l’intelligence artificielle. Le sommeil est relativement stable chez un individu donné, particulièrement bien régulé par des mécanismes complexes et étroitement intriqués ; toutefois, il varie en durée et en architecture selon l’âge, les habitudes individuelles, les horaires de sommeil et l’environnement. De nombreuses pathologies du sommeil existent cependant, qu’il faut savoir dépister, diagnostiquer et prendre en charge. Une meilleure connaissance de la physiologie du sommeil permettra de mieux comprendre certains dysfonctionnements particulièrement fréquents au cours du sommeil et d’envisager à l’avenir une prise en charge plus adaptée.
Références
1. Krueger JM, Frank MG, Wisor JP, Roy S. Sleep function: toward elucidating an enigma. Sleep Med Rev 2016;28:46-54.
2. Jessen NA, Munk ASF, Lundgaard I, Nedergaard M. The glymphatic system: a beginner’s guide. Neurochem Res 2015;40:2583‑99.
3. Carskadon MA, Dement WC. Normal human sleep: an overview. Princ Pract Sleep Med 2005;4:13-23.
4. Peever J, Fuller PM. The biology of REM sleep. Curr Bio. 2017;27:R1237-48.
5. Magnin M, Rey M, Bastuji H, Guillemant P, Mauguière F, Garcia-Larrea L. Thalamic deactivation at sleep onset precedes that of the cerebral cortex in humans. Proc Natl Acad Sci 2010;107:3829-33.
6. Nobili L, De Gennaro L, Proserpio P, et al. Local aspects of sleep: observations from intracerebral recordings in humans. In: Progress in brain research. Elsevier, 2012:219-32.
7. Trotti LM. Waking up is the hardest thing I do all day: Sleep inertia and sleep drunkenness. Sleep Med Rev 2017;35:76-84.
8. Antelmi E, Ferri R, Iranzo A, et al. From state dissociation to status dissociatus. Sleep Med Rev 2016;28:5-17.
9. Partinen M, Kaprio J, Koskenvuo M, Putkonen P, Langinvainio H. Genetic and environmental determination of human sleep. Sleep 1983;6:179-85.
10. Heath AC, Kendler KS, Eaves LJ, Martin NG. Evidence for genetic influences on sleep disturbance and sleep pattern in twins. Sleep 1990;13:318-35.
11. Fisher A, van Jaarsveld CH, Llewellyn CH, Wardle J. Genetic and environmental influences on infant sleep. Pediatrics 2012;129:1091.
12. Dauvilliers Y, Lopez R, Lecendreux M. French consensus. Hypersomnolence: Evaluation and diagnosis. Rev Neurol (Paris) 2017;173:19‑24.
13. Dauvilliers Y, Arnulf I, Mignot E. Narcolepsy with cataplexy. Lancet 2007;369:499-511.
14. Greene RW, Bjorness TE, Suzuki A. The adenosine-mediated, neuronal-glial, homeostatic sleep response. Curr Opin Neurobiol 2017;44:236-42.
15. Blum ID, Bell B, Wu MN. Time for bed: genetic mechanisms mediating the circadian regulation of sleep. Trends Genet 2018;34:379-88.
16. Borbély A. A two process model of sleep regulation. Hum Neurobiol 1982;1:195‑204.
17. Borbély AA, Daan S, Wirz-Justice A, Deboer T. The two-process model of sleep regulation: a reappraisal. J Sleep Res 2016;25:131-43.
18. Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep 2004;27:1255-73.
19. Eisermann M, Kaminska A, Moutard ML, Soufflet C, Plouin P. Normal EEG in childhood: from neonates to adolescents. Neurophysiol Clin Neurophysiol 2013;43:35-65.
20. Mander BA, Winer JR, Walker MP. Sleep and human aging. Neuron 2017;94:19-36.
2. Jessen NA, Munk ASF, Lundgaard I, Nedergaard M. The glymphatic system: a beginner’s guide. Neurochem Res 2015;40:2583‑99.
3. Carskadon MA, Dement WC. Normal human sleep: an overview. Princ Pract Sleep Med 2005;4:13-23.
4. Peever J, Fuller PM. The biology of REM sleep. Curr Bio. 2017;27:R1237-48.
5. Magnin M, Rey M, Bastuji H, Guillemant P, Mauguière F, Garcia-Larrea L. Thalamic deactivation at sleep onset precedes that of the cerebral cortex in humans. Proc Natl Acad Sci 2010;107:3829-33.
6. Nobili L, De Gennaro L, Proserpio P, et al. Local aspects of sleep: observations from intracerebral recordings in humans. In: Progress in brain research. Elsevier, 2012:219-32.
7. Trotti LM. Waking up is the hardest thing I do all day: Sleep inertia and sleep drunkenness. Sleep Med Rev 2017;35:76-84.
8. Antelmi E, Ferri R, Iranzo A, et al. From state dissociation to status dissociatus. Sleep Med Rev 2016;28:5-17.
9. Partinen M, Kaprio J, Koskenvuo M, Putkonen P, Langinvainio H. Genetic and environmental determination of human sleep. Sleep 1983;6:179-85.
10. Heath AC, Kendler KS, Eaves LJ, Martin NG. Evidence for genetic influences on sleep disturbance and sleep pattern in twins. Sleep 1990;13:318-35.
11. Fisher A, van Jaarsveld CH, Llewellyn CH, Wardle J. Genetic and environmental influences on infant sleep. Pediatrics 2012;129:1091.
12. Dauvilliers Y, Lopez R, Lecendreux M. French consensus. Hypersomnolence: Evaluation and diagnosis. Rev Neurol (Paris) 2017;173:19‑24.
13. Dauvilliers Y, Arnulf I, Mignot E. Narcolepsy with cataplexy. Lancet 2007;369:499-511.
14. Greene RW, Bjorness TE, Suzuki A. The adenosine-mediated, neuronal-glial, homeostatic sleep response. Curr Opin Neurobiol 2017;44:236-42.
15. Blum ID, Bell B, Wu MN. Time for bed: genetic mechanisms mediating the circadian regulation of sleep. Trends Genet 2018;34:379-88.
16. Borbély A. A two process model of sleep regulation. Hum Neurobiol 1982;1:195‑204.
17. Borbély AA, Daan S, Wirz-Justice A, Deboer T. The two-process model of sleep regulation: a reappraisal. J Sleep Res 2016;25:131-43.
18. Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep 2004;27:1255-73.
19. Eisermann M, Kaminska A, Moutard ML, Soufflet C, Plouin P. Normal EEG in childhood: from neonates to adolescents. Neurophysiol Clin Neurophysiol 2013;43:35-65.
20. Mander BA, Winer JR, Walker MP. Sleep and human aging. Neuron 2017;94:19-36.